Плоскоклеточный рак слизистой оболочки полости рта (СОПР) является распространенным злокачественным новообразованием эпителия с высокой заболеваемостью и смертностью [1]. Распространенность рака полости рта в России в 2019 г. составила 29,7 на 100 000 населения. Индекс накопления контингента больных со злокачественными новообразованиями полости рта за 2009–2019 гг. в России составил 5,0. Удельный вес злокачественных новообразований полости рта, выявленных в запущенной IV стадии, из числа впервые выявленных злокачественных новообразований в 2019 г. в России составил 34,4% [2]. Несмотря на достижения в диагностике и лечении рака СОПР, заболевание по-прежнему отличается низкой пятилетней выживаемостью, которая составляет 30–50% [1]. В результате исследований последних лет выявлено, что клинический и гистологический статус при раке СОПР может не отражать повреждения, происходящие на генетическом уровне. Это фенотипическое и генотипическое несоответствие может частично объяснить неэффективность прогноза и организации протокола наблюдения за пациентами с раком СОПР, основанного на традиционных клинических и микроскопических исследованиях [3]. В связи с этим обстоятельством в нашей работе была предпринята попытка объединения иммуногистохимических и генетических методик контроля изменений факторов репарации ДНК в опухолевых клетках. Молекулярно-генетические методы все шире входят в практику современной онкологии [4]. С одной стороны, иммуногистохимическими методами характеризовали экспрессию в опухолевой ткани маркера клеточного цикла р53. Как известно, белок р53 блокирует клеточный цикл в G1-S фазе и тем самым ингибирует дальнейшую репликацию поврежденной ДНК, которая синтезируется именно в S фазе, и создает условия для удаления поврежденного места и репарации ее измененного участка [5]. С другой стороны, генетическими методами анализировали частоту полиморфных вариантов гена репарации XRCC3 [6]. Белок, кодируемый геном XRCC3, считается интегральным регулятором эксцизионной репарации оснований, необходимой для точечного удаления поврежденных оснований ДНК [7]. Продукт гена XRCC3 непосредственно взаимодействует с RAD51 С и RAD51D при репарации двухцепочечных разрывов [8]. Целью исследования явилось определить прогностическую значимость для развития летальных исходов комплексной оценки экспрессии в опухолевой ткани маркера р53 и полиморфных вариантов гена репарации XRCC3 у больных раком слизистой оболочки дна полости рта (СОДПР).
Материал и методы исследования
Исследование было одобрено Локальным независимым этическим комитетом ФГБУ «Национальный медицинский исследовательский центр онкологии» Минздрава России. В эпидемиологическую группу больных раком СОДПР вошли 232 человека из онкологического регистра Ростовской области с датой установки диагноза с 1989 г. и по 2020 г. Возраст пациентов эпидемиологической группы колебался от 32 до 87 лет, в среднем составлял 59,5±0,73 года (медиана 61 год). Женщин было 59 (25,4%), мужчин – 173 (74,6%). По гистологическому строению у всех больных был верифицирован плоскоклеточный рак.
Клиническая часть работы была проведена совместно: в ФГБОУ ВО «РостГМУ» Минздрава России и ФГБУ «НМИЦО» Минздрава России. Всего в исследование были включены 67 больных раком СОДПР обоего пола в возрасте от 45 до 80 лет. Средний возраст пациентов клинической группы составлял 65,2±1,4 года (медиана 63 года). По полу соотношение было 21 женщина (31,3%) и 46 мужчин (68,6%).
Критериями включения в клиническое исследование были: рак слизистой оболочки дна полости рта (МКБ С04); отсутствие до момента исследования специализированного лечения онкологического заболевания; негативная экспрессия p16INK4A в опухолевой ткани (<40%). Критериями исключения явились: стадии обострения воспалительных заболеваний полости рта; наличие тяжелой общесоматической патологии – ВИЧ, СПИДа, гепатита, декомпенсации соматических заболеваний.
Все пациенты подписывали добровольное информированное согласие на проведение исследования.
Для иммуногистохимического исследования брали ткани опухоли во время оперативного вмешательства. Исследуемые ткани были заморожены для дальнейшего хранения при температуре –70°С.
Экспрессию белка р53 в ткани оценивали иммуногистохимическим способом. Парафиновые срезы толщиной 4–6 мкм наносили на адгезивные предметные стекла SuperFrost Plus, депарафинировали и регидратировали по стандартной методике. «Демаскировку» антигенов проводили в PT-Link Thermo. Протокол включал в себя предварительный нагрев до 65ºС, восстановление антигена в течение 20 мин при температуре 97ºС и дальнейшее охлаждение до 65ºС. Затем стекла промывали в течение 1–3 мин TBS-буфером (Dako) и помещали в автостейнер Thermo Scientific для окрашивания в автоматическом режиме. Были использованы моноклональные антитела к р53 (cloneAb-5 (DO-7) LabVision в разведении 1:100.
Для визуализации иммуногистохимической реакции использовали систему детекции Reveal Polyvalent HRP-DAB Detection System. Оценку результатов окрашивания проводили с применением светового микроскопа «Leica» (Германия) под увеличением х10, х20, х40. В исследовании применяли следующие критерии оценки: опухоль считали отрицательной по р53, если в ткани опухоли отсутствовала ядерная реакция с антителами или количество окрашенных клеток было менее 25% (1+); 25–50% опухолевых клеток – 2+, 50–100% опухолевых клеток — 3+. Гиперэкспрессию р53 устанавливали при наличии реакции 3+.
Детекцию однонуклеотидных замен в гене XRCC3 в периферической крови проводили методом ПЦР в реальном времени. При этом использовали резонансное тушение флюоресценции в TaqMan системе. ДНК из образцов венозной крови выделяли классическим методом с помощью наборов QIAamp DNA Mini Kits (Qiagen). Количество выделенной ДНК определяли с помощью Qubit® 2.0 Fluorometer с использованием набора Molecular probes Qubit®ds DNA BR Assay kit («Life technologies», США). Для постановки ПЦР-РВ и проведения HRM-анализа геномная ДНК образцов была нормализована (концентрация 4 нг/мкл).
Для изучения однонуклеотидных последовательностей гена XRCC3 осуществляли HRM-анализ на приборе CFX96 («BioRad», США). Для амплификации фрагмента генов были использованы стандартные олигонуклеотидные праймеры. Реакционная смесь в общем объеме 25 мкл содержала 1х ПЦР мастер-микс («Синтол», Россия) с интеркалирующим красителем EvaGreen, 500 нМ каждого праймера и по 20 нг ДНК каждого образца. Условия проведения амплификации и HRM-анализа были следующими: 95°C – 5 мин; 35 циклов: 95°C – 10 с, 63°C – 30 с, 72°C – 15 с; 94°C – 1 мин, 72°C – 30 с; Melt Curve 72°C – 85°C: Increment 0,2°C – 5 с. Анализ результатов проводили с помощью программного обеспечения для HRM-анализа Precision Melt Analysis™ software. После определения генотипов методом HRM образцы из каждого кластера были секвенированы. Полученные ПЦР-продукты после HRM-анализа очищали с помощью набора реагентов Silica Bead DNA Gel Extraction Kit («Thermo scientific»). Секвенирующую ПЦР ставили с ипользованием BigDye® Terminator v3.1 Cycle Sequencing Kit («Applied Biosystems», США). Определение нуклеотидной последовательности проводили на генетическом анализаторе 3500 («Applied Biosystems», США). Генотипирование rs861539 XRCC3 Thr241 Met осуществляли с помощью праймеров Beacon Designer 7.0 (Premier Biosoft International).
Статистический анализ результатов исследования проводился с помощью программы STATISTICA 12.0 (StatSoft Inc., США).
Результаты исследования и их обсуждение
Среди 232 больных, включенных в онкологический регистр Ростовской области начиная с 1989 г., летальный исход наблюдали у 159 пациентов (68,5%), а 73 (31,5%) пациента были живы. Среди пациентов эпидемиологической группы у 9 (3,9%) больных диагностировали 1-ю стадию, у 52 (22,4%) – 2-ю стадию, у 63 (27,2%) – 3-ю стадию и у 108 (46,6%) пациентов – 4-ю стадию заболевания. Следовательно, на момент постановки диагноза у преобладающего числа больных (73,8%) наблюдали 3–4-ю стадию рака СОДПР.
После взятия на учет и постановки диагноза медиана дожития составляла 5,51±0,34 года. Следовательно, половина больных общей клинической группы в течение 5,51 года были живы. Через 7 лет медиана дожития сократилась вдвое и составила 2,3±0,39 года.
Общая выживаемость больных раком СОДПР клинической группы по методу Каплана–Мейера представлена на рисунке 1.
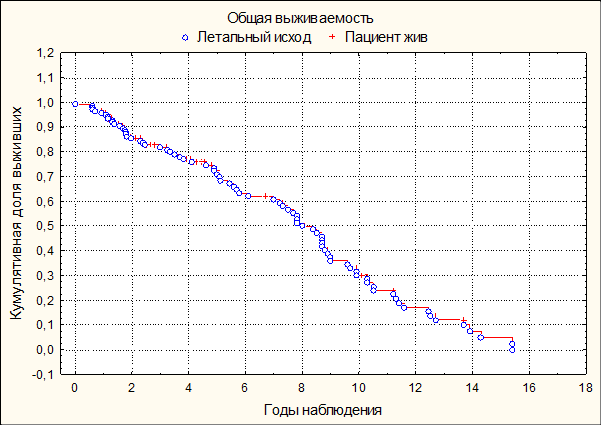
Рис. 1. Общая выживаемость больных раком СОДПР эпидемиологической группы по Каплану–Мейеру
Вероятность, что больные раком СОДПР переживут первый год после установки диагноза, составила 0,88, 2 года – 0,76, 3 года – 0,70, 5 лет – 0,55, 7 лет – 0,39 и 10 лет – 0,14.
Различия кумулятивной выживаемости больных раком СОДПР по методу Каплана–Мейера в зависимости от пола отсутствовали: log-rank тест=0,78; p=0,44.
Величина кумулятивная выживаемости больных раком СОДПР в динамике статистически значимо зависела от стадии заболевания (c2=59,4; p<0,0001). Уже через 3,6 года после постановки диагноза сформировалось различие кумулятивной выживаемости: у пациентов 1-й стадии кумулятивная доля выживших была 100%, при 2-й стадии – 90%, при 3-й стадии – 81,6% и при 4-й стадии – 36,4%. Через 5 лет наблюдения кумулятивная выживаемость составила при 1-й стадии 83,3%, при 2-й стадии 84,8%, при 3-й стадии 68,1% и при 4-й стадии 19,1% (рис. 2).
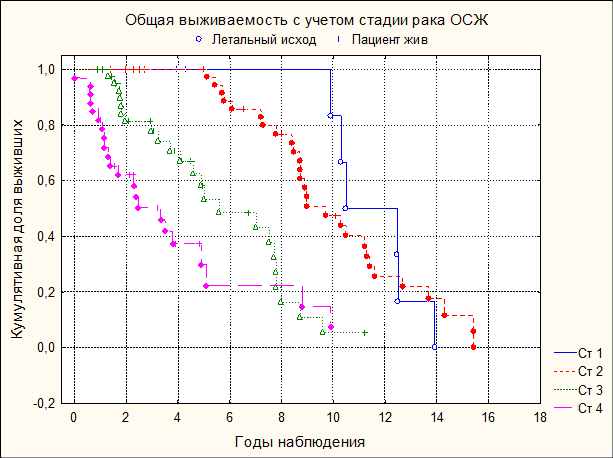
Рис. 2. Общая выживаемость больных раком СОДПР эпидемиологической группы по Каплану–Мейеру с учетом стадии заболевания
Медиана дожития у больных раком СОДПР при 1-й стадии составляла 6,6 года, 2-й стадии – 5,4 года, 3-й стадии – 5 лет и при 4-й стадии – 2,5 года. При 1-й стадии за 16 лет наблюдения из 11 умерли 5 (45%) больных, 2-й стадии из 68 – 38 (56%), 3-й стадии из 63 больных – 46 (73%) и при 4-й стадии из 90 – 70 (78%) пациентов.
На следующем этапе для проведения генетических исследований была сформирована клиническая группа из 67 больных раком СОДПР, которые проходили лечение с 2015 по 2020 гг. Среди пациентов клинической группы у 2 (3%) больных диагностировали 1-ю стадию, у 12 (18%) – 2-ю стадию, у 14 (21%) – 3-ю стадию и у 39 (58%) пациентов – 4-ю стадию заболевания. Из них 34 (51%) пациента умерли, а 33 (49%) остались живы. Динамика кумулятивной выживаемости больных клинической группы была сходной с эпидемиологической: вероятность, что пациенты клинической группы переживут первый год после установки диагноза, составила 0,92, 2 года – 0,88, 3 года – 0,75, 5 лет – 0,54, 7 лет – 0,36 и 10 лет – 0,04. Медиана дожития составила 5,7 года, межквартильный диапазон соответствовал 3,0–7,4 года.
Дальнейший научный интерес был связан с анализом влияния молекулярно-генетических факторов и их мутаций на выживаемость больных раком СОДПР.
При иммуногистохимическом исследовании в клинической группе чаще всего наблюдали гиперэкспрессию мутантного белка р53 в опухолевой ткани, которая была установлена у 41 пациента (61%). Из них 1-я и 2-я стадии заболевания были у 4 (28,6%) из 14 человек, 3–4-е стадии — у 37 (69,8%) из 53 пациентов. Экспрессия р53 – отрицательная и слабой выраженности (1+) – выявлена у 11 (16,4%), экспрессия интенсивностью 2+ – у 15 (22,4%) пациентов (табл. 1).
Таблица 1
Экспрессия p53mut в опухолевой ткани у больных раком СОДПР в зависимости от стадии и исхода заболевания
|
Экспрессия p53mut |
1–2-е стадии n=14 Абс. (%) |
3–4-е стадии n=53 Абс. (%) |
Умершие n=34 Абс. (%) |
Выжившие n=33 Абс. (%) |
|
1+ |
4 (28,6%) |
7 (13,2%) |
5 (14,7%) |
6 (18,2%) |
|
2+ |
6 (42,8%) |
9 (17%)* |
7 (20,6%) |
8 (24,2%) |
|
3+ |
4 (28,6%) |
37 (69,8%)* |
22 (64,7%) |
19 (57,6%) |
|
c2, р |
c2=7,98, р=0,018 |
c2=1,09, р=0,58 |
||
Примечание: * – статистически значимое различие между 3–4-й стадиями по сравнению с 1–2-й стадиями
Экспрессия маркера р53-mut в опухолевой ткани была ассоциирована с развитием более поздних стадий заболевания (относительный риск=2,44, р=0,001), но на выживаемость пациентов не влияла (p>0,05).
Далее было проведено генотипирование по полиморфным вариантам Thr/Thr, Thr/Met и Met/Met в гене XRCC3 Thr241 Met (табл. 2).
Таблица 2
Распределение генотипов гена XRCC3 Thr241 Met у больных раком СОДПР в зависимости от стадии и исхода заболевания
|
Ген/ полиморфизм |
Генотип |
1–2-я стадии n=14 Абс. (%) |
3–4-я стадии n=53 Абс. (%) |
Умершие n=34 Абс. (%) |
Выжившие n=33 Абс. (%) |
|
XRCC3 Thr241 Met |
Thr/Thr |
9 (64,3%) |
7 (13,2%)* |
4 (11,8%)° |
12 (36,4%) |
|
Thr/Met |
3 (21,4%) |
17 (32,1%) |
8 (23,5%) |
12 (36,4%) |
|
|
Met/Met |
2 (14,3%) |
29 (54,7%)* |
22 (64,7%)° |
9 (27,3%) |
|
|
c2, р |
c2=16,4, р=0,0003 |
c2=10,2, р=0,006 |
|||
Примечание: * – статистически значимое различие между 3–4-й стадией по сравнению с 1–2-й стадией,
° – статистически значимое различие между умершими и выжившими.
Наличие полиморфизма XRCC3 Thr241 Met было ассоциировано с развитием 3–4-й стадии заболевания и наступлением летального исхода у больных раком СОДПР. Наличие аллеля Met для однонуклеотидного полиморфизма p.T241M XRCC3 увеличивало вероятность развития высоких стадий заболевания (относительный риск=2,86, р=0,001) и развития летального исхода по сравнению с аллелем Thr (относительный риск=1,94, р=0,02).
На следующем этапе было изучено влияние молекулярно-генетических факторов, а также их сочетанного изменения на общую выживаемость пациентов с раком СОДПР. Для выполнения этой задачи проводили регрессионный анализ Кокса.
Наиболее выраженное прямое влияние на летальность больных раком СОДПР оказывали наличие полиморфизма XRCC3 Thr241 Met (β стандартизированный коэффициент регрессии 2,05, p=0,0002), а также сочетанное выявление аллеля Met для однонуклеотидного полиморфизма p.T241M XRCC3 с гиперэкспрессией в опухолевой ткани мутантного белка р53 (β стандартизированный коэффициент регрессии 2,94, p=0,0001). Поправка на коварианту – стадию рака – не изменяла статистической значимости влияния генетического фактора на выживаемость пациентов.
Следовательно, полиморфизм репарационного гена XRCC3 в опухолевой ткани относился к независимым предикторам, способствующим прогрессированию заболевания с летальным исходом. Комплексное определение в опухолевой ткани выраженности экспрессии p53mut и оценка полиморфизма репарационного гена XRCC3 взаимно усиливали прогностическую значимость каждого исследования по отдельности.
Выводы
1. Анализ однонуклеотидного полиморфизма гена репарации ДНК XRCC3 имеет клиническую и прогностическую значимость при формировании групп высокого риска прогрессирования рака СОДПР.
2. Генотип Met для однонуклеотидного полиморфизма p.T241M XRCC3 повышает риск развития летального исхода у больных раком СОДПР в 1,94 раза (р=0,02).
3. Комплексное исследование экспрессии в опухолевой ткани мутантного белка р53 и анализ однонуклеотидного полиморфизма гена репарации ДНК XRCC3 повышают прогностическую значимость молекулярно-генетического исследования для оценки риска летального исхода у больных раком СОДПР.
Библиографическая ссылка
Енгибарян М.А., Айрапетов Г.А., Максимов А.Ю., Проходная В.А., Максюков С.Ю., Кравченко П.С. ВЛИЯНИЕ КОМПЛЕКСНОЙ ОЦЕНКИ ИММУНОГИСТОХИМИЧЕСКИХ И ГЕНЕТИЧЕСКИХ МАРКЕРОВ ИЗМЕНЕНИЯ РЕПАРАЦИИ ДНК В ОПУХОЛЕВОЙ ТКАНИ НА ВЫЖИВАЕМОСТЬ БОЛЬНЫХ РАКОМ СЛИЗИСТОЙ ОБОЛОЧКИ ДНА ПОЛОСТИ РТА // Современные проблемы науки и образования. 2020. № 6. ;URL: https://science-education.ru/ru/article/view?id=30334 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.30334



