Генез воспалительных процессов тесно связан с развитием и прогрессией злокачественных новообразований. Имеются данные, что клетки и медиаторы хронического воспаления могут существенно влиять на рост и прогрессию карцином [1]. У больных со злокачественными эпителиальными опухолями с течением времени стойкое и постоянно возобновляемое хроническое воспаление может перерасти в пренишу [2], затем в преметастатическую нишу [3] и впоследствии – в метастаз. Ввиду этого в послеоперационном периоде увеличивается вероятность развития рецидивов и метастазов. Вероятно, своевременное назначение противовоспалительных средств позволит снизить риск развития данных послеоперационных осложнений [4].
В связи с этим возникает необходимость в изучении информативности маркеров для определения провоспалительного статуса (ПС) пациента. ПС – это состояние организма, характеризующееся разными значениями гематологических (количество лимфоцитов, нейтрофилов, моноцитов, тромбоцитов), биохимических и цитокиновых показателей в периферической крови. На данный момент на основе клеточных показателей крови вычисляются воспалительные индексы: NLR (neutrophil-to-lymphocyte ratio) [5], PLR (platelet-to-lymphocyte ratio) [6], SII (systemic immune-inflammation index) [7] и LMR (lymphocyte-to-monocyte ratio) [8, 9], которые также могут характеризовать ПС. Предпринимаются попытки прогнозировать риск развития метастазов, рецидивов и выживаемости пациентов с помощью оценки уровня ПС. Однако стоит отметить, что термин ПС редко используется в научной литературе и связь ПС с гематогенным метастазированием (ГМ) и неоадъювантной химиотерапией (НАХТ) при немелкоклеточном раке легкого, как и при других злокачественных новообразованиях, остается недостаточно раскрытой.
Установлено, что возникающие на фоне хронического воспаления морфологические изменения респираторного эпителия в мелких бронхах могут быть ассоциированы с развитием ГМ [10]. Так, показано, что наличие изолированной базальноклеточной гиперплазии (БКГ+) в мелких бронхах, смежных с опухолью, ассоциировано с высоким риском развития гематогенных метастазов (ГМ) при НМРЛ, отсутствие предопухолевых изменений (БКГ–) – с низким риском. Авторы предполагают, что ассоциация характера морфологических изменений в мелких бронхах с риском ГМ может быть обусловлена конститутивными особенностями иммуновоспалительных реакций [11].
Целью исследования явилось изучение ассоциации параметров провоспалительного статуса (ПС) с риском развития гематогенного метастазирования при немелкоклеточном раке легкого (НМРЛ) в условиях проведения неоадъювантной химиотерапии (НАХТ) в зависимости от морфологических изменений бронхиального эпителия.
Материал и методы исследования
Клиническая характеристика пациентов. В исследование были включены 99 больных в возрасте от 53 до 87 лет (84 мужчины и 15 женщин), прооперированных по поводу НМРЛ T1-4N0-3M0 стадии. У мужчин чаще встречался плоскоклеточный рак (66,6% случаев), у женщин – аденокарцинома легкого (73,3% случаев). Синхронные лимфогенные метастазы были выявлены у 28 пациентов. В послеоперационном периоде пациенты получали стандартную адъювантную химиотерапию по показаниям. В течение 5 лет наблюдения за больными у 34,3% пациентов были диагностированы ГМ. В бронхах мелкого калибра у 75,8% пациентов наблюдалась БКГ, у 24,2% БКГ отсутствовала. Клинико-морфологическая характеристика пациентов представлена в таблице 1.
Клинико-морфологическая характеристика больных немелкоклеточным раком легкого
|
Параметр |
Значения параметров |
Частота встречаемости, абс. (%) |
|
Возраст |
67±4,1 года |
|
|
Пол |
Мужчины |
84/99 (84,8%) |
|
Женщины |
15/99 (15,2%) |
|
|
Вариант НМРЛ |
Плоскоклеточный рак |
59/99 (59,6%) |
|
Аденокарцинома |
39/99 (39,3%) |
|
|
Мукоэпидермоидная карцинома |
1/99 (1,1%) |
|
|
Размер опухолевого узла |
T1 |
6/99 (6,1%) |
|
T2 |
17/99 (17,2%) |
|
|
T3 |
42/99 (42,4%) |
|
|
T4 |
34/99 (34,3%) |
|
|
Стадии |
I |
4/99 (4,1%) |
|
IIа |
24/99 (24,2%) |
|
|
IIb |
6/99 (6,1%) |
|
|
IIIа |
53/99 (54,5%) |
|
|
IIIb |
12/99 (12,1%) |
|
|
Синхронные лимфогенные метастазы |
N– |
71/99 (72,7%) |
|
N+ |
28/99 (27,3%) |
|
|
Гематогенные метастазы |
М– |
65/99 (65,6%) |
|
М+ |
34/99 (34,4%) |
|
|
НАХТ |
Не проводилась |
46/99 (46,5%) |
|
Проводилась |
53/99 (53,5%) |
|
|
Морфология бронхиального эпителия |
БКГ– |
24/99 (24,2%) |
|
БКГ+ |
75/99 (75,8%) |
В предоперационном периоде 53 больным было проведено 2–3 курса НАХТ по схеме: внутривенно паклитаксел 175 мг/м2 + карбоплатин AUC 6, интервал между курсами – 3 недели. Для снижения побочных эффектов во время НАХТ по схеме «паклитаксел + карбоплатин» пациентам вводили дексаметазон.
Морфологический анализ. Морфологический диагноз плоскоклеточного рака и аденокарциномы легкого устанавливали согласно «Гистологической классификации опухолей легкого» ВОЗ 2015 [12]. Для изучения характера морфологических изменений бронхиального эпителия при НМРЛ исследовали фрагменты ткани удаленного легкого с бронхом на расстоянии 3–4 см от опухоли. Исследовались бронхи мелкого калибра (d=0,5–2 мм). Диагностику БКГ проводили по общепринятым критериям [13].
Морфологическое исследование проводили с помощью светового микроскопа «Axio Scope. A1» (Carl Zeiss, Германия). Гистотип опухоли был подтвержден иммуногистохимическим исследованием с использованием панели антител: TTf-1 (clone 8G7G3/1, Dako), Napsin А (Napsin A, Rabbit Polyclonal) и p63 (Rabbit Polyclonal, Leica), СК7 (clone OV-TL 12/30, Dako), СК20 (clone Ks 20.08, Dako) и СЕА (clone AMT28, Dako).
Оценка ПС. Материалом для исследования ПС служила венозная кровь, взятая утром натощак накануне операции (не ранее чем через 2–3 недели после последнего курса НАХТ). С помощью стандартных гематологических методов оценивали показатели общего анализа крови с подсчетом лейкоцитарной формулы крови. Проводили расчет воспалительных индексов: отношение количества нейтрофилов к количеству лимфоцитов (neutrophil-to-lymphocyte ratio – NLR), количества тромбоцитов к количеству лимфоцитов (platelet-to-lymphocyte ratio – PLR), количества лимфоцитов к количеству моноцитов (lymphocyte-to-monocyte ratio – LMR) и определяли системный иммуновоспалительный индекс (systemic immune-inflammation index – SII) – отношение произведения числа нейтрофилов и числа тромбоцитов к числу лимфоцитов. Определение концентрации провоспалительных цитокинов (интерлейкинов IL-1b, IL-33, IL-6, фактора некроза опухолей (tumor necrosis factor – TNFa)), хемокинов (интерлейкина-8 – IL-8 (CXCL8), CXCL12 (stromal cell-derived factor-1 – SDF-1), CCL2 (моноцитарного хемотаксического протеина-1, monocyte chemoattractant protein-1 – MCP-1)) и фактора роста эндотелия сосудов (vascular endothelial growth factor – VEGF A) в периферической крови производилось мультиплексным методом xMAP с помощью наборов Human Cytokine/Chemokine Magnetic Bead Panel и Human Cytokine/Chemokine Panel II (Merk Millipore, США).
Статистический анализ. Статистический анализ проводился с использованием пакета программ «Statistica 8.0» (Statsoft, США). Проверку нормальности распределения показателей осуществляли с помощью критерия Шапиро–Уилка. Для сравнения независимых выборок использовали критерий Манна–Уитни. Результаты отражали в виде медианы (Me), первого (Q1) и третьего (Q3) квартилей. Для построения математических моделей с целью прогнозирования развития ГМ использовали метод логистической регрессии. Пороговый уровень показателей для построения математических моделей определяли с помощью ROC-анализа. Обсуждались результаты с достоверностью различий при р<0,05 и с тенденцией к различиям при р≤0,1.
Результаты исследования и их обсуждение
Результаты проведенного ранее исследования показали, что в бронхах мелкого калибра, отдаленных на 3–4 см от опухоли, могут быть обнаружены разные варианты сочетаний морфологических изменений эпителия, каждый из которых ассоциирован с тем или иным видом прогрессирования НМРЛ. ГМ при НМРЛ наиболее часто возникали у больных, имевших в мелких бронхах БКГ на фоне воспаления. Крайне низкая частота развития ГМ отмечалась у пациентов с БКГ– [10]. В связи с этим представляла интерес оценка ПС в группах больных с БКГ+ и БКГ– при наличии и отсутствии ГМ, а также с учетом проведения НАХТ. Дизайн исследования представлен на рисунке 1.
Дизайн исследования
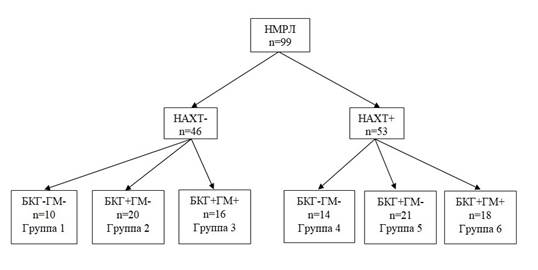
Рис. 1. Дизайн исследования
Примечание: НМРЛ – немелкоклеточный рак легкого, НАХТ – неоадъювантная химиотерапия, БКГ – базальноклеточная гиперплазия, ГМ – гематогенные метастазы
Проведение предварительного сравнения параметров ПС у пациентов в зависимости от возраста, пола и гистологического варианта НМРЛ не показало статистических различий. Анализ частоты возникновения отдаленных метастазов также не выявил статистических различий в группах больных в зависимости от проведенной адъювантной химиотерапии.
Провоспалительный статус в зависимости от морфологических изменений бронхиального эпителия у пациентов без проведения НАХТ с отсутствием гематогенных метастазов
Были исследованы гематологические показатели (рис. 2) и спектр провоспалительных цитокинов в крови (рис. 3) больных с БКГ– (группа 1) и с БКГ+ (группа 2), у которых отсутствовали ГМ и не проводилась НАХТ.
При наличии БКГ на уровне тенденций отмечались большее количество нейтрофилов (p1-2=0,06), значение индекса PLR (p1-2=0,09) и SII (p1-2=0,09) и меньшее количество лимфоцитов (p1-2=0,1). Статистически значимо было меньшим относительное количество моноцитов (p1-2=0,01) (рис. 2). В сравниваемых группах не было обнаружено значимых различий сывороточной концентрации провоспалительных цитокинов (рис. 3). Полученные результаты позволяют сделать вывод о том, что уровень ПС при БКГ+ГМ– выражен в большей степени по сравнению с БКГ–ГМ–.
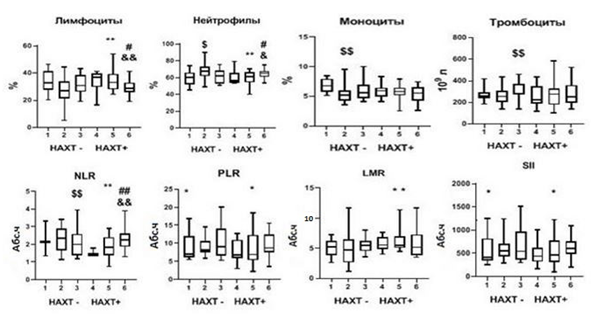
Рис. 2. Параметры ПС в зависимости от морфологических изменений бронхиального эпителия, наличия ГМ и проведения НАХТ у пациентов с НМРЛ (Me(Q1-Q3))
Примечание: #$$ – р<0,05 по сравнению с группой 1; ** – р<0,05 по сравнению с группой 2; # – р<0,05 по сравнению с группой 4; && – р<0,05 по сравнению с группой 5; $ – p<0,09 по сравнению с группой 1, * – p<0,09 по сравнению с группой 2; & – р<0,09 по сравнению с группой 5; # – p<0,09 по сравнению с группой 6. НАХТ – неоадъювантная химиотерапия; Абс. ч. – абсолютное число NLR – отношение количества нейтрофилов к количеству лимфоцитов (neutrophil-to-lymphocyte ratio), PLR – отношение количества тромбоцитов к количеству лимфоцитов (platelet-to-lymphocyte ratio), LMR – отношение количества лимфоцитов к количеству моноцитов (lymphocyte-to-monocyte ratio), SII – системный иммуновоспалительный индекс (systemic immune-inflammation index) – отношение произведения числа нейтрофилов и тромбоцитов к числу лимфоцитов
Проведение многофакторного анализа (метод логистической регрессии) позволило подтвердить выраженные различия параметров ПС (величина воспалительного индекса SII, сывороточная концентрация IL-6, CCL2 (MCP-1) и CXCL12 (SDF-1)) у пациентов с НМРЛ в зависимости от наличия/отсутствия морфологических изменений бронхиального эпителия: уровень ПС при наличии БКГ был выше, чем при отсутствии БКГ, смежных с опухолью (Chi-square=10,0, p=0,0403; чувствительность модели составила 100%, специфичность – 100%).
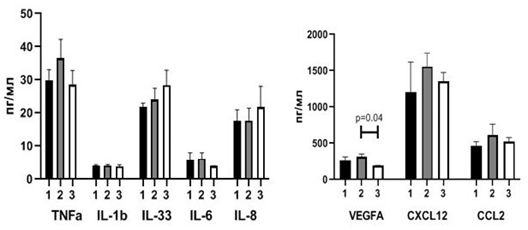
Рис. 3. Сывороточная концентрация провоспалительных цитокинов в зависимости от морфологических изменений бронхиального эпителия и наличия ГМ у пациентов, не получавших НАХТ (Me(Q1-Q3))
Примечание: 1 – группа пациентов без базальноклеточной гиперплазии и гематогенных метастазов (БКГ–ГМ–), 2 – группа пациентов с базальноклеточной гиперплазией и без метастазов (БКГ+ГМ–), 3 – группа пациентов с базальноклеточной гиперплазией и гематогенными метастазами (БКГ+ГМ+)
Особенности провоспалительного статуса в зависимости от наличия гематогенных метастазов и характера морфологических изменений эпителия в мелких бронхах при НМРЛ в группе пациентов без проведения НАХТ
Сравнение параметров ПС у пациентов группы БКГ+ГМ+ (группа 3) (рис. 1) с аналогичными параметрами групп БКГ–ГМ– (группа 1) и БКГ+ГМ– (группа 2) не выявило статистически значимых различий между ними (рис. 2). Сывороточная концентрация провоспалительных цитокинов у пациентов с БКГ–ГМ– (группа 1) и БКГ+ГМ– (группа 2) также статистически не различалась (рис. 3). При сравнении показателей ПС в группах пациентов с наличием морфологических изменений бронхиального эпителия, но различающихся по наличию ГМ (БКГ+ГМ– (группа 2) и БКГ+ГМ+ (группа 3)) была обнаружена меньшая концентрация VEGF А в крови пациентов с БКГ+ГМ+ (группа 3) (p=0,04) (рис. 3).
Несмотря на отсутствие межгрупповых различий параметров ПС, оцененных с помощью непараметрических критериев, использование метода логистической регрессии позволило показать ассоциацию выраженности ПС с наличием БКГ и высоким риском развития ГМ при НМРЛ (Chi-square=15,6, р=0,0014; чувствительность модели составила 100%, специфичность – 100%).
Таким образом, результаты исследования свидетельствуют о том, что высокий уровень ПС ассоциирован с высоким риском развития гематогенных метастазов НМРЛ в группе пациентов, не получавших НАХТ, у которых в мелких бронхах, смежных с опухолью, регистрировалось развитие БКГ.
Влияние НАХТ на параметры провоспалительного статуса у пациентов с НМРЛ в зависимости от морфологических изменений эпителия мелких бронхов и наличия гематогенных метастазов
При сравнении показателей ПС у пациентов с БКГ–ГМ– в зависимости от назначения НАХТ (группа 1 и группа 4) не было обнаружено статистически значимых различий. На уровне тенденции наблюдалось снижение воспалительного индекса NLR (р1-4= 0,08).
Сравнение показателей ПС пациентов с БКГ+ГМ– в зависимости от проведения НАХТ (группа 2 и группа 5) выявило статистически значимые различия между группами. У пациентов, которым проводилась НАХТ, наблюдались значимое повышение количества лимфоцитов (р2-5=0,02), величины воспалительного индекса LMR (р2-5=0,02), снижение количества нейтрофилов (р2-5=0,02) и величины воспалительных индексов NLR (р2-5=0,01), PLR (р2-5=0,06) и SII (р2-5=0,07) по сравнению с пациентами, которым НАХТ не назначалась. Полученные данные свидетельствуют о том, что НАХТ снижает выраженность ПС в группе пациентов с высоким риском развития ГМ (БКГ+).
Статистически значимых различий между группами пациентов с БКГ+ГМ+, различающихся проведением НАХТ (группа 3 и группа 6), обнаружено не было (р3-6>0,05; рис. 2). Показатели выраженности ПС в группах больных с НАХТ и отсутствием ГМ, но различающихся по морфологическим изменениям бронхиального эпителия (БКГ–ГМ– (группа 4) и БКГ+ГМ– (группа 5)), также не имели значимых различий.
Выраженность параметров ПС различалась при сравнении групп пациентов в зависимости от наличия ГМ и БКГ, которые получали НАХТ (БКГ–ГМ– (группа 4)) и (БКГ+ГМ+ (группа 6)). На уровне тенденции в группе 6 было меньшим количество лимфоцитов (р4-6=0,08) и выше количество нейтрофилов (р4-6= 0,08), статистически значимо был выше NLR (р4-6=0,03) (рис. 2) по сравнению с группой 4. В соответствии с результатом многофакторного анализа высокий риск развития ГМ был связан с уровнем NLR и низкой степенью дифференцировки опухоли при наличии БКГ (Chi-square=8,26, p=0,0160; чувствительность модели составила 63%, специфичность – 76%).
При сравнении ПС у пациентов, получавших НАХТ, с БКГ+ГМ+ (группа 6)) с группой пациентов БКГ+ГМ– (группа 5) был выявлен ряд отличий. При наличии ГМ (группа 6) были ниже количество лимфоцитов (р5-6=0,04) и выше воспалительный индекс NLR (р5-6=0,04). На уровне тенденции было большим количество нейтрофилов (р5-6=0,09).
Интегральная количественная оценка маркеров ПС (воспалительных индексов, концентрации провоспалительных цитокинов) позволила судить о выраженности ПС. Результаты позволяют обсуждать ассоциацию ПС с риском гематогенного метастазирования с учетом наличия в мелких бронхах БКГ и проведения НАХТ.
В настоящем исследовании показано, что у пациентов с НМРЛ ГМ ассоциировано с более высоким уровнем параметров ПС при наличии в мелких бронхах БКГ, как в группах НМРЛ с наличием, так и без проведения НАХТ.
Судя по результатам оценки ПС в группах пациентов, которым не проводилась НАХТ и в течение пяти лет отсутствовали ГМ, можно полагать, что развитие БКГ ассоциировано с более выраженным уровнем ПС. Следует отметить, что большая выраженность ПС при наличии БКГ согласуется с отмеченной О.В. Панковой и соавт. (2016) более выраженной воспалительной инфильтрацией в слизистой мелких бронхов при наличии в ней БКГ в сравнении со случаями, когда последняя отсутствовала [10, 11].
Несмотря на большое количество исследований прогностического значения различных воспалительных индексов, практически отсутствуют работы, в которых учитывалось бы влияние НАХТ. Обобщая полученные нами результаты, можно прийти к выводу, что влияние НАХТ существенно и ассоциировано с характером морфологических изменений в эпителии смежных с опухолью бронхов. Реакция на НАХТ сложной функциональной системы, обусловливающей изменения множества разных параметров ПС, при БКГ– характеризуется значимым уменьшением уровня ПС. Однако этот феномен наблюдается только в группе, в которой в течение 5 лет не были выявлены ГМ. В группе с гематогенным метастазированием такой эффект НАХТ отсутствовал. Можно предполагать, что снижение выраженности ПС в ответ на НАХТ связано с низким риском ГМ. На фоне НАХТ проявилась ассоциация ГМ и с выраженностью ПС. Выраженность ПС у пациентов с ГМ, получавших НАХТ (группа 3), оказалась более высокой как по отношению к группе без ГМ и без изменений бронхиального эпителия (БКГ–ГМ– (группа 1)), так и по отношению к группе без ГМ с изолированной БКГ бронхиального эпителия (БКГ+ГМ– (группа 2)). Обращает на себя внимание, что спектр параметров ПС, связанных с риском гематогенного метастазирования, различен в группах с наличием и отсутствием НАХТ. Результаты исследования, свидетельствующие об ассоциации параметров ПС с развитием ГМ при НМРЛ, согласуются с существующими представлениями о роли механизмов, лежащих в основе развития воспалительных реакций, в формировании преметастатических ниш – «почвы» для ГМ. Кроме этого, результаты проведенного исследования косвенно подтверждают гипотезу, которая объясняет природу ассоциации БКГ эпителия мелких бронхов с высоким риском отдаленного метастазирования при НМРЛ особенностями иммуновоспалительных реакций [13].
Заключение
Гематогенное метастазирование при НМРЛ ассоциировано с более высоким уровнем ПС как у пациентов, не получавших НАХТ, так и на фоне проведенной НАХТ. Однако для прогнозирования риска развития ГМ у пациентов, которые получали НАХТ и не подвергались подобной терапии, необходимо учитывать разные параметры ПС. Наличие БКГ в мелких бронхах у пациентов с НМРЛ ассоциировано с более выраженным уровнем ПС. НАХТ влияет на уровень ПС: уменьшает выраженность ПС при наличии БКГ и не влияет на ПС при отсутствии БКГ.
Исследования выполнены при поддержке гранта Президента РФ НШ-2701.2020.7.
Библиографическая ссылка
Письменный Д.С., Савельева О.Е., Завьялова М.В., Вторушин С.В., Дурова А.А., Родионов Е.О., Таширева Л.А., Панкова О.В., Перельмутер В.М. СВЯЗЬ ПАРАМЕТРОВ ПРОВОСПАЛИТЕЛЬНОГО СТАТУСА С РАЗВИТИЕМ ГЕМАТОГЕННЫХ МЕТАСТАЗОВ У БОЛЬНЫХ НЕМЕЛКОКЛЕТОЧНЫМ РАКОМ ЛЁГКОГО // Современные проблемы науки и образования. 2020. № 6. ;URL: https://science-education.ru/ru/article/view?id=30317 (дата обращения: 18.11.2025).
DOI: https://doi.org/10.17513/spno.30317



