Ранее считалось, что центральная нервная система обособлена от иммунной системы благодаря наличию гематоэнцефалического барьера (ГЭБ), однако сейчас известно, что нервная и иммунная системы активно взаимодействуют. В частности, уровень нейрогенеза в гиппокампе мышей значительно снижается при моделировании периферического воспаления с помощью введения липополисахарида (ЛПС) [1]. Поскольку проникновение ЛПС через ГЭБ затруднено [2], его воздействие на центральную нервную систему происходит за счет образования вторичных посредников клетками эндотелия и/или глиальными клетками (астроцитами и микроглией).
Глиальные клетки являются иммунными клетками мозга, и в случае повреждения нервной ткани глия приобретает реактивный фенотип [3; 4]. Во время нейровоспалительных реакций микроглиальные клетки регулируют активность астроцитов, олигодендроцитов, а также нейронов [5]. Показано, что ДНК/РНК вирусного, бактериального, грибкового происхождения, эндогенные белки, ЛПС, цитокины и факторы роста in vitro вызывают активацию микроглии [6]. При этом микроглия меняет свой фенотип на провоспалительный (М1) и синтезирует провоспалительные цитокины, окислительные метаболиты и супероксидные соединения [7]. В отличие от М1-фенотипа, микроглия в фенотипе М2 подавляет воспалительные процессы, высвобождая противовоспалительные цитокины, факторы роста, а также контролирует активность других резидентных клеток, которые способствуют выживанию нейронов и играют важную роль в процессах нейрогенеза в гиппокампе [8-10]. Астроциты являются иммунокомпетентными клетками, способными реагировать на изменения концентрации цитокинов и хемокинов, а также активировать некоторые адаптивные иммунные реакции [11]. В активированном состоянии астроциты могут оказывать значимое воздействие на микроокружение нейронов, в частности они способны модулировать их выживаемость [12].
Таким образом, знания о реактивных изменениях, которые происходят с глиальными клетками после введения ЛПС, могут дать представление о том, каким образом иммунные реакции могут влиять на нейрогенез. В настоящее время остается открытым вопрос о наличии реактивных изменений в глиальных клетках на раннем этапе воспалительного ответа. Целью настоящего исследования было изучение реактивных изменений в глиальных клетках гиппокампа мыши в ответ на ЛПС.
В соответствии с целью поставлены следующие задачи:
1) оценить изменения количества и морфологии Iba1+ микроглиальных клеток, а также изменение уровня экспрессии Iba1 в гиппокампе мыши в ответ на интраперитонеальные инъекции ЛПС;
2) оценить изменения количества и морфологии S100b+ астроцитарных клеток, а также определить изменение уровня экспрессии GFAP в гиппокампе мыши в ответ на интраперитонеальные инъекции ЛПС.
Материалы и методы исследования
В исследовании были использованы мыши инбредной линии C57BL/6 в возрасте 3 месяцев (n=14, 7>, 7+). Животных содержали в стандартных условиях вивария, при световом режиме 12/12, доступе к корму и воде ad libitum. Эксперименты проводили в соответствии с этическими правилами работы с животными («Об утверждении Правил надлежащей лабораторной практики», Приказ Министерства здравоохранения РФ от 01.04.2016 г. № 199н и European Convention for the Protection of Vertebral Animals Used for Experimental and Other Scientific Purposes. CETS No. 123). Объектом исследования являлся головной мозг мыши. Для индуцирования периферического воспаления использовали интраперитонеальные инъекции ЛПС (E. coli 026: B6, Sigma-Aldrich, США) в концентрации 50 мкг/кг. Животным из контрольной группы вводили 0,9%-ный водный раствор NaCl (Solopharm, Россия). Спустя 1 час после инъекции проводили цервикальную дислокацию и декапитацию с последующим извлечением мозга. Для проведения иммуногистохимического исследования были отобраны левые полушария головного мозга, которые были зафиксированы в 4%-ном параформальдегиде в течение суток. Каждое полушарие мозга было промыто натрий-фосфатным буфером (pH 6.0) и залито 5%-ным агарозным гелем в специальной форме. Затем на вибратоме были сделаны фронтальные срезы толщиной 50 мкм и произведено иммуногистохимическое окрашивание. Окрашенные срезы были разложены по порядку (от обонятельных луковиц до мозжечка и спинного мозга) в среде Molwiol, затем срезы были накрыты покровным стеклом и оставлены на час при комнатной температуре в темноте. Таким образом были подготовлены препараты для дальнейшей работы на флуоресцентном микроскопе. В работе использовали оборудование и реактивы для гистологии от Thermo Fisher Scientific (США), Sigma Aldrich (США), антитела для иммуногистохимии от Abcam (Великобритания). Для каждого вида окрашивания использовали по две серии срезов из каждого мозга. Было произведено инкубирование срезов сначала с первичными антителами: поликлональные антитела козы к Iba1 (1:500); поликлональные антитела кролика к S100b (1:1000). Для того чтобы исключить неспецифическое окрашивание, к срезам из серии, используемым для анализа Iba1, был предварительно добавлен авидин. После этого срезы инкубировали со вторичными антителами: поликлональные антитела осла к антигенам козы, конъюгированные с биотином (1:1000); поликлональные антитела осла к антигенам кролика с Alexa 555 (1:1000). Далее к вторичным антителам, конъюгированным с биотином, был добавлен стрептавидин с флуоресцентной меткой Alexa 594 (1:1000). Окрашенные срезы промывали натрий-фосфатным буфером (pH 6.0), монтировали на предметные стекла в Mowiol (Sigma-Aldrich, США). Подсчет клеток производился на срезах мозга при помощи флуоресцентного микроскопа Zeiss Axio Imager A2 (Германия) в гиппокампе (было выбрано 11 областей гиппокампа, в которых производился подсчет на каждом срезе). На основании этих данных было подсчитано количество клеток в целом полушарии с аппроксимацией. Статистическая обработка результатов проводилась на основе гипотезы нормальности распределения. Для оценки статистической достоверности использовали Т-тест и тест Манна-Уитни. Статистически значимыми считали различия при р≤0,05.
Для оценки уровней экспрессии глиальных маркеров была проведена полимеразная цепная реакция. Из правого полушария выделяли гиппокамп, после чего ткань помещали в RNAlater (Sigma-Aldrich, США) для последующего выделения РНК с использованием коммерческого реактива ExtractRNA («Евроген», кат. #BC032, Россия) в соответствии с инструкцией. Количество и качество полученной мРНК измеряли методами флуориметрии и электрофорезом в агарозном геле. Затем производили синтез кДНК при помощи набора для обратной транскрипции «MMLV RT kit» («Евроген», кат. #SK021, Россия) в соответствии с инструкцией с использованием ДНК-амплификатора C1000 Touch 96 Reaction Module (Bio-Rad, США). На полученной кДНК проводили ПЦР в реальном времени. Праймеры подобраны с использованием системы Primer-BLAST – NCBI: GFAP (F: ACA CTG AAA CAG GAG AGA GG, R: TAA GAT GAC TGA GCG GAT GG), IBA1 (F: AAG GGA ATG AGT GGA AAG GG, R: CAG ACG CTG GTT GTC TTA GG). Для проведения ПЦР использовали готовую смесь «qPCRmix-HS SYBR» («Евроген», кат. #PK147, Россия) в соответствии с инструкцией. Результаты были проверены с помощью электрофореза в агарозном геле. Анализ данных был произведен с помощью метода ΔCt, с последующим тестом ANOVA и критерием Манна-Уитни. Значения *p<0,05 считались статистически значимыми.
Результаты исследования и их обсуждение
Иммуногистохимическое окрашивание на маркер Iba1 позволило идентифицировать микроглиальные клетки в гиппокампе мозга мыши. Морфологически микроглия представляет собой клетки с овальным или округлым телом до 10 мкм в диаметре, с несколькими ветвящимися отростками (рис. 1). По результатам визуального анализа микроглиальные клетки в областях гиппокампа СА1, СА3 и DG после введения ЛПС имеют тенденцию к смене морфологии на активированную/промежуточную форму (М0-М1).
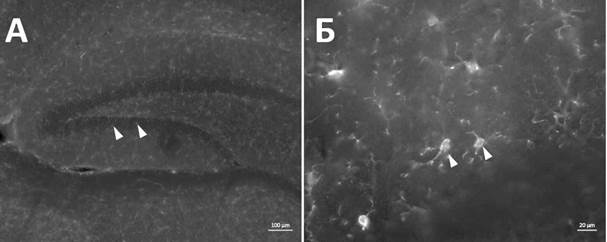
Рис. 1. Иммунореактивность к маркеру Iba1+ в гиппокампе мыши экспериментальной группы. Белые стрелки указывают на Iba1+ клетки в области зубчатой извилины. Масштабный отрезок –100 мкм (А), 20 мкм (Б)
По результатам количественного анализа общее число микроглиальных клеток в гиппокампе у мышей с введенным ЛПС составило 37 194, а у контрольной группы 38 556, то есть количество клеток в контрольной группе оказалось незначительно больше (на 3,66%). Сравнительный анализ числа клеток по каждой области гиппокампа отдельно также не показал существенных различий СА1 (р=0,97), СА3 (р=0,96) и DG (р=0,80). Данные представлены на рисунке 2. Таким образом, интраперитонеальное введение ЛПС в концентрации 50 мкг/кг спустя 1 час не приводит к изменению количества микроглиальных клеток в гиппокампе.
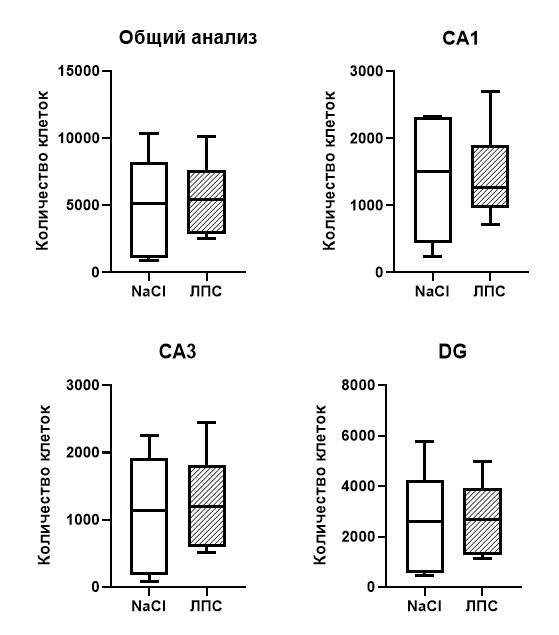
Рис. 2. Количество Iba1+ микроглиальных клеток на фронтальных срезах левого гиппокампа мыши спустя 1 час после введения ЛПС в концентрации 50 мкг/кг. Т-тест
Анализ количества микроглиальных клеток у самцов и самок не показал статистически значимых различий. Уровень достоверности данных составил p>0,99 для самцов и p=0,69 для самок. Иммуногистохимическое окрашивание на маркер S100b позволило выявить астроцитарные клетки в гиппокампе мыши (рис. 3). Морфологически астроциты представляют собой клетки звездчатой формы с округлым телом около 10 мкм в диаметре с ветвящимися отростками. На рисунке 3 представлены микрофотографии гиппокампа мыши, на которых обозначены S100b+ астроцитарные клетки.
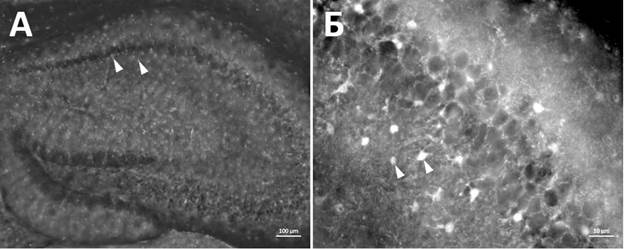
Рис. 3. Иммунореактивность к маркеру S100b+ в гиппокампе мыши экспериментальной группы. Белые стрелки указывают на отдельные S100b+ клетки.
Масштабный отрезок – 100 мкм (А), 10 мкм (Б)
Количественная оценка S100b+ астроцитарных клеток на срезах гиппокампа, а также сравнительный анализ количества клеток отдельно по каждой области гиппокампа CA1 (р=0,46), CA3 (р=0,46), DG (р=0,25) показал, что интраперитонеальная инъекция ЛПС спустя 1 час не вызывает существенных изменений в количестве астроцитов (рис. 4).
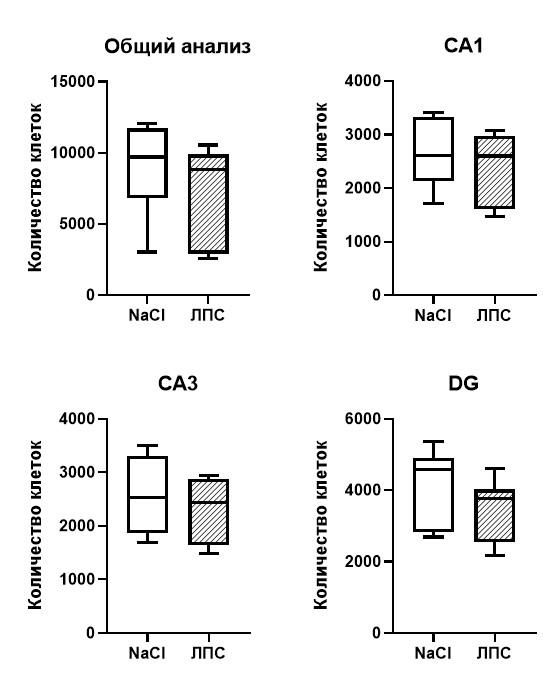
Рис. 4. Количество S100b+ астроцитарных клеток на фронтальных срезах левого гиппокампа мыши спустя 1 час после введения ЛПС в концентрации 50 мкг/кг. Т-тест
Анализ количества клеток у самцов и самок также не показал значимых изменений. Значение достоверности составило p=0,16 для самцов и p=0,79 для самок.
Исследование уровней экспрессии глиального фибриллярного кислого белка (GFAP) и IBA1 с помощью полимеразной цепной реакции показало, что спустя 1 час после интраперитонеальной инъекции ЛПС уровень экспрессии GFAP существенно повышается у самцов (p<0,05), в то время как у самок статистически значимых изменений не происходит (рис. 5А). При этом у самцов с введенным ЛПС уровень экспрессии GFAP оказался существенно выше, чем у самок с ЛПС (p=0,0041). Экспрессия микроглиального маркера IBA1 спустя 1 час после интраперитонеальной инъекции ЛПС также была статистически значимо повышена у самцов (p<0,001), но не у самок (рис. 5Б). При этом у самцов с введенным ЛПС уровень экспрессии IBA1 оказался существенно выше, чем у самок с ЛПС (p=0,0013).
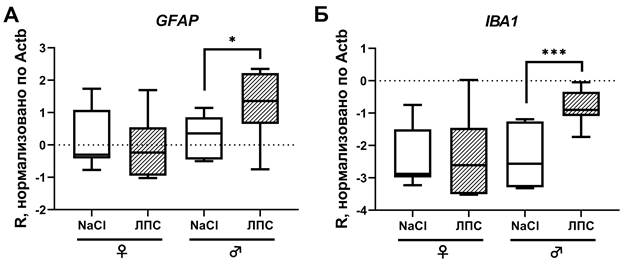
Рис. 5. Экспрессия GFAP (А) и Iba1 (Б) у животных разного пола спустя 1 час после введения ЛПС (штриховка) и в соответствующих контрольных группах
По результатам морфологического анализа было установлено, что микроглиальные клетки имеют тенденцию к смене морфологии на активированную/промежуточную форму. В исследованиях in vitro, где культивировали клетки микроглии после добавления ЛПС в концентрации 1 мг/мл среды, было установлено, что микроглия переходит в активированный фенотип через 3 часа. При этом было отмечено, что наибольшее количество активированной микроглии наблюдали через 6 часов после добавления ЛПС, а с 3 до 6 часов наблюдается тенденция к увеличению числа клеток [13]. В нашем исследовании было определено лишь небольшое количество активированных микроглиальных клеток. Можно предположить, что через 1 час после введения ЛПС микроглия только начинает переход в активированное состояние, поэтому увеличивается количество активированных клеток и клеток промежуточной формы.
Количественный анализ астроцитарных клеток показал, что интраперитонеальное введение ЛПС мышам в концентрации 50 мкг/кг в течение 1 часа не приводит к изменению числа S100b+ астроцитарных клеток. Мы предполагали, что введение ЛПС приведет к усилению экспрессии S100b [14], что соответствует переходу астроцитов в активированное состояние. Микроглиальные клетки могут регулировать активность астроцитов посредством увеличения концентрации провоспалительных цитокинов [5; 6]. Известно, что увеличение концентрации провоспалительных цитокинов (TGF-α, CNTF, ИЛ-6, LIF, онкостатина М) способствует переходу астроцитов в реактивную форму [15]. Поскольку ЛПС способствует возникновению воспалительного процесса в головном мозге, концентрация S100b может увеличиться [16]. Но полученные нами данные свидетельствуют о тенденции к снижению S100b+ астроцитов после введения ЛПС. Такое снижение не является статистически значимым.
Однако уменьшение экспрессии S100b также могло быть возможным. Установлено, что низкие концентрации провоспалительных цитокинов могут приводить к снижению экспрессии S100b в астроцитах. Так, работы Guerra M.C. с соавт. [14] показали, что астроциты in vitro снижают экспрессию S100b при добавлении ЛПС в концентрации менее 10 мкг/мл, а именно 0,1 и 1 мкг/мл. А при концентрации 10 мкг/мл авторы наблюдали значимое увеличение экспрессии S100b. Но так как в нашем исследовании статистическая обработка не показала значимых различий, можно сделать вывод, что количество S100b+ астроцитарных клеток не изменилось после введения ЛПС. По результатам морфологической оценки астроциты после введения ЛПС не находятся в реактивном состоянии. В совокупности, в результате количественного и качественного анализа S100b+ клеток, можно предположить отсутствие реактивных изменений у астроцитов.
Результаты исследования уровней экспрессии GFAP и IBA методом полимеразной цепной реакции показали, что в ответ на периферическое воспаление, вызванное ЛПС, статистически значимое увеличение экспрессии глиальных маркеров наблюдалось только у самцов, у самок значимых изменений экспрессии не было. Эти данные согласуются с исследованиями половых различий в развитии процессов нейровоспаления [17-19]. Так, эксперименты in vitro показали, что в ответ на ЛПС астроциты, выделенные из церебральной коры самцов, демонстрируют существенно более высокие уровни мРНК ИЛ-1β, ИЛ-6 и ФНОα, и, возможно, это связано с различными уровнями экспрессии белков, связанных с синтезом и метаболизмом стероидных гормонов у самцов и самок, - StAR и TSPO [20]. Так, в одном исследовании мышей подвергали физическому стрессу с последующим введением ЛПС. Выяснилось, что после стресса микроглия у самцов в ответ на ЛПС демонстрирует увеличение количества активированных клеток, являясь, таким образом, вероятным клеточным источником праймирования стресса. В то же время в аналогичных условиях микроглия самок проявляет тенденцию к нейропротекторному профилю, результатом которого является подавление активации микроглиальных клеток. Предполагается, что притуплять реакцию микроглии на ЛПС может вызванное стрессом увеличение глюкокортикоидов, которое у самок является более продолжительным, чем у самцов [17].
Также половые гормоны играют ключевую роль в регуляции экспрессии GFAP. Дефицит же половых гормонов вызывает в гиппокампе астроглиальную атрофию [21]. По результатам полимеразной цепной реакции экспрессия микроглиального маркера IBA1 существенно увеличилась у самцов, что может быть следствием как увеличения числа Iba1+ клеток (чего не наблюдалось), так и увеличением экспрессии IBA1 в отдельных клетках. Так как в настоящем исследовании мы оценивали только число и морфологию клеток, а не относительный уровень флуоресценции отдельных клеток, по которому можно сделать заключение об изменении количества белка, однозначный ответ дать сложно. Таким образом, спустя 1 час после интраперитонеальной инъекции ЛПС изменения количества микро- и астроглиальных клеток не происходит, при этом микроглия имеет тенденцию к смене фенотипа на активированный или промежуточный. Вероятно, что для приобретения глиальными клетками активированного фенотипа и пролиферативного ответа необходим более продолжительный промежуток времени.
Выводы
1. Спустя 1 час после интраперитонеальной инъекции ЛПС в концентрации 50 мкг/кг в гиппокампе мышей наблюдается тенденция к изменению морфологии Iba1+ микроглиальных клеток и приобретению микроглией активированного фенотипа. Изменения количества Iba1+ микроглиальных клеток не происходит: вероятно, на пролиферативный ответ требуется больше времени. В гиппокампе самцов, в отличие от самок, происходит статистически значимое увеличение РНК микроглиального маркера IBA, что может означать переход микроглиальных клеток в активированную форму (М1).
2. Спустя 1 час после интраперитонеальной инъекции ЛПС в концентрации 50 мкг/кг в гиппокампе мышей количество и морфология S100b+ астроцитов не изменяются. В гиппокампе самцов, в отличие от самок, происходит статистически значимое увеличение РНК GFAP, что может свидетельствовать об изменении профиля астроцитов.
Статья написана при поддержке программы повышения конкурентоспособности БФУ им. И. Канта на 2016-2020 годы (Проект 5-100).
Библиографическая ссылка
Патлай Н.И., Сотников Е.Б., Курилова Е.А., Тучина О.П. РАННИЕ ИЗМЕНЕНИЯ РЕАКТИВНОГО ПРОФИЛЯ ГЛИАЛЬНЫХ КЛЕТОК ГИППОКАМПА МЫШИ В ОТВЕТ НА ЛИПОПОЛИСАХАРИД // Современные проблемы науки и образования. 2020. № 6. ;URL: https://science-education.ru/ru/article/view?id=30310 (дата обращения: 02.01.2026).
DOI: https://doi.org/10.17513/spno.30310



