Одним из эффективных методов реконструкции первого пальца кисти является перемещение ее сегментов [1-4]. Однако при последствиях травмы данные вмешательства в настоящее время выполняются по ограниченным показаниям, преимущественно при отсутствии первого пальца с пястной костью и наличии на кисти дефектного (увечного) второго пальца [5, 6]. Причем степень дефектности (тяжесть деформации) второго пальца не должна быть значительной. Перемещению сегментов других трехфаланговых пальцев посвящены единичные работы [7]. В основе известных методик лежат перемещение сегмента на ладонных сосудисто-нервных пучках и формирование первого межпальцевого промежутка с использованием кожного лоскута из местных тканей [7, 8]. При этом сохраняются сухожилия сгибателей и восстанавливаются сухожилия разгибателя пальца. Необходимыми условиями применения типичных методик перемещения сегмента кисти (пальца, культи пальца и пястной кости) большинство авторов считают целостность его костного остова, сохранение иннервации и магистральных сосудов, сухожилий, адекватное состояние кожных покровов, отсутствие приводящих контрактур первой пястной кости, наличие достаточной подвижности суставов. При повреждениях и дефектах пальцевых артерий подобные операции, как правило, не выполнялись, а при наличии многокомпонентных дефектов и деформаций мягких тканей и костного остова донорского сегмента, приводящих контрактур первой пястной кости известные методики часто оказываются неприменимы с технической точки зрения. Кроме того, среди хирургов нет единого мнения относительно целесообразности перемещения сегмента кисти с тяжелой степенью деформации. Большинство специалистов считают бесперспективным использование изначально мало- или афункционального трехфалангового пальца или его культи для реконструкции первого, а также отмечают наличие высокого риска развития ишемических осложнений, вплоть до полного его некроза, вследствие обширных рубцовых изменений тканей, а также первичного или вторичного нарушения магистрального кровообращения и венозного оттока. По их мнению, такой сегмент, перенесенный в позицию первого пальца, не приведет к улучшению функции кисти. По этой причине актуальным является изучение возможностей перемещения тяжелодеформированных сегментов кисти в атипичных условиях для реконструкции пальцев кисти при последствиях ее повреждений. Кроме того, необходимо разработать новые способы реконструкции пальцев с использованием данного донорского материала, обеспечивающие надежную профилактику ишемических осложнений и адекватные функциональные результаты.
Цель исследования – разработать новые подходы к реконструкции пальцев кисти путем перемещения ее сегментов, имеющих посттравматические дефекты, деформации мягких тканей и костного остова.
Материалы и методы исследования
Перемещение сегмента в атипичных условиях выполнено у 52 больных на 52 кистях. Реконструкция первого пальца осуществлена у 51 больного, третьего пальца – у 1 больного. Средний возраст пациентов составил 32,15±1,75 года. Восстановительная операция проведена через 764,44 ±228,07 дня после получения травмы. Правая кисть была поражена у 28 больных, а левая – у 24. Мужчин было 43 человека, женщин – 9 человек. Последствия механической травмы были у 29 пациентов, огнестрельных ранений – у 8, ожогов пламенем – у 6, электроожогов – у 4,отморожений – у 4, последствия комбинированной травмы имели место у 1 человека. Критериями включения в исследование были: 1) возраст больных от 18 до 65 лет; 2) наличие культи первого пальца на различных уровнях основной фаланги и пястной кости и трехфалангового пальца на различных уровнях средней, основной фаланг и пястной кости; 3) наличие на кисти трехфалангового пальца, культи этого пальца или соответствующей пястной кости, имеющих дефекты мягких тканей, костного остова и магистральных сосудов, контрактуры суставов, а также обширных рубцовых изменений. Критериями исключения были возраст пациентов моложе 18 и старше 65 лет, отсутствие выраженных рубцовых изменений тканей, дефектов мягких тканей и костного остова, контрактур суставов донорского сегмента и первой пястной кости, нарушений магистрального кровообращения кисти и пальцев. Изолированное отсутствие первого пальца отмечалось у 26 больных, первого и одного трехфалангового пальца – у 13, отсутствие первого и двух или трех трехфаланговых пальцев – у 4, отсутствие всех пальцев – у 9. Реконструкция пальца выполнялась при его отсутствии на уровне средней трети средней фаланги (1), средней трети основной фаланги (1), проксимальной трети основной фаланги (16), головки пястной кости (11), дистальной трети пястной кости (6), средней трети пястной кости (1), проксимальной трети пястной кости (5), костей запястья (11). На всех оперированных кистях отмечались рубцовые изменения мягких тканей кисти различной степени тяжести. Определялись приводящие контрактуры первой пястной кости первой (20), второй (5), третьей (4), четвертой (7) степени. Проведены перемещение второго пальца с деформацией фаланг (1), в состоянии сгибательной контрактуры (14), разгибательной контрактуры (5), сгибательной контрактуры и дефектом основной фаланги (1), с дефектом основной фаланги (1), с переломом основной фаланги (1), с переломом пястной кости (1), с дефектом пястной кости (3), а также перемещение третьего пальца в состоянии сгибательной контрактуры (3). Кроме того, выполнено перемещение культи второго пальца на уровне ногтевой фаланги (1), головки основной фаланги (2), головки средней фаланги (2), основания основной фаланги (3), проксимальной трети основной фаланги (1), дистальной трети основной фаланги (1), средней трети основной фаланги (1), головки пястной кости (7). Выполнено также перемещение культи третьего пальца на уровне проксимальной трети основной фаланги (1), головки пястной кости (1), культи средней трети средней фаланги четвертого пальца (1). Перемещение сегмента выполняли после его остеотомии, пересечения сухожилий разгибателей и мобилизации его образовавшейся дистальной части на питающих ножках, представляющих собой тканевые мостики различного строения и состава, связывающие сегмент с кистью. Как правило, чаще всего формировали кожно-сосудистые ножки по Хильгенфельдту–Шушкову. В питающую ножку включали кожную ленту (кожный лоскут П-образной формы, мостовидный кожный лоскут) шириной 1,5–2см, в том числе и рубцово-измененную, прикрывающую сосудисто-нервные пучки и связанную с ними на всем протяжении при их сохранении. Если рубцы были локализованы только в пределах кожи, имелась возможность перемещения сегмента на сосудисто-нервных пучках, прикрытых рубцово-измененной кожной лентой. В состав ладонной питающей ножки наряду с кожной лентой включали пальцевые сосудисто-нервные пучки и сухожилия сгибателей. При наиболее тяжелых дефектах и деформациях донорского сегмента, неизбежно приводящих к нарушению его кровообращения, использовали две питающие ножки – ладонную и тыльную различного строения (состава) и в различных комбинациях в зависимости от характера деформации кисти и степени сохранности магистральных сосудов. Тыльная питающая ножка также включала кожную ленту шириной 1,5–2 см, прикрывающую сохранившиеся тыльные сосуды (подкожные вены, тыльные пястные артерии) или не содержащую их. Тыльную питающую ножку применяли только совместно с ладонной. Однако тыльная кожно-сосудистая ножка в условиях повреждения ладонных пальцевых артерий являлась основной. В условиях рубцовых тканей ножку формировали «en masse», не выделяя из нее артерий, вен, сухожилий. При сохранении ладонных сосудисто-нервных пучков и тыльных магистральных подкожных вен кожную ленту в состав тыльной питающей ножки не включали. На двух питающих кожно-подкожно-фасциальных ножках палец или культю пальца перемещали при обширных рубцовых изменениях тканей, повреждении ладонных сосудов, облитерации тыльных подкожных вен и отсутствии возможности их восстановления. Кровоток перемещаемого сегмента интраоперационно верифицировали по цвету кожных покровов, скорости наполнения кожного «сосудистого пятна». Артериальная недостаточность проявлялась бледностью кожных покровов, замедленной реакцией капилляров и слабым кровотечением на разрезе тканей. Признаками венозной недостаточности были синюшность кожных покровов, ускоренная реакция «сосудистого пятна», темный цвет крови на разрезе. При перемещении сегмента на двух питающих ножках неизбежно формировался дефект мягких тканей в донорской области и возникала необходимость применения различных вариантов свободной, комбинированной и лоскутной кожной пластики из отдаленных областей, так как возможности местной кожной пластики в подобных условиях были весьма ограничены из-за рубцовой ретракции тканей. Замещение предсуществовавших и/или образовавшихся в ходе операции дефектов донорского сегмента выполняли методом пластики полнослойным кожным трансплантатом (24), стеблем Филатова (8), сдвоенным лоскутом Конверса–Блохина (5), стеблем Филатова в комбинации со свободным кожным трансплантатом (1), несвободным паховым лоскутом в комбинации со свободным кожным трансплантатом (1), стеблем Филатова в комбинации с островковым лоскутом на тыльной межкостной артерии (1). Свободные кожные трансплантаты применяли при контрактурах пальцев и кисти средней степени тяжести и наличии мягкотканого кровоснабжаемого реципиентного ложа. Кожно-жировые лоскуты использовались для устранения тяжелых контрактур донорского сегмента и первой пястной кости, замещения обширных и глубоких рубцовых дефектов кисти, сопровождающихся обнажением сухожилий, костей и суставов, формирования области тенара и первого межпальцевого промежутка, а также питающих ножек донорского сегмента. В случае тотальных рубцовых изменений мягких тканей кисти после приживления сдвоенного кожно-жирового лоскута и наступления реваскуляризации подлежащих тканей выполняли перемещение сегмента на тыльной и ладонной питающих ножках, сформированных полностью из пересаженного лоскута (патент РФ № 2391930). Две широкие кожно-подкожно-фасциальные питающие ножки (2–2,5 см, максимальной ширины) с неосевым кровоснабжением, сформированные из предварительно пересаженного кожно-жирового лоскута, обеспечивают адекватное кровоснабжение даже пальца полной длины, лишенного магистральных сосудов (артерий и вен) за счет хорошо развитой поверхностной и глубокой артериальной сосудистой сети и венозных сплетений кожи. Разработанный нами способ позволяет сформировать область тенара, первого межпальцевого промежутка, заместить дефект мягких тканей донорского пальца за счет использования одного трехлопастного стебля Филатова и переместить дефектный палец на двух питающих ножках (патент РФ № 2577948 от 18.02.2016 г.). Как показывает наш опыт, должен быть индивидуальный подход к формированию питающих ножек, выбору метода лоскутной пластики в зависимости от характера деформации, состояния мягких тканей и кровообращения. Поэтому перед операцией большое значение придавали исследованию сосудов кисти и пальцев. Применяли различные варианты формирования питающих ножек в зависимости от степени рубцовых изменений тканей, состояния кожных покровов, а также сохранности ладонных пальцевых сосудисто-нервных пучков и тыльных пястных артерий, а также подкожных вен кисти и пальцев. Были сформированы ладонная кожно-сосудисто-нервная и тыльная венозная (23), ладонная кожно-сосудисто-нервная и тыльная кожно-сосудистая (17), ладонная кожно-сосудисто-нервная и тыльная кожно-подкожно-фасциальная (1), ладонная кожно-подкожно-фасциальная и тыльная кожно-сосудистая (4), ладонная и тыльная кожно-подкожно-фасциальные ножки (1), ладонная рубцово-кожно-сосудисто-нервная ножка (5), ладонная сосудисто-нервная и тыльная кожно-подкожная ножка (1). Кожно-подкожно-фасциальные ножки в виде кожной ленты создавали из пересаженного кожно-жирового лоскута. Венозная ножка состояла из одной или нескольких сохранившихся (при перемещении второго пальца) или восстановленных с применением микрохирургической техники и мобилизованных тыльных подкожных вен пальца или кисти в случае перемещения третьего, четвертого, пятого пальцев. Чем тяжелее была деформация перемещаемого сегмента и сложнее условия его перемещения, тем больше показаний возникало к лоскутной пластике и разнообразнее были варианты формирования питающих ножек и кожной пластики. Таким образом, системы выбора источников питания и лоскутной пластики при атипичном перемещении сегмента были взаимосвязаны, так как выбор варианта лоскутной пластики зависел не только от характера дефекта, но и варианта формирования питающей ножки или ножек. В связи с этим осуществлялся выбор источников питания и соответственно вариантов лоскутной пластики в каждом конкретном случае. В наиболее тяжелых случаях возникала необходимость в комбинировании различных вариантов лоскутной пластики и выкраивания питающих ножек. Остеосинтез перемещенных сегментов с культей восстанавливаемого пальца осуществляли наложением костного шва (4), перекрещивающимися спицами (19), методом внедрения (17), методом внедрения и спицами (8), интрамедуллярным костным штифтом (3), интрамедуллярным костным штифтом и спицами (1). Разработанные подходы позволяют переместить любой сегмент, несмотря на тяжесть патологических изменений и нарушения кровообращения его тканей, при любом расположении донорской и воспринимающей культей и уровнях их ампутации. После реконструкции пальца в ряде случаев потребовалось выполнение на нем корригирующих вмешательств (20). Выполнены артродез дистального межфалангового сустава (1), артродез проксимального межфалангового сустава (1), артродез пястно-фалангового сустава (2), корригирующая остеотомия основной фаланги (1), корригирующая остеотомия пястной кости (2), дистракционное удлинение в сочетании с костной пластикой (1), костная аутопластика пястной кости трансплантатом из второй плюсневой кости на микрососудистых анастомозах (2), костная аллопластика дефекта пястной кости (1). Кроме того, выполнены шов (3), пластика сухожилия разгибателя пальца (4), тенодез ногтевой фаланги (1), транспозиция сухожилия разгибателя третьего пальца на первый палец (1).
В работе применены клинические, рентгенологические, биомеханические, биофизические и статистические методы исследования. Для обработки статистических данных использованы программы STATISTICA 6,0 и STATISTICA 10.
Результаты исследования и их обсуждение
Послеоперационные раны после реконструкции пальца и выполнения корригирующих операций на нем зажили первичным натяжением. В 100% случаев достигнуто приживление всех перемещенных сегментов, пересаженных кожных трансплантатов, кожно-жировых лоскутов. Результаты реконструкции зависели от уровня ампутации восстанавливаемого пальца и степени выраженности остаточной функции донорского сегмента. При культях на уровне основания и дистальной трети пястной кости результаты сгибания в межфаланговом суставе были лучше, чем в культях на уровне основной фаланги и головки пястной кости (Р=0,06). Функции приведения первого пальца (Р=0,01) и его противопоставления (Р=0,015) были лучше при культях на уровне основания основной фаланги и головки пястной кости, чем при проксимальной трети пястной кости. Показатели противопоставления первого пальца (Р=0,001) и сгибания в пястно-фаланговом суставе (Р=0,022) также были лучше при культях на уровне основания основной фаланги и головки пястной кости, чем при тотальном отсутствии луча. Установлена зависимость результатов от этиологии дефекта. Так, функция противопоставления была лучше при последствиях механической травмы, чем отморожений (Р=0,05). Результаты перемещения культей пальцев и пястных костей, а также афункциональных пальцев были примерно одинаковыми (Р=0,71). Отдаленные результаты лечения оценены у 41 больного с использованием методики А.Е. Белоусова (1984), усовершенствованной нами. Нами исследовались боковой и щипковый схваты. Обследование силовой функции кисти проводили по методике И.В. Хлызовой с соавт. (2013) [9]. Отличные результаты получены у 1 (2,4%), хорошие – у 5 (12,2%), удовлетворительные – у 29 (70,7%), неудовлетворительные – у 6 (14,6%) больных. В итоге восстановление функции схвата достигнуто у 85,4% больных.
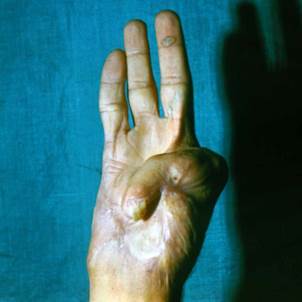
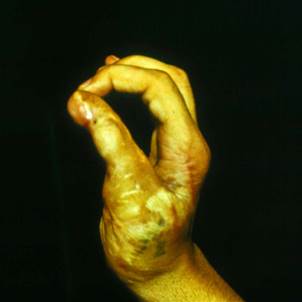
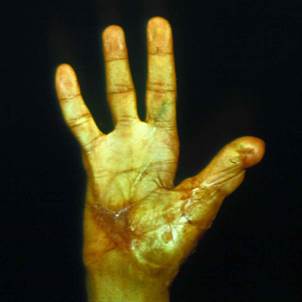
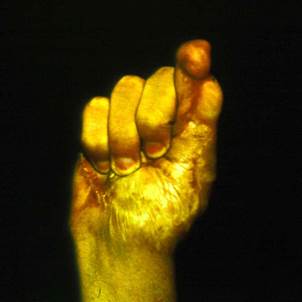
Клинический пример. Мужчина, 23 лет, находился в микрохирургическом отделении Университетской клиники ПИМИУ по поводу культи первой пястной кости на уровне проксимальной трети, сгибательной дермато-тено-артрогенной контрактуры, неправильно сросшегося перелома основной фаланги второго пальца левой кисти. Пациент ранее получил тяжелую термомеханическую травму в результате попадания кисти под пресс. При поступлении в клинику отмечаются грубая деформация, отсутствие функции двухстороннего схвата кисти (рис. 1). Пациенту выполнено перемещение второго пальца в позицию первого пальца на двух питающих ножках: кожно-сосудисто-нервной ладонной и тыльной кожно-сосудистой. Адекватное кровоснабжение перемещенного донорского пальца позволило одномоментно устранить его контрактуры. Образовавшиеся дефекты кожи в области первого межпальцевого промежутка и тыле кисти были замещены полнослойными кожными трансплантатами, взятыми по методу Б.В. Парина. Достигнуто приживление пальца без развития ишемических нарушений. В последующем выполнены корригирующие операции на мягких тканях и костном остове восстановленного первого пальца. Пациент осмотрен через 1 год после операции. Восстановлены двухсторонний схват кисти, возможность отведения и противопоставления первого пальца всем сохранившимся (рис. 2, 3, 4). Дискриминационная чувствительность на первом пальце составила 2 мм.
|
|
|
|
Рис. 1 |
Рис. 2 |
|
|
|
|
Рис. 3 |
Рис. 4 |
Рис. 1. Внешний вид кисти до операции. Рис. 2. Функция противопоставления восстановленного первого пальца через 1 год после операции. Рис. 3. Функция отведения восстановленного первого пальца через 1 год после операции. Рис. 4. Функция схвата кисти через 1 год после операции
Как показало проведенное исследование, при дефектах и рубцовых изменениях мягких тканей, первичном и вторичном повреждении сосудов, деформациях костного остова донорского сегмента должны применяться атипичные методики его перемещения. Главным принципом операции перемещения патологически измененного сегмента служит максимально возможное улучшение его кровообращения за счет использования сохранившихся сосудов и формирования новых источников кровоснабжения. Основным элементом технологии атипичного перемещения сегмента явилось персонифицированное формирование двух питающих ножек (тыльной и ладонной) различного строения и состава, обеспечивающих адекватное кровоснабжение перемещенного сегмента и его надежное приживление. Известны методики, предусматривающие формирование дополнительной тыльной питающей ножки перемещаемого сегмента [10, 11]. Однако они не могут быть применены при обширных рубцовых изменениях мягких тканей кисти, сопровождающихся склерозированием, облитерацией или повреждением глубоких и тыльных подкожных вен, а также пястных артерий. Кроме того, эти методики осуществимы по ограниченным показаниям, применительно к рядом расположенным донорским и реципиентным сегментам, при отсутствии глубоких рубцовых дефектов кожи и контрактур, обеспечивают профилактику преимущественно венозной недостаточности, позволяют переместить только культю пальца или пястной кости. В связи с этим возникла необходимость разработки методик перемещения ишемизированных пальцев, культей пальцев и пястных костей. Многообразие и многокомпонентность деформаций донорского сегмента обусловливают необходимость строгого индивидуального подхода к выполнению операции. Определение показаний к перемещению, а также выбор методики формирования питающих ножек зависят от состояния сосудов донорского сегмента и характера его кровоснабжения, в связи с чем обязательным является исследование перед операцией его сосудистого русла, что совпадает с мнением других авторов [7, 12]. Мы считаем, что в условиях рубцовых изменений тканей и сохранения пальцевых сосудов сегмент кисти необходимо перемещать на кожно-сосудистой питающей ножке. При перемещении пальца в ситуации сохранения его ладонных сосудов и включения их в состав питающей ножки наиболее часто развивается его венозная недостаточность, так как венозный отток по подкожным венам кожного мостика и глубоким пальцевым венам в составе питающей ножки часто бывает недостаточным. В связи с этим необходимо сохранять или восстанавливать с применением прецизионной техники его тыльные подкожные вены, а при их облитерации – формировать тыльную кожно-подкожную питающую ножку, в том числе и из пересаженного кожно-жирового лоскута. Такая питающая ножка обеспечивает адекватный венозный отток из сформированного пальца совместно с кожно-подкожным компонентом ладонной кожно-сосудистой ножки в условиях сохранения магистрального кровоснабжения пальца. При дефектах и повреждениях ладонных пальцевых артерий, обширных рубцовых изменениях мягких тканей, как правило, развивается артериальная недостаточность донорского сегмента после его перемещения. В этих условиях его достаточная артериализация, включая и пальца полной длины, достигается за счет использования ладонной кожно-фасциально-подкожной и тыльной кожно-сосудистой ножек, содержащих тыльные пястные артерии. Адекватное кровоснабжение сегмента в условиях полного отсутствия его осевого кровоснабжения вследствие повреждения тыльных и ладонных сосудов может быть обеспечено также за счет выкраивания двух (ладонной и тыльной) широких (2,0–2,5 см) кожно-подкожно-фасциальных ножек с неосевым типом кровоснабжения, в том числе полностью сформированных из пересаженного кожно-жирового лоскута. Это обусловлено тем, что пересаженные кожно-жировые лоскуты обладают выраженными реваскуляризирующими свойствами. Наиболее подходящими для этих целей, а также формирования области тенара, первого межпальцевого промежутка и устранения контрактур донорского сегмента, на наш взгляд, являются лоскуты на временных питающих ножках. Венозный отток по двум кожно-подкожным питающим ножкам при таком редуцированном типе кровоснабжения перемещенного сегмента является более чем достаточным, имеющим значительные резервные возможности. В случае рубцовых изменений мягких тканей кожно-сосудисто-нервную ножку необходимо формировать «en masse», не выделяя из ее состава сосудов. Рубцово-измененная кожа тыльной и ладонной поверхности кисти может быть включена в состав питающей ножки, если рубцы не проникают (распространяются) глубже подкожной клетчатки. Безусловно, в современных условиях могут быть использованы пластика или шов пальцевых артерий с применением микрохирургической техники. Однако такое вмешательство при наличии грубых рубцовых изменений мягких тканей сопряжено с высоким риском развития тромбозов микрососудистых анастомозов и некроза перемещенного пальца. По этой причине наш подход является более надежным и менее травматичным, позволяет расширить возможности перемещения патологически измененных сегментов. Дифференцированное применение различных вариантов формирования питающих ножек, лоскутной кожной пластики из отдаленных областей, а также комбинированной кожной пластики позволило переместить любой сегмент кисти независимо от степени тяжести его деформации, патологических изменений, обеспечить надежную профилактику артериальной и венозной недостаточности сформированного пальца и добиться адекватного функционального результата. Во всех случаях атипичного перемещения подобных сегментов нами было достигнуто их приживление в 100% случаев и восстановление двухстороннего схвата. Обеспечение достаточного кровоснабжения и формирование адекватного кожного покрова на восстановленном пальце и кисти позволяют успешно выполнять корригирующие вмешательства на их кожных покровах, костном остове и сухожилиях. Подобные вмешательства могут быть выполнены одномоментно с реконструкцией пальца или после нее в зависимости от тяжести и распространенности патологического процесса. В целом исследование показало, что наличие повреждений, дефектов кожных покровов, костей, суставов, сухожилий, сосудов и нервов донорского сегмента не может служить противопоказанием к его перемещению.
Заключение. Перемещение деформированного сегмента с успехом может быть выполнено с применением атипичных методик, которые позволяют успешно переместить сегмент кисти и добиться его приживления независимо от степени тяжести деформации, патологических изменений и нарушения кровообращения тканей.
Библиографическая ссылка
Александров Н.М., Купцов Д.А., Вешаев И.Д. АТИПИЧНОЕ ПЕРЕМЕЩЕНИЕ СЕГМЕНТОВ КИСТИ ПРИ ПОСЛЕДСТВИЯХ ТРАВМЫ // Современные проблемы науки и образования. 2020. № 5. ;URL: https://science-education.ru/ru/article/view?id=30243 (дата обращения: 11.03.2026).
DOI: https://doi.org/10.17513/spno.30243