Одной из актуальных проблем современной травматологии и ортопедии остается вопрос восстановления и замещения дефектов или патологически измененной костной ткани [1–3]. Длительное изучение применения аутокости определило ее золотым стандартом в ряду пластических костных материалов. Однако малый объем трансплантата, повреждение донорского участка, различие в структуре и биомеханике частей скелета ограничивают использование указанного материала [4]. Поэтому при решении данных проблем современные тенденции диктуют новые направления в создании биоинженерных конструкций, которые могли бы сохранять способность к стимуляции процессов остеогенеза при их применении с биоинертными имплантатами с минимальной токсичностью и достаточной механической прочностью. Использование для этих целей клеточных технологий показывает определенные успехи. Однако увеличение объемов клеточного трансплантата при применении с носителями (скаффолдами и т.д.) увеличивает риски нарушения его питания в центральных отделах, что приводит к гибели клеток [5]. Наличие капилляров с эндотелиальной выстилкой у остеотрансплантата в условиях заполнения им костного дефекта обеспечивает созревание костной ткани равномерно, во всем объеме остеотрансплантата [6]. Однако недостаточно изучено формирование кости в случаях использования остеотрансплантата с биоинертными имплантатами, которые ограничивают его контакт с костным ложем при выполнении межтелового спондилодеза.
Цель исследования: сравнить качественно процесс остеогенеза при выполнении межтелового спондилодеза аллогенным остеотрансплантатом (АОТ) и аутотрансплантатом (АТ) с фиксацией керамическими имплантами.
Гипотеза. Формирование органоспецифической кости и костного сращения (костного блока) при выполнении межтелового спондилодеза АОТ в условиях фиксации позвоночного сегмента керамическими имплантатами происходит в те же сроки, что и при использовании АТ, при тех же условиях.
Материалы и методы исследования. Предварительно проведенные нами экспериментальные исследования в разные сроки процессов репаративной регенерации АОТ по пластике дефектов и переломов тел позвонков позволили определить его преимущества по отношению к АТ, которые были выявлены к сроку 90 дней после проведения острого эксперимента [6]. Это послужило основанием определить этот же срок контрольным (90 дней) для оценки качества остеогенеза и сформированных регенератов при выполнении межтелового спондилодеза этими пластическими материалами в сочетании с керамическими имплантатами. Экспериментальное исследование (на 20 мини-пигах возрастом 6 месяцев) проведено согласно этическим нормам, регламентирующим эксперименты на животных в соответствии с международными и российскими нормативно-правовыми документами («Европейская Конвенция о защите позвоночных животных, используемых для экспериментов или в иных научных целях: EST № 123» от 18 марта 1986 г., Страсбург, 1986; приказ Министерства здравоохранения Российской Федерации от 19.06.2003 г. № 267 «Об утверждении правил лабораторной практики», ГОСТ 10993-2-2011). Основой для создания АОТ служили хондротрансплантаты, изготовленные из культивированных хондробластов, извлеченных в стерильных условиях из пластинки роста тела позвонка новорожденного мини-пига [7]. Размеры сформированных трансплантатов варьировали и в объеме составляли от 6 до 8 мм3 (рис. 1).
АТ брался в ходе операции из кости центральной части вентральных отделов, расположенных на два позвоночных сегмента выше тел позвонков. Оперативное вмешательство на поясничном отделе мини-пигов проводилось под общим обезболиванием. Межтеловой спондилодез выполняли следующим образом: после выделения вентральных отделов позвоночника на уровне L3–L4 иссекался диск с замыкательными пластинками смежных позвонков до появления кровяной росы. Придавалось положение экстензии, при котором высота межтелового промежутка увеличивалась. Затем в сформированный дефект устанавливали керамический фиксатор с полостью внутри, заполненной АОТ (1-я серия – 10 животных) (рис. 2), АТ (2-я серия – 10 животных) (рис. 3).
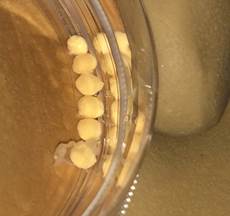
Рис. 1. АОТ в чашке Петри
 (а)
(а)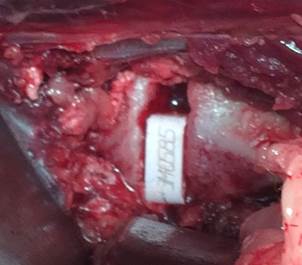 (б)
(б)
Рис. 2. Имплантат заполнен АОТ (а) и помещен в межтеловой промежуток (б)
После устранения экстензии имплантат плотно заклинивался в дефекте. В каждом отдельном случае проводилась вентральная фиксация керамической пластиной с введением винтов в смежные дефекту тела позвонков (рис. 4). Эффективность проведенного оперативного вмешательства контролировалась сразу после выполненной операции путем проведения рентгенографического исследования поясничного отдела позвоночника. Животные содержались однотипно и наблюдались в течение 90 дней, затем выводились из эксперимента. Готовились макропрепараты области оперативного вмешательства. Они подвергались компьютерно-томографическому (КТ) исследованию. Проводилась оценка рентгенологической плотности костной ткани (ПКТ) в единицах HU, остеоинтеграции трансплантатов с ложем с использованием классификации Tan G. H. et al. (2007) [8].
 (а)
(а) 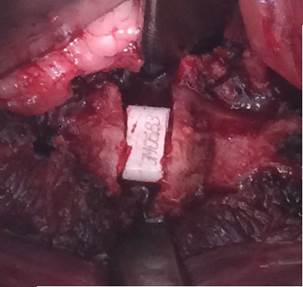 (б)
(б)
Рис. 3. Имплантат заполнен костным АТ (а) и помещен в межтеловой промежуток (б)
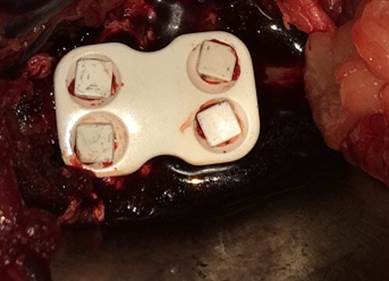
Рис. 4. Пластина, установленная по вентральной поверхности тел позвонков
Остеогенез оценивался по данным гистологического исследования препаратов после их подготовки и окраске по Ван Гизону. Расчеты микротвердости проводились на основе данных, полученных на приборе ПМТ-3, использовалась формула Виккерса [9]. Минеральная насыщенность (МН) костной ткани (кальцием и фосфором), состоящей в большинстве своем из кристаллов Сa10(PO4)6(OH)2, определялась на сканирующем электронном микроскопе Carl Zeiss EVO50, дающем большую точность [1]. Для получения объективной характеристики остеогенеза изучаемые параметры определялись в выделенных зонах пластического материала и ложа, одинаково расположенных от оси, проходящей через центр отверстия керамического имплантата, находившегося в межтеловом промежутке (рис. 5).
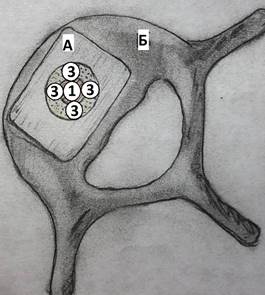
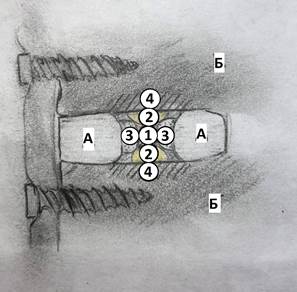
Рис. 5. Зоны проведения измерений при вентральном межтеловом спондилодезе в группах 1 и 2: А – имплантат, Б – тело позвонка; 1 – центр регенерата; 2 – край регенерата, прилегающий к телу позвонка; 3 – край регенерата, прилегающий к имплантату; 4 – край тела позвонка, прилегающий к регенерату
Сравнение групп по количественным показателям было проведено при помощи непарного рангового непараметрического критерия Манна–Уитни. В случае одной пары сравнений различия считали статистически значимыми при уровне значимости менее установленного значения 0,05. В случае множественных сравнений различия считали значимыми при учете поправки Бонферрони (УПБ): для пяти пар сравнения пороговый уровень альфа принимали равным 0,05/5=0,01; для шести пар сравнений пороговый уровень альфа принимали равным 0,05/6=0,008333; для семи пар сравнений альфа принимали равным 0,05/7=0,00714. Статистический анализ был проведен с использованием программного обеспечения IBM SPSS Statistics (версия 21.0).
Результаты исследования и их обсуждение
Межгрупповое сравнение выявило значимую различную РПКТ в зонах 1, 2, 3. Причем плотность была больше в 1,4 раза в группе 1 (P<0,008333 с УПБ). Также в ней отмечено в 1,5 раза преимущество и общих показателях РПКТ (P<0,00833 с УПБ) (табл. 1).
МТ регенерата в группе с АОТ в среднем оказалась в 1,32 раза (20,67 HV) выше, чем в группе применялся АТ для зон 1, 2 и 3 между группами соответственно), как и общих показателей МТ в группах в 1,37 раза (P<0,008333; с учетом ПБ) (табл. 2).
Таблица 1
Показатели РПКТ в группах 1 и 2
|
Наименование показателя |
Группа 1 (n=10) |
Группа 2 (n=10) |
|
Зона 1, HU |
1080 [1036; 1115]* |
657 [581; 702]* |
|
Зона 2, HU |
1096 [1025; 1138]* |
890 [838; 943]* |
|
Зона 3, HU |
1030 [984; 1106] * |
686 [602; 783]* |
|
Общий показатель, HU |
1078 [1012; 1115]* |
711 [622; 864,5]* |
|
Зона 4, HU |
1067 [1058; 1191]* |
950 [904; 1015]* |
Примечание. Данные представлены в виде Me [Q25; Q75]. Результаты оценены с помощью непараметрического критерия Манна–Уитни с ПБ как статистически значимые (P<0,008333): * – результат является статистически значимым по отношению к соответствующим значениям другой группы
Таблица 2
Результаты сравнения микротвердости костной ткани в группах 1 и 2
|
Наименование показателя |
Группа 1 (n=10) |
Группа 2(n=10) |
|
Зона 1, HV |
86,5 [85; 90,2]* |
61,2 [56,1; 66,1]* |
|
Зона 2, HV |
87,8 [85,9; 91,2]* |
78,5 [74,8; 81,9]* |
|
Зона 3, HV |
85,9 [84,8; 90,4]* |
63,0 [58,9; 65,1]* |
|
Общий показатель, HV |
87,9 [85,80; 90,25]* |
63,5 [60,2; 76,2]* |
|
Зона 4, HV |
89,9 [88,4; 93,2]* |
81,8 [79,0; 86,1]* |
Примечание. Данные представлены в виде Me [Q25; Q75]. Результаты оценены с помощью непараметрического критерия Манна–Уитни с ПБ как статистически значимые (P<0,01): * – результат является статистически значимым по отношению к соответствующим значениям другой группы
Были определены и значимые различия между группами во всех выделенных зонах измерений по содержанию Са и Р. Эти показатели были выше в группе 1, соотношение составило 1,46/1,32 раза (324,33/20,67 %) для Ca и P (P<0,008333/0,008333; с учетом ПБ для зон 1, 2 и 3). Общие показатели МП общих показателей также статистически значимо различались в пользу группы 1 (P<0,008333 как для Ca, так и для P) (табл. 3).
Таблица 3
Результаты сравнения спектрометрии костной ткани в группах 1 и 2
|
Наименование показателя |
Спектрометрия Ca, % |
Спектрометрия P, % |
||
|
Группа 1 (n=10) |
Группа 2(n=10) |
Группа 1 (n=10) |
Группа 2(n=10) |
|
|
Зона 1 |
17,1 [16,90;17,71]* |
10,13 [9,8; 11,2]* |
13,95 [12,54;15,68]* |
7,42 [6,51; 8,21]* |
|
Зона 2 |
17,4 [16,77; 17,59]* |
13,9 [13,09; 15,19]* |
15,95 [15,45; 16,35]* |
11,40 [10,33; 12,11]* |
|
Зона 3 |
17,0 [15,44; 17,61]* |
10,51 [9,83; 10,98]* |
15,07 [13,81; 15,22]* |
8,04 [6,93; 8,86]* |
|
Общий показатель |
17,11 [16,77; 17,60]* |
13,61 [9,72; 14,62]* |
15,04 [13,94; 15,94]* |
10,28 [7,38; 11,51]* |
|
Зона 4 |
17,44 [17,03; 17,81]* |
15,1 [13,90; 17,02] |
15,45 [14,77; 15,91]* |
12,09 [11,13; 12,62] |
Примечание. Данные представлены в виде Me [Q25; Q75]. Результаты оценены с помощью непараметрического критерия Манна–Уитни с ПБ как статистически значимые (P<0,008333): * – результат является статистически значимым по отношению к соответствующим значениям другой группы
Ложе (зона 4) отреагировало увеличением всех исследуемых показателей в группе 1. Так, его РПКТ была больше в 1,12 раза (193 HU) в образцах, где использовался АОТ (P<0,008333 с учетом ПБ). МТ кости ложа группы 1 увеличилась по сравнению с показателями 2-й группы в 1,1 раза (9,7 HV) (P<0,008333). При спектрометрии кости ложа выявили большее содержание кальция и фосфора, но в меньшей пропорции, соответственно в 1,18/1,29 раза (2,7% / 3,41%) в пользу АОТ (P<0,008333/0,008333). Морфологические исследования костной ткани показали, что в зоне бывшего пластического замещения АОТ сформирована органоспецифичная костная ткань. Между костными структурами располагался красный костный мозг (рис. 6 а, б). Однако в области пластики АТ определялись редкие костные включения, которые не контактировали между собой. В центральной части выявлены значительные нерассосавшиеся фрагменты костного аутотрансплантата, в них врастали костные балки. Данная морфологическая картина говорит о том, что в центральной части продолжается формирование костного блока (рис. 6в).
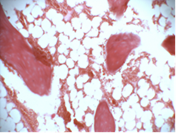 а
а 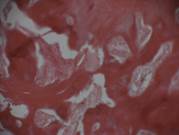 б
б  в
в
Рис. 6. Данные световой микроскопии при вентральном межтеловом спондилодезе с использованием: АОТ (а, б), АТ (в) через 90 суток после имплантации; окраска гематоксилин-эозином, х200
Все пластические материалы, в том числе тканеинженерные конструкции, используемые при замещении дефектов тел позвонков, имеют свои недостатки, поиск идеального остеопластического материала по сей день остается актуальной проблемой [10, 11]. Не менее важной задачей является и поиск материалов, обладающих биоактивностью и в то же время не подавляющих свойства пластических материалов при их совместном использовании. Среди материалов особое место занимают имплантаты из композитов, которые также могут использоваться для создания конструкций при помощи 3D-технологий. Алюмоксидная керамика обладает биоинерностью и повышенными прочностными характеристиками [12]. Поэтому мы использовали разработанные нами и разрешенные к применению импланты из этого материала, что обеспечило равные условия хорошей фиксации позвоночного сегмента на уровне, где выполнялся межтеловой спондилодез [13, 14]. В случае заполнения АОТ (группа 1) РПКТ и МТ к сроку 90 суток в исследуемых зонах как внутри регенерата, так и по периферии соответствовали таковым в области тела позвонка. Такое распределение параметров говорит о формировании органоспецифической костной ткани и равномерном течении процесса во всем объеме пластического замещения независимо от расположения зон исследования относительно керамического имплантата и ложа реципиента. Морфологическое исследование показало, что формирование костной ткани в области пластического замещения происходило в этом случае независимо от наличия или отсутствия его прямого контакта с костным ложем, чего нельзя сказать в случае использования АТ, где процесс идет медленнее, путем ползучего замещения, начиная с резорбции трансплантата и заканчивая формированием новой костной ткани. Значения Ca/P внутри АОТ между зонами в этой группе указывали на то, что процесс остеорепарации идет равномерно и соответствует содержанию этих элементов в телах смежных позвонков. А при оценке значений конкретных зон в случаях применения АОТ выявлено следующее: имеется прямо пропорциональная зависимость между показателями рентгеноплотности и микротвердости; остеотрансплантат сохраняет скорость минерализации независимо от места в его объеме. Керамический имплантат не усугубляет процессы формирования кости. АТ к этому же времени снижает минерализацию за счет все той же резорбции, процесс создания костной ткани не восполняет потерю прочности. Принципиально, что формирование органоспецифической кости АОТ приводит к слиянию с костным ложем с формированием костного блока 1-го типа по Tan. В этом случае процесс образования костной ткани проходил равномерно во всем объеме пластического замещения благодаря наличию остеогенных клеток и матрикса, содержащего тканеспецифические белки предкостной ткани, минеральные компоненты в виде матричных пузырьков и кальцификатов, щелочной фосфатазы и капилляры с эндотелиальной выстилкой [15], что позволило обеспечить быструю адаптацию после пересадки, чего не отмечается при использовании АТ. По показателям РПК смежные тела позвонков превосходят АТ, гистологически в его костное ложе не определяется регулярный переход костных балок. Исходя из данных исследователей, при замещении дефектов кости мезенхимальными стволовыми клетками (МЗСК) имеет принципиальные отличия от АОТ в силу того, что васкуляризация с эндотелиальной выстилкой сосудов равномерна по всему его объему [15]. Это обеспечивает лучшие условия и уменьшает возможность некрозов в его центральной части, что часто возникает при имплантации МЗСК в условиях заключения их в скаффолды [5, 16].
Заключение. При выполнении межтелового спондилодеза в условиях фиксации позвоночного сегмента керамическими имплантатами аллогенный остеотрансплантат имеет больший регенераторный потенциал, что способствует более раннему формированию органоспецифической костной ткани (высокой степени минерализации и прочности), нежели костный аутотрансплантат.
Библиографическая ссылка
Рерих В.В., Предеин Ю.А., Батаев В.А., Никулина А.А., Ластевский А.Д., Зайдман А.М. ФОРМИРОВАНИЕ КОСТНОГО БЛОКА ПРИ ВЫПОЛНЕНИИ МЕЖТЕЛОВОГО СПОНДИЛОДЕЗА ОСТЕОТРАНСПЛАНТАТОМ И АУТОКОСТЬЮ В УСЛОВИЯХ ФИКСАЦИИ ПОЗВОНОЧНОГО СЕГМЕНТА КЕРАМИЧЕСКИМИ ИМПЛАНТАТАМИ В ЭКСПЕРИМЕНТЕ // Современные проблемы науки и образования. 2020. № 5. ;URL: https://science-education.ru/ru/article/view?id=30221 (дата обращения: 16.12.2025).
DOI: https://doi.org/10.17513/spno.30221



