Травматизм у детей остается одной из ведущих медико-социальных проблем вследствие высокой распространенности травм и инвалидизации детского населения. Он занимает второе место в структуре общей заболеваемости детей, составляя 6–8% [1].
Микрохирургическая аутотрансплантация кровоснабжаемого комплекса тканей у детей впервые была выполнена в середине 1970-х гг., через несколько лет после осуществления ее у взрослых [2]. В последующем началось активное применение подобных методов лечения при различных врожденных и приобретенных деформациях опорно-двигательного аппарата (ОДА). Основные преимущества микрохирургической аутотрансплантации комплексов тканей перед другими методами реконструкции сегментов и тканей ОДА – это одноэтапность, возможность замещения обширных и глубоких дефектов тканей, снижение риска инфекционно-воспалительных процессов [2].
Значительное количество работ посвящено использованию микрохирургических методов лечения при закрытии дефектов мягких тканей нижних конечностей в ранние сроки после травмы [2-5]. Выбор донорского аутотрансплантата зависит от размера и локализации дефекта, а также от глубины и состава поврежденных мягких тканей. В случаях, когда необходимо восстановление двигательной функции конечности, возможно применение кровоснабжаемого аутотрансплантата с включением в его состав реиннервированной мышцы (например, торакодорзального лоскута с активной, реиннервированной широчайшей мышцы спины). В то же время при наличии дефекта только кожи и подкожно-жировой клетчатки возможно использование как кожно-фасциального, так и кожно-фасциально-мышечного лоскутов [2, 4-6]. Кожно-фасциальные лоскуты могут быть слишком громоздкими при закрытии дефекта в дистальном отделе нижней конечности, в последующем возможно их утолщение, если пациент набирает вес. Достоинством мышечных лоскутов является то, что в последующем происходит атрофия мышцы из-за ее денервации и улучшается контур конечности. Наилучшими вариантами являются торакодорзальный (ТДЛ) и переднелатеральный лоскуты бедра (ПЛЛБ), так как они имеют длинные постоянные сосудистые ножки и могут быть взяты для закрытия больших по площади дефектов мягких тканей [7, 8].
Риск развития осложнений при микрохирургических операциях у пациентов с посттравматическими деформациями, как правило, более высокий. Это происходит из-за вторичных изменений сосудов (таких как периваскулярное воспаление, фиброз), что приводит к возможному развитию тромбоза [5].
Проведенный литературный поиск показал, что свободная пересадка комплексов тканей применяется у пациентов с приобретенными деформациями нижних конечностей. В данной статье представлен опыт клинического использования свободной микрохирургической аутотрансплантации различных комплексов мягких тканей с целью замещения дефектов мягких тканей нижних конечностей в отделении реконструктивной микрохирургии и хирургии кисти ФГБУ «НМИЦ детской травматологии и ортопедии им. Г.И. Турнера» Минздрава России.
Цель исследования: провести ретроспективный анализ лечения пациентов детского возраста, которым выполняли микрохирургическую аутотрансплантацию кровоснабжаемых комплексов тканей для замещения дефектов мягких тканей нижних конечностей.
Материалы и методы исследования. В исследование были включены 53 пациента (21 девочка (39,6%) и 32 мальчика (60,4%)), которым была выполнена свободная пересадка различных комплексов тканей для закрытия дефектов мягких тканей нижних конечностей с 1984 по 2019 гг. в отделении реконструктивной микрохирургии и хирургии кисти ФГБУ «НМИЦ детской травматологии и ортопедии им. Г.И. Турнера» Минздрава России. Критерий исключения – пациенты, которым, помимо закрытия дефекта мягких тканей, также одномоментно выполняли восстановление костной ткани нижних конечностей.
Были проанализированы протоколы оперативных вмешательств и следующие данные: 1) возраст и пол пациента; 2) локализация дефекта мягких тканей нижней конечности; 3) варианты и площадь донорской области; 4) варианты донорских и реципиентных сосудов, длина сосудистой ножки; 5) осложнения. Все осложнения были разделены на интраоперационные и послеоперационные [5]. При оценке послеоперационных осложнений учитывалась классификация Caton [9]. Кроме того, проведен анализ количества последующих оперативных вмешательств.
Полученные результаты подвергали статистической обработке в системе Statistica 7.0 for Windows с помощью методов параметрической и непараметрической статистики.
Результаты исследования и их обсуждение. В период с 1984 по 2019 гг. в отделении реконструктивной микрохирургии и хирургии кисти ФГБУ «НИДОИ им. Г.И. Турнера» было произведено 1304 микрохирургические аутотрансплантации различных комплексов тканей с наложением микрососудистых анастомозов (в свободном варианте), из них в 4,2% случаев для закрытия дефектов мягких тканей нижних конечностей.
У 2 пациентов микрохирургическая аутотрансплантация была проведена на двух конечностях. Средний возраст пациентов составил 10,5±4 года (от 1 года до 17 лет). По мнению многих авторов, посттравматические деформации чаще встречаются у пациентов мужского пола [2]. В нашем исследовании также отмечено преобладание пациентов мужского пола над женским (60,4% и 39,6% соответственно).
При оценке распределения по диагнозам выявлено, что преимущественно были пациенты (72,7% случаев) с посттравматическими деформациями мягких тканей, которые возникали в результате дорожно-транспортных происшествий, ожогов (термических, химических, высоковольтных), огнестрельных ранений. При врожденных заболеваниях (14,5% пациентов) в результате неправильного анатомического развития стопы и голени, перераспределения нагрузки во время ходьбы возникали различные дефекты мягких тканей. Ятрогенные деформации (10,9%) были связаны с некрозом мягких тканей и последующей рубцовой деформацией в результате воздействия лекарственных средств и гипсовых повязок. В группу инфекционно-воспалительных процессов (1,9%) вошли пациенты с последствиями острого гематогенного остеомиелита.
По данным литературы, дорожно-транспортные происшествия и травмы являются наиболее частыми причинами повреждения мягких тканей нижних конечностей [4], что совпадает с нашими наблюдениями.
При оценке уровня повреждения мягких тканей нижней конечности отмечено преобладание пациентов с деформациями на уровне голени (47%) и стопы (29%). При этом отмечено, что в области коленного сустава и голени рубцовая деформация мягких тканей чаще всего была связана с последствиями травм (100% и 84,6% соответственно), а на стопе – с врожденными заболеваниями (62,5% случаев) (рис. 1).
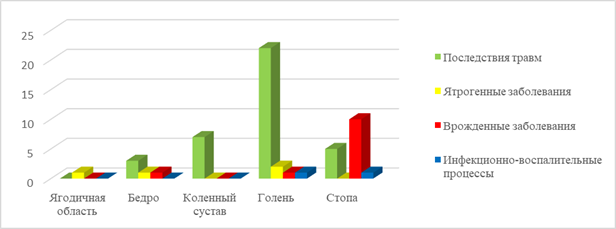
Рис. 1. Диаграмма распределение пациентов по уровню поражения мягких тканей и диагнозам
Наиболее часто рубцовые изменения мягких тканей располагались на передней (36,4% случаев) и задней (21,8% случаев) поверхностях нижней конечности. В 3 случаях рубцовые ткани окутывали голень по всей окружности.
В 74,5% случаев производили аутотрансплантацию ТДЛ, реже – пахового и переднелатерального лоскута бедра. При замещении дефектов в ягодичной области, на бедре и в области коленного сустава использовали только ТДЛ. На голени и стопе наиболее часто также использовали ТДЛ (76,9% и 50% случаев соответственно), а также выполняли свободную пересадку других комплексов тканей (рис. 2).
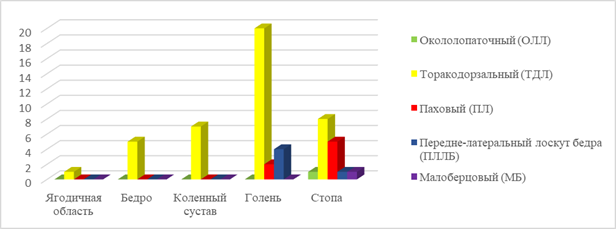
Рис. 2. Диаграмма распределение пациентов по донорской и реципиентной областям
При оценке размеров заимствованного аутотрансплантата выявлены показатели, представленные в таблице.
Оценка размеров донорского лоскута (средние значения), донорской артерии (количество) и длины сосудистой ножки (средние значения)
|
Лоскут |
Длина (см) |
Ширина (см) |
Длина сосудистого пучка (см) |
Донорская артерия |
Количество трансплантатов |
|
ОЛЛ |
10 |
7 |
5 |
Артерия, огибающая лопатку |
1 |
|
ТДЛ |
18,2±6,4 |
11,7±4,4 |
6,5±2,2 |
Торакодорзальная артерия |
41 |
|
ПЛ |
11,9±2,4 |
6,7±1,6 |
6±0,3 |
Наружная артерия, огибающая подвздошную кость |
7 |
|
ПЛЛБ |
12,4±7,2 |
13,2±4,1 |
10,5±0,7 |
Нисходящая ветвь латеральной огибающей бедренную кость артерии |
5 |
|
МБ |
6 |
8 |
10 |
Малоберцовая артерия |
1 |
ОЛЛ – окололопаточный лоскут; ТДЛ – торакодорзальный лоскут; ПЛ – паховый лоскут; ПЛЛБ – переднелатеральный лоскут бедра; МБ – малоберцовый лоскут.
Полученные данные показывают некоторые преимущества ПЛЛБ по сравнению с ТДЛ, учитывая длину сосудистой ножки и меньший объем мягких тканей, поскольку данный лоскут кожно-фасциальный. Однако при замещении глубоких тканевых дефектов использование ТДЛ предпочтительнее, хотя его сосудистая ножка несколько короче, что необходимо учитывать при подготовке реципиентных сосудов.
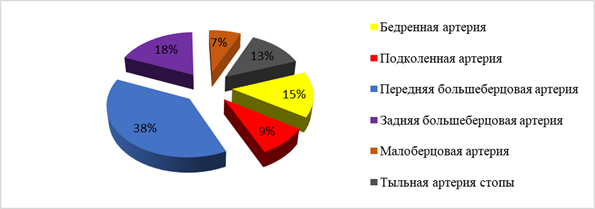
Рис. 3. Диаграмма вариантов подключения донорских артерий трансплантатов в реципиентной области
В реципиентной области наиболее часто использовали переднюю большеберцовую (38% случаев) и заднюю большеберцовую артерии (18% случаев) (рис. 3). В большинстве публикаций отмечено, что в качестве реципиентной артерии чаще используют заднюю большеберцовую артерию, а точнее – ее ветви. Это обосновано тем, что указанный магистральный ствол залегает в глубоких слоях мягких тканей, а спереди прикрыт мощными больше- и малоберцовой костями, соответственно он более защищен при травмах данного сегмента ОДА. Учитывая, что большинство травм голени по статистике приходится на ее переднюю поверхность, то в первую очередь страдают структуры, расположенные в этой области, в том числе передняя большеберцовая артерия [3, 5], при этом задний большеберцовый пучок обычно остается интактным. Если же повреждаются передний и задний большеберцовый пучки, то кровоснабжение сегмента дистальнее области повреждения значительно уменьшается либо прекращается вовсе, и конечность нуждается в реваскуляризации или ампутации [3]. Однако есть исследования, в которых описывается более частое использование переднего большеберцового пучка в реципиентной области [4]. Но в данных случаях посттравматический дефект мягких тканей располагался на стопе и не было повреждения передних отделов голени. В нашем исследовании при расположении дефекта мягких тканей на стопе артерию трансплантата подключали к тыльной артерии стопы (43,75% случаев), задней большеберцовой (37,5%) и передней большеберцовой (18,75%) артериям.
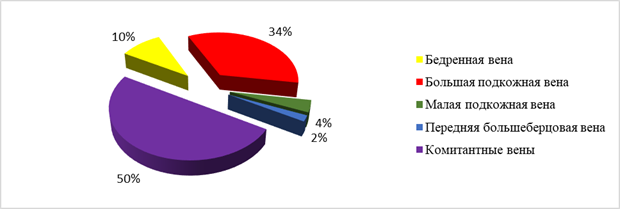
Рис. 4. Диаграмма вариантов подключения вен в реципиентной области
При наложении венозных анастомозов в 50% случаев использовали комитантные вены, сопровождающие реципиентную артерию, а у 34% пациентов – между донорской веной и большой подкожной веной (рис. 4). По данным литературы, комитантные, глубокие вены и значительно реже малая подкожная вена наиболее удобны для использования. Большая подкожная вена очень часто повреждается, подвержена воспалительным изменениям и должна использоваться с осторожностью [3]. В нашем исследовании мы не отметили каких-либо проблем с большой подкожной веной, что позволило с достаточно большой частотой (в 34% случаев) использовать ее для выполнения венозных анастомозов.
В 12,7% случаев (7 пациентов) производили реиннервацию широчайшей мышцы спины в реципиентной области.
В 21,8% случаев столкнулись с интраоперационными осложнениями. В 9 случаях после снятия клипс не произошло восстановления кровообращения в пересаженном трансплантате, что потребовало проведения ревизии, механического прокачивания сосудов и, в некоторых случаях, повторного наложения анастомозов на сосуды. Еще в 3 случаях понадобилось использование венозной вставки в связи с недостаточной длиной донорской сосудистой ножки. И, если в 6 случаях указанные мероприятия увенчались успехом и кровообращение в перемещенных трансплантатах удалось восстановить, то у 3 пациентов они оказались безуспешными – кровоток в трансплантатах так и не был получен. В таких случаях одним из выходов является удаление подкожных мягких тканей лоскута (подкожной жировой клетчатки с фасцией и сосудами) и использование полученного полнослойного кожного лоскута для закрытия раневой поверхности реципиентной области.
Осложнения II степени были связаны с нарушением микроциркуляции в аутотрансплантатах. Частота ревизий сосудистых анастомозов пересаженных лоскутов колеблется от 5,89% до 12%, по данным разных авторов [3, 8]. В нашем исследовании в 16,4% случаев в послеоперационном периоде (первые 3 суток) мы столкнулись с нарушениями кровообращения в пересаженных аутотрансплантатах. В 6 случаях отмечена артериальная недостаточность, в 1 случае – венозная и в 2 – смешанный тип нарушения микроциркуляции. У всех пациентов была произведена ревизия сосудистых анастомозов с наложением реанастомозов, в 4 случаях потребовалась дополнительная венозная вставка. Однако после ревизии сосудистых анастомозов в 6 случаях (осложнения III степени по классификации Caton) в последующем отмечен полный или частичный некроз лоскутов. При иссечении некротических тканей (15–21-е сутки от дня ревизии) в 33,3% случаев рана закрыта собственным тканями с наложением вторичных швов, а в 66,7% случаев выполнена комбинированная кожная пластика.
По данным литературы, выживаемость лоскутов на нижней конечности после микрохирургической аутотрансплантации составляет 86–95% [4, 5, 10]. В нашем исследовании выживаемость лоскутов составила 89,1%.
Одним из негативных исходов микрохирургической аутотрансплантации комплексов тканей является сформированный дефицит тканей в донорской области, что впоследствии может вызвать косметические или функциональные расстройства, особенно у продолжающих расти пациентов. Однако многочисленные публикации показали, что с ростом ребенка практически не отмечаются вторичные деформации мягких тканей в донорской зоне [2, 4, 5]. Только у 1 пациента в нашем исследовании была выполнена кожная пластика в связи с тянущим рубцом в подмышечной области.
По данным литературы, 25% пациентов требуются дополнительные операции с целью устранения вторичных деформаций – иссечение избытка мягких тканей, кожная пластика рубцов [5]. Последующее уменьшение мягких тканей с помощью липосакции приводит к значительному улучшению косметических результатов [4, 5]. В нашем исследовании в 21 случае в последующем были проведены дополнительные операции на нижних конечностях. При этом только у 3 пациентов это было связано с иссечением избытка мягких тканей пересаженного лоскута. У остальных пациентов были проведены различные сухожильно-мышечные пластики на стопе, удлинение костей нижней конечности и удаление металлоконструкций.
Клинический пример. Пациент К., 8 лет, поступила с диагнозом: послеожоговая деформация левой стопы и голени. В пятилетнем возрасте нога девочки попала в ведро со строительной известью. Лечилась самостоятельно дома. С ростом отмечено натяжение сформировавшихся рубцов. Сформировалась ригидная разгибательная контрактура 2–5-го пальцев стопы. С учетом значительной площади планируемого раневого дефекта после иссечения рубцовых тканей было принято решение о пластике тыльной поверхности стопы переднелатеральным лоскутом бедра. В ходе оперативного вмешательства также устранены разгибательные контрактуры пальцев. Через 2 года после лечения результат полностью удовлетворяет пациента. Ограничений функции стопы нет (рис. 5).
|
|
Рис. 5. Результат реконструкции тыльной поверхности стопы: а, б) состояние стопы до оперативного лечения – отмечаются выраженный дефицит мягких тканей и тянущие рубцы; в) образовавшийся раневой дефект после иссечения деформирующих рубцов;
г) отдаленный результат через 2 года после оперативного вмешательства, устранены контрактуры пальцев стопы, устранен дефицит мягких тканей тыла стопы
Заключение
Настоящее исследование показало, что микрохирургическая аутотрансплантация комплексов тканей с целью замещения дефекта мягких тканей нижних конечностей является, как минимум, эффективной альтернативой традиционным методам кожной пластики. Использование микрохирургических методов пересадки кровоснабжаемых комплексов тканей с реваскуляризацией их в реципиентной области позволяет более полноценно восстанавливать утраченные или поврежденные ткани конечности как по площади, так и по глубине. Это требует специальной подготовки хирургов в освоении микрохирургической техники, оснащения операционной оптикой, специальным микрохирургическим инструментарием. Также важна подготовка анестезиологов-реаниматологов для корректного проведения интра- и послеоперационного периода, с целью предотвращения или лечения возможных осложнений, связанных с нарушением микроциркуляции в пересаженном аутотрансплантате. Выполнение всех перечисленных условий в ходе одного хирургического вмешательства позволяет добиваться отличных результатов лечения и максимально уменьшить риск возникновения необратимых негативных последствий.
Библиографическая ссылка
Авдейчик Н.В., Голяна С.И., Гранкин Д.Ю., Сафонов А.В. ЗАМЕЩЕНИЕ ДЕФЕКТОВ МЯГКИХ ТКАНЕЙ НИЖНИХ КОНЕЧНОСТЕЙ У ДЕТЕЙ // Современные проблемы науки и образования. 2020. № 5. ;URL: https://science-education.ru/ru/article/view?id=30182 (дата обращения: 03.01.2026).
DOI: https://doi.org/10.17513/spno.30182




 а
а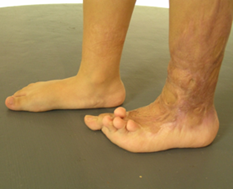 б
б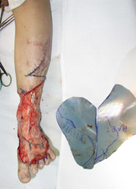 в
в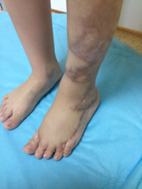 г
г