Многие биомолекулы, тканевые и внутриклеточные структуры обнаруживают свойства аутофлюоресценции. В некоторых случаях спонтанная люминесценция может даже усложнять трактовку результатов, полученных с использованием методов флуоресцентной микроскопии [1].
В литературе содержится множество данных об аутофлюоресценции мышечной ткани [2, 3], а также миоглобина, порфирина и липофусцина при деструкции симпластов поперечнополосатой мышечной ткани (СПМТ) [4, 5]. Хорошо известна аутофлюоресценция макрофагов [6, 7], считается, что эти фагоциты приобретают или усиливают люминесцентные способности при активации [6]. Описано свечение макрофагов за счет фагоцитоза различных флюоресцентных объектов, тех же эритроцитов, обладающих способностью к выраженной самостоятельной аутофлюоресценции [1, 8], или продукта их деструкции – гемосидерина [9].
Цель исследования: на основании случайной регистрации усиления флюоресценции макрофагов за счет фагоцитоза некротизированных СПМТ, данные о чем отсутствуют в литературе, изучить, действительно ли накопление продуктов деградации поперечнополосатой мышечной ткани инициирует или усиливает люминесценцию макрофагов, а также изучить особенности флюоресценции макрофагов в участках лизиса некротизированных мышц при моделировании острой венозной блокады.
Материал и методы исследования
Эксперименты выполнены на крысах-самцах инбредной линии Wag в возрасте 6 месяцев, массой 180–200 г, в разные сроки после наложения лигатуры на бедренную вену с захватом окружающих клетчатки и мышц. В качестве контроля были использованы интактные животные. Все животные были получены из вивария Института цитологии и генетики СО РАН, который соответствует категории SPF. Все манипуляции с животными осуществляли под эфирным наркозом, они не были связаны с риском причинения им боли в соответствии с ГОСТ 33215-2014.
Под общим ингаляционным эфирным наркозом, в условиях чистой операционной, при соблюдении правил асептики и антисептики, после обработки кожи спиртом скальпелем производили разрез кожи длиной до 3 см по внутренней стороне бедра до паховой складки. Тупым способом выделяли сосудистый пучок, проводили медленно абсорбируемую полифиламентную лигатуру из плетеного шовного материала «Викрил 3/0» через мышечный массив бедра под v. femoralis в области паховой связки, как можно ближе к месту впадения к v. circumflexa ilium profunda, и завязывали хирургическим узлом с захватом окружающих тканей. Ушивали кожу и обрабатывали швы спиртом. Крысы с признаками гнойно-воспалительных осложнений в экспериментальные группы не включались. Животных выводили из эксперимента передозировкой эфирного наркоза через 4 суток, 1, 2, 3, 4 и 5 недель. В каждой группе было 10–12 особей, в том числе и в группе интактного контроля (12 животных), всего в эксперименте было задействовано 69 крыс.
Образцы тканей вокруг лигированной вены фиксировали в 10%-ном растворе забуференного нейтрального формалина (рН=7,4) не менее 1 суток, обезвоживали в серии спиртов возрастающей концентрации, просветляли в бензоле и заключали в гистопласт. Гистологические срезы толщиной не более 5 мкм окрашивали гематоксилином и эозином, исследовали при увеличении до 1200 раз в световом микроскопе Axioimager M1 (Carl Zeiss, Germany). Неокрашенные срезы исследовали в режиме люминесценции в этом же микроскопе с применением фильтра Alexa Fluor 488 (диапазон возбуждения 450–490 нм, диапазон регистрации 515-∞ нм). При получении микрофотографий использовали автоматическую экспозицию.
Результаты исследования и их обсуждение
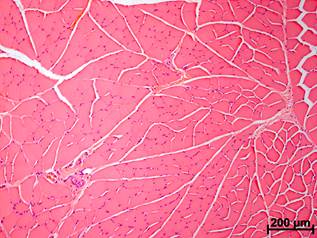
У интактных животных в мышечном массиве бедра значительных патологических изменений не найдено (рис. 1, а). Также отсутствовали светящиеся ярче фона объекты, за исключением эритроцитов в просвете сосудов (рис. 2, а). Эти клетки обладают аутофлюоресценцией [1, 8] и могут светиться сами по себе при воздействии ультрафиолетовым светом.
Через 4 суток после операции в мышечной ткани, оказавшейся в лигатуре, были обнаружены разной величины фрагменты некротизированных мышечных волокон, обширные свежие геморрагии, выраженная воспалительно-клеточная инфильтрация, преимущественно лейкоцитарная с присутствием лимфоцитов и макрофагов. Лейкоцитарные инфильтраты проникали глубоко в мышечную ткань, а среди инфильтрированного лейкоцитами детрита были расположены фрагменты СПМТ, окруженные макрофагами. Необходимо обратить внимание на то, что происходил не просто лизис макрофагами некротизированных СПМТ, вокруг таких фрагментов формировались многочисленные гигантские клетки инородных тел, то есть воспалительный процесс в ответ на повреждение мышечной ткани уже через 4 суток носил гранулематозный характер (рис. 1, б). Изменения бедренной вены при ее тромбозе или острой блокаде были подробно описаны нами ранее [10, 11].
 а
а 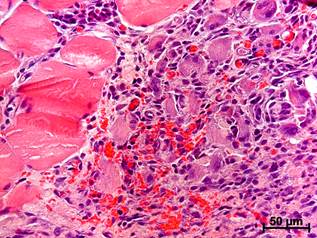 б
б
 в
в 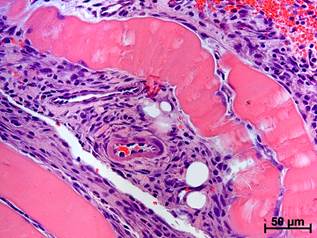 г
г
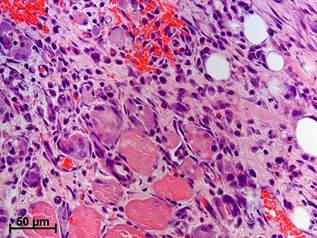
Рис. 1. Мышечная ткань бедра крыс в различные сроки после наложения лигатуры на v. femoralis с захватом окружающих тканей. Окраска гематоксилином и эозином:
а – отсутствие отека, лейкоцитарной инфильтрации и микроциркуляторных расстройств у интактного животного; б – набухание и гомогенизация СПМТ со значительной лейкоцитарной инфильтрацией, геморрагиями и формированием гигантских клеток инородных тел через 4 суток после операции; в – уменьшение числа и объема некротизированных СПМТ с сохранностью многоядерных макрофагов со слившейся цитоплазмой, снижение выраженности лейкоцитарной инфильтрации, появление фибробластов и внеклеточного матрикса через 1 неделю; г – лимфоцитарно-макрофагальная инфильтрация с гигантскими клетками инородных тел вокруг некротизированных СПМТ через 2 недели эксперимента
При исследовании неокрашенных гистологических срезов в режиме люминесценции светового микроскопа вокруг некротизированных СПМТ было обнаружено яркое свечение разнокалиберных включений в крупных клетках, наиболее вероятно, в макрофагах. Вместе с этим часть цитоплазмы таких клеток оставалась темной, различался четкий переход между светящимися и темными участками цитоплазмы, то есть светились именно ограниченные включения в цитоплазме (рис. 2, б). Необходимо отметить, что не у всех животных некротизированная мышечная ткань попала в срез, но там, где это произошло, флюоресценция была усилена во всех случаях.
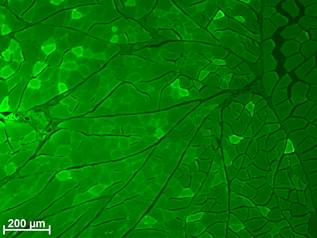 а
а 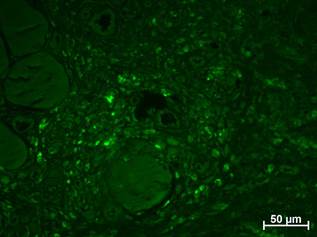 б
б
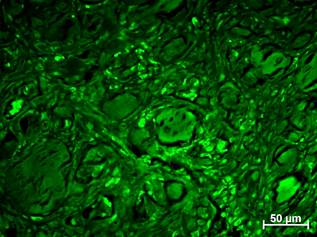 в
в 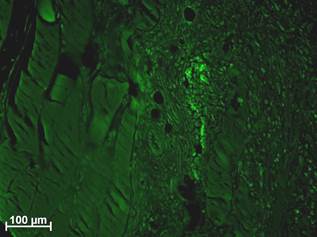 г
г
Рис. 2. Флюоресценция макрофагов рядом с некротизированными и лизируемыми СПМТ. Неокрашенные срезы в люминесцентном режиме микроскопа с фильтром Alexa 488: а – отсутствие клеточных элементов с ярким свечением у крысы из группы интактного контроля; б – интенсивная флюоресценция отдельных очень крупных клеток в лейкоцитарном инфильтрате вокруг некротизированных СПМТ через 4 суток после хирургического вмешательства; в – увеличение количества макрофагов и яркости их люминесценции между лизируемыми СПМТ через 1 неделю; г – выраженное уменьшение числа макрофагов с флюоресценцией ярче фона рядом с нежизнеспособными СПМТ через 2 недели, снижение интенсивности свечения макрофагов
Заключение о том, что такие крупные клетки принадлежат к макрофагальному ряду, было сделано нами на основании регистрации большого числа макрофагов, в том числе их многоядерных форм со слившейся цитоплазмой, среди клеточного детрита и некротизированных СПМТ, по данным световой микроскопии.
При перевязывании вены с окружающими тканями попавшие в лигатуру СПМТ некротизируются вследствие непосредственного сдавления и пережатия кровеносных и лимфатических сосудов. Явления некроза сопровождаются воспалением с соответствующими лейкоцитарной инфильтрацией и расстройствами микроциркуляции (в том числе геморрагиями). Учитывая большой объем каждого отдельного симпласта и коагуляцию их белков при деструкции, можно ожидать слияние макрофагов в многоядерные формы для фагоцитоза и лизиса таких крупных объектов.
Во всех этих случаях возможно свечение макрофагов за счет фагоцитированного материала, в частности за счет эритроцитов из участков геморрагий и гемосидерина, образовавшегося при их деструкции [9]. Вместе с этим в литературе есть данные об аутофлюоресценции поперечнополосатых мышц [2, 3] и продуктов их деструкции – миоглобина [7], порфирина и липофусцина, которые находятся в очаге воспаления после распада мышечной ткани [4].
Спустя 1 неделю отмечалось уменьшение числа некротизированных СПМТ, скорее всего, вследствие их резорбции. Рядом c оставшимися еще не лизированными нежизнеспособными СПМТ по-прежнему располагались гигантские клетки инородных тел и свежие геморрагии, но выраженность лейкоцитарной инфильтрации значительно уменьшалась; в инфильтратах практически исчезали нейтрофилы. Необходимо отметить появление большого числа фибробластов, синтезировавших компоненты внеклеточного матрикса (рис. 1, в).
По мере лизиса и элиминации некротизированных СПМТ уменьшалась активность воспаления; в воспалительно-клеточном инфильтрате нейтрофилы замещались лимфоцитами, появлялись фибробласты, на месте лизируемого детрита начинала формироваться соединительная ткань. Однако в этот срок еще не все нежизнеспособные СПМТ подвергались деструкции, поэтому рядом с ними присутствовали лейкоциты, многоядерные макрофаги со слившейся цитоплазмой; встречались также свежие геморрагии.
На неокрашенных срезах при использовании люминесцентной микроскопии рядом с более темными некротизированными СПМТ были расположены очень ярко светящиеся крупные клетки разных размеров (до 20 мкм) и форм (макрофаги). Количество таких интенсивно флюоресцирующих клеток было больше, чем в предыдущий срок (рис. 2, в). По-видимому, макрофаги фагоцитируют продукты деградации СПМТ, например миоглобин, обладающий способностью к свечению при воздействии ультрафиолетовым светом [4, 5], и за счет этого приобретают способность к яркой люминесценции. Одним из доказательств такой причины интенсивной флюоресценции фагоцитов является то, что светящиеся макрофаги расположены рядом, по периферии участков с некротизированными СПМТ и, скорее всего, резорбируют их.
Через 2 недели активность воспаления снижалась в еще большей степени, а очаги фиброза увеличивались. Вместе с этим единичные СПМТ еще оставались нелизированными, рядом с ними еще присутствовали гигантские клетки инородных тел (рис. 1, г). Скорее всего, после захвата в лигатуру и пережатия части мышц не все СПМТ погибают одновременно, часть волокон подвергается некрозу в более поздние сроки в результате микроциркуляторных нарушений, денервации, сжатия воспалительным инфильтратом (который проникает глубоко в мышцы между СПМТ и по межмышечным пространствам) (рис. 1, б, г) и подобных причин. Эти СПМТ лизируются позже и, пока полностью не разрушатся, служат источником и поддерживающим фактором воспалительной реакции.
При использовании люминесценции было найдено свечение только в относительно небольшом числе крупных клеток рядом с такими нежизнеспособными СПМТ (рис. 2, г). Это также служит свидетельством того, что основной причиной флюоресценции макрофагов в процессе лизиса резорбции ими некротизированных СПМТ является фагоцитоз продуктов распада, способных к люминесценции, в частности миоглобина [4, 5]. По мере уменьшения численности подвергающихся макрофагальной деструкции резорбции СПМТ резко снижается и содержание ярко флюоресцирующих клеточных элементов.
Через 3, 4 и 5 недель эксперимента некротизированные СПМТ уже не выявлялись рядом с лигатурой. Соответственно, резко снижалась интенсивность воспалительного процесса в участках повреждения, в которых активно развивалась соединительная ткань.
При использовании люминесцентного режима микроскопии в соединительной ткани на месте лизированных структур были найдены единичные ярко флюоресцирующие объекты, расположенные как в просвете сосудов (эритроциты), так и вне связи с ними (макрофаги), по всей вероятности, светящиеся за счет аутофлюоресценции [1, 6, 7].
Заключение
Результаты люминесцентно-микроскопического исследования позволяют заключить, что в элиминации некротизированных СПМТ активное участие принимают макрофаги, причем в первые 2 недели этот процесс сопровождается формированием гигантских клеток инородных тел. Включения в цитоплазме макрофагов (фагосомы), формирующиеся при фагоцитозе детрита СПМТ, характеризуются способностью к яркой аутофлюоресценции при воздействии ультрафиолетовым светом через фильтр Alexa Fluor 488, что может быть использовано в качестве дополнительного критерия выявления макрофагов и при оценке их активности.
Работа выполнена при финансовой поддержке ПФНИ ГАН на 2017-2020 гг. (VI.62.2.1, 0309-2016-0006) «Разработка технологий получения материалов для регенеративной медицины и развитие методов восстановления репродуктивного здоровья» и (0535-2019-0028) «Клеточные и молекулярные механизмы повреждения и ремоделирования тканей и органов при метаболических нарушениях и токсических воздействиях, разработка технологий стимуляции цитопротекторных реакций и тканеспецифической репаративной регенерации».
Библиографическая ссылка
Аникеев А.А., Шевела А.А., Лушникова Е.Л., Майбородин И.В. ОСОБЕННОСТИ ФЛЮОРЕСЦЕНЦИИ МАКРОФАГОВ В УЧАСТКАХ ЛИЗИСА НЕКРОТИЗИРОВАННЫХ МЫШЦ ПРИ МОДЕЛИРОВАНИИ ОСТРОЙ ВЕНОЗНОЙ БЛОКАДЫ // Современные проблемы науки и образования. 2020. № 5. ;URL: https://science-education.ru/ru/article/view?id=30173 (дата обращения: 11.03.2026).
DOI: https://doi.org/10.17513/spno.30173



