В последнее время наблюдается увеличение числа сосудистых заболеваний и цереброваскулярных нарушений центральной нервной системы. В лечении данных патологий важная роль принадлежит церебропротекторным, ноотропным и стресс-протекторным препаратам.
В данной работе приведены результаты исследований репродуктивной токсичности и эмбриотоксического действия, а также оценки возможного мутагенного и канцерогенного действия потенциального ЛС для лечения нарушений мозгового кровообращения - «Лизаргам, спрей назальный дозированный» (далее препарат «Лизаргам»).
Исследования показали, что активный фармакологический ингредиент препарата «Лизаргам» (Nα-ацетил-D-лизил-лизил-аргинил-аргинил-амид) обладает нейропротекторным действием [1]. Введение препарата нормализует уровни цитокинов в головном мозге, а также обладает антиапоптотическим действием, поскольку может ограничивать развитие апоптоза в головном мозге после воздействия оксида углерода. Защитное действие исследуемого пептида характеризуется также нейротрофическим компонентом. Таким образом, препарат «Лизаргам» обладает высокой нейропротекторной эффективностью in vivo.
Материалы и методы исследования
В данной работе использовали готовую лекарственную форму (ГЛФ) «Лизаргам, спрей назальный дозированный 0,5% и 1,0%». Подробная характеристика ГЛФ приведена нами ранее [2]. Терапевтическую дозу препарата для человека (20 мкг/кг) высчитывали в соответствии с руководством Т.А. Гуськовой [2; 3].
Животные содержались в виварии согласно санитарно-эпидемиологическим требованиям от 29.08.2014 г., условия соответствовали Европейской конвенции по защите позвоночных животных (Страсбург, 1986 г.). Эксперименты проводились с разрешения биоэтической комиссии института. В качестве контроля во всех экспериментах использовали физиологический раствор (стерильный 0,9% раствор хлорида натрия, ФР).
Оценку репродуктивной токсичности (генеративной функции) проводили на белых беспородных крысах обоего пола (180-200 г, 9-10 недель) [4; 5]. Препарат «Лизаргам» вводили самкам (n=20) ежедневно интраназально (и/н) в дозе 5 мг/кг (максимальная доза, использованная в эксперименте по изучению хронической токсичности) в течение 15 дней (3 эстральных цикла). Самцам препарат вводили (n=10) и/н в дозе 5 мг/кг в течение всего периода сперматогенеза (48 дней). После введения препарата самок помещали с самцами на 2 эстральных цикла (10 дней). Взвешивание крыс проводили до начала эксперимента (фоновые значения), после завершения введения препарата и перед эвтаназией (самки). Забой и морфологическое исследование репродуктивной системы самок проводили на 20-й день после оплодотворения. Состояние внутренних органов и костной системы плодов исследовали по методу Вильсона или по модифицированному методу Даусона [4].
Исследование эмбриотоксического действия препарата проводили в 2 этапа [4; 6; 7]. Спаривание виргинных самок осуществляли с интактными самцами. На первом этапе препарат и/н вводили двум опытным группам самок по 15 особей с 1-го по 19-й день беременности: в 1-й группе - в дозе 1 мг/кг (10-кратная предполагаемая терапевтическая доза для человека с учетом коэффициента пересчета на площадь поверхности тела крыс, равного 6); во 2-й группе - в дозе 5 мг/кг. В контрольной группе самкам (n=15) в эти сроки вводили ФР. Вскрытие самок проводили после эвтаназии на 20-й день беременности, при этом определяли показатели репродуктивной системы самок и состояния плодов.
На втором этапе препарат вводили и/н одной группе самок (n=15) в дозе 5 мг/кг с 1 по 21-й день беременности, в контрольной группе самкам (n=15) в эти же сроки вводили ФР. На 4, 7, 14 и 21-й дни после рождения у 8 крысят из каждого помета проводили оценку физического развития неполовозрелого потомства. На 2-6-й дни изучали скорость созревания сенсорно-двигательных рефлексов крысят, а на 30-й день - эмоционально-двигательное поведение по методу «открытое поле».
При изучении генотоксичности руководствовались рекомендациями действующих методических документов [4; 8]. Мутагенные свойства препарата «Лизаргам» изучали in vitro с использованием чашечного метода учета мутаций в тесте Эймса.
Мутагенность и риск канцерогенного действия препарата «Лизаргам» изучали in vivo в 2 сериях экспериментов на белых беспородных мышах и мышах-гибридах F1(CBA x С57В1) обоего пола. Проводили оценку хромосомных аберраций в клетках красного костного мозга (ККМ). В первой серии экспериментов были сформированы три группы по 5 самцов. В 1-й (опытной) группе «Лизаргам» вводили однократно и/н в дозе 6 мг/кг; во 2-й группе (негативный контроль) - по той же схеме вводили ФР; в 3-й группе (позитивный контроль) в те же сроки однократно, внутрибрюшинно (в/б) вводили циклофосфамид в дозе 20 мг/кг. Во второй серии экспериментов в двух группах (опытная и контрольная) было по 5 самцов и по 5 самок. В опытной группе препарат вводили и/н в дозе 6 мг/кг ежедневно 5 дней. Через 24 часа после введения «Лизаргама» после эвтаназии у мышей получали ККМ для исследований.
Проводили изучение индукции доминантных летальных мутаций в зародышевых клетках мышей (CBA x С57В1). В опытной и контрольной группах было по 15 самцов. В опытной группе «Лизаргам» вводили и/н в дозе 6 мг/кг однократно. К каждому самцу подсаживали по 3 интактных виргинных самки, затем заменяли новыми через 7 дней. На 15-17-й день беременности после эвтаназии самок вскрывали. Уровень постимплантационных потерь (А) подсчитывали по формуле:
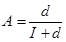 , где d - число погибших эмбрионов, I - число выживших эмбрионов.
, где d - число погибших эмбрионов, I - число выживших эмбрионов.
Статистическую обработку проводили в программе Microsoft Excel-2007. Полученные данные представляли в виде средних значении и ошибок среднего (M±m). Различия между группами оценивали с помощью Т-критерия Стьюдента, а также теста Манна-Уитни.
Результаты исследования и их обсуждение
1. Оценка репродуктивной токсичности
1.1. Генеративная функция
После введения препарата ни в одной из групп не наблюдалось гибели крыс. Не происходило снижение прироста массы тела, а также не было выявлено изменений в поведении животных. При изучении репродуктивной системы у самок не было обнаружено никаких патологических изменений. В каждой из групп было по 18 беременных самок, при этом индекс фертильности составил 90% и в опытной, и в контрольной группе. Результаты оценки параметров репродуктивной системы самок приведены на рисунке 1.
Количество резорбций не отличалось в контрольной и опытной группах (всего 4 и 5; 0,22±0,13% и 0,28±0,19% соответственно). Предимплантационная гибель составила в контрольной - 1,02±0,70, в опытной группе - 1,12±0,79, а постимплантационная - 2,36±1,40 и 2,40±1,67 соответственно. Таким образом, показатели предимплантационной и постимплантационной потерь также были близкими в обеих группах. При исследовании состояния плодов в обеих группах не было выявлено значительных различий. Так, средний вес составил в контрольной группе 3,15±0,04 г, а в опытной группе - 3,12±0,03 г, краниокаудальный размер плодов был в среднем 34,09±0,12 и 34,12±0,13 мм соответственно. При внешнем обследовании 164 плодов в контрольной и 162 в опытной группе не было выявлено никаких аномалий развития. При изучении развития внутренних органов у 82 плодов в контрольной и 81 в опытной группе, а также состояния костного скелета также не обнаружено патологий развития. Число центров оссификации метакарпальных (справа 3,66±0,07; слева 3,59±0,05) или метатарзальных (справа 3,63±0,09; слева 3,57±0,05) в контрольной группе значительно не различалось от таковых в опытной группе (метакарпальных - справа 3,64±0,06; слева 3,60±0,05 или метатарзальных - справа 3,67±0,05; слева 3,54±0,06).
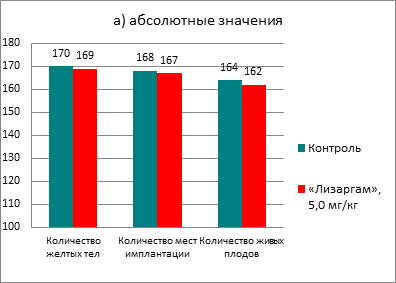
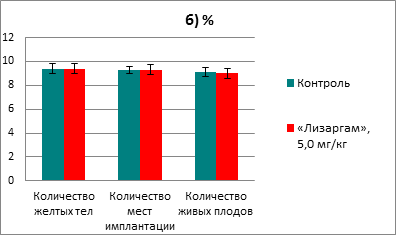
Рис. 1. Влияние препарата «Лизаргам» на параметры репродуктивной системы самок крыс
1.2. Изучение возможного эмбриотоксического действия
На первом этапе проводили оценку возможного действия препарата в пренатальный период развития. При и/н введении препарата самкам в дозах 1 и 5 мг/кг в течение 19 дней в репродуктивной системе самок не было обнаружено патологических изменений. Также не было выявлено нарушений в состоянии плодов.
На втором этапе изучали возможное постнатальное действие препарата. Результаты показали, что после введения препарата крысам не было обнаружено патологических изменений в развитии их потомства. Оценка количественных показателей, параметров физического развития, сроков формирования сенсорно-двигательных рефлексов и эмоционально-двигательного поведения неполовозрелого потомства самок крыс, получавших «Лизаргам», не выявила различий между контрольными и опытными группами (таблицы 1-3, рисунки 2, 3).
Таблица 1
Количественные показатели потомства, рожденного от самок крыс, получавших препарат «Лизаргам»
|
Показатели |
Группы животных M±m |
|
|
Контроль |
«Лизаргам», 5 мг/кг |
|
|
Количество пометов, всего |
15 |
15 |
|
Количество крысят, всего/в среднем в помете |
145/ 9,7±0,3 |
144/ 9,6±0,3 |
|
В т.ч. живых, всего/в среднем в помете |
140/ 9,3±0,2 |
140/ 9,3±0,4 |
|
Погибло в период вскармливания, всего/в среднем в помете |
5/ 0,33±0,13 |
4/ 0,27±0,15 |
|
Самцов, всего |
74 |
68 |
|
Самок, всего |
66 |
72 |
Таблица 2
Показатели скорости созревания сенсорно-двигательных рефлексов неполовозрелого потомства самок крыс, получавших препарат «Лизаргам» (сутки)
|
Показатели |
Группы животных M±m |
|
|
Контроль |
«Лизаргам», 5 мг/кг |
|
|
Переворачивание на плоскости |
7,11±0,07 |
7,14±0,06 |
|
Отрицательный геотаксис |
6,31±0,07 |
6,32±0,07 |
|
Избегание обрыва |
8,21±0,09 |
8,20±0,07 |
Таблица 3
Показатели исследования эмоционально-двигательного поведения неполовозрелого потомства самок крыс, получавших препарат «Лизаргам»
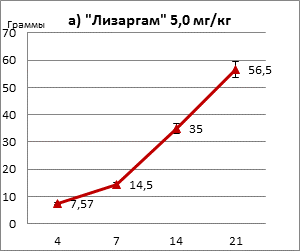
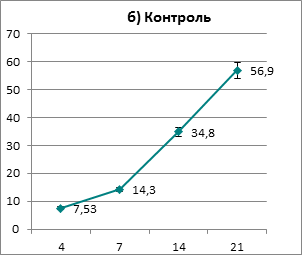
Рис. 2. Динамика прироста массы тела неполовозрелого потомства самок крыс, получавших препарат «Лизаргам» (граммы)
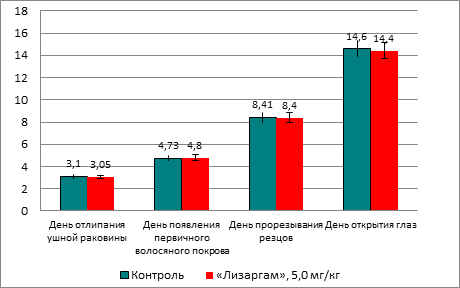
Рис. 3. Показатели физического развития неполовозрелого потомства самок крыс, получавших препарат «Лизаргам» (сутки)
2. Изучение возможной мутагенной активности препарата
2.1. Оценка мутагенной активности в тесте Эймса
В рамках данного исследования оценивали возможную мутагенную активность препарата по способности индуцировать генные мутации у бактерий Salmonella typhimurium линий ТА98, ТА 1537 и ТА100. В качестве положительного контроля были использованы 2-амино- антрацен 10, 4NQO и 9-амино-акридин 10, при добавлении данных веществ число ревертантов достоверно увеличивалось. В то же самое время при внесении препарата «Лизаргам» в концентрациях 0,1-1000 мкг/чашку не наблюдали значительного увеличения количества ревертантов (таблица 4).
Таблица 4
Оценка мутагенной активности препарата «Лизаргам» в тесте Эймса
|
Дозы препаратов, мкг/чашку |
Среднее геометрическое число ревертантов на чашку |
|||||
|
ТА 98 |
ТА 1537 |
ТА 100 |
||||
|
НАМС |
ПАМС |
НАМС |
ПАМС |
НАМС |
ПАМС |
|
|
«Лизаргам» |
||||||
|
0.1 |
24.7 |
25.7 |
8.3 |
13.5 |
72.0 |
54.9 |
|
1.0 |
18.7 |
30.4 |
10.2 |
7.1 |
73.8 |
48.0 |
|
10.0 |
28.1 |
22.6 |
8.7 |
10.3 |
66.2 |
81.8 |
|
100.0 |
21.7 |
23.1 |
7.3 |
8.1 |
74.0 |
67.2 |
|
1000.0 |
22.9 |
22.9 |
8.9 |
8.6 |
71.9 |
62.1 |
|
Контроль |
36.0 |
37.1 |
7.9 |
7.3 |
71.9 |
90.5 |
|
2-амино- антрацен 10 |
69.3 |
27.1 |
353.5 |
|||
|
4NQO |
1178.0 |
3952 |
||||
|
9-амино-акридин 10 |
7605 |
|||||
2.2. Оценка по критерию хромосомных аберраций в клетках красного костного мозга
Возможную мутагенную активность in vivo оценивали по уровню хромосомных аберраций в клетках ККМ мышей (таблица 5). Как следует из данных таблицы 5, во всех группах встречаются 2 типа аберраций (одиночные и парные фрагменты), а в группе животных, получавших циклофосфан, обнаружены также транслокации. Введение циклофосфана приводило к значительному увеличению числа хромосомных аберраций. Частота аберраций в группах мышей, получавших «Лизаргам», была сопоставима с таковой в группе негативного контроля и соответствует среднестатистическому спонтанному уровню аберраций (1%), что является нормальным для мышей. Пятикратное введение препарата не вызывало значимого увеличение количества хромосомных аберраций в клетках ККМ мышей.
Таблица 5
Изучение влияния препарата «Лизаргам» на уровень хромосомных аберраций в клетках красного костного мозга
|
Дозы препаратов |
Кол-во клеток |
Кол-во клеток с аберрациями |
Кол-во абер- раций |
Типы аберраций |
% аберрантных клеток |
|||
|
один. фрагм. |
парн. фрагм. |
дицен- трические хромо-сомы |
транс-лока- ции |
|||||
|
Контроль 1-кратно, самцы |
500 |
5 |
5 |
- |
5 |
- |
- |
1,0 |
|
Циклофосфан, самцы |
500 |
203 |
208 |
200 |
6 |
- |
2 |
40,6 |
|
«Лизаргам», 6 мг/кг, 1-кратно, самцы |
500 |
7 |
8 |
5 |
3 |
- |
- |
1,4 |
|
«Лизаргам», 6 мг/кг, 5-кратно, самцы |
500 |
6 |
7 |
3 |
4 |
- |
- |
1,2 |
|
«Лизаргам», 6 мг/кг, 5-кратно, самки |
500 |
6 |
6 |
5 |
1 |
- |
- |
1,2 |
|
Контроль, 5-кратно, самцы |
500 |
3 |
4 |
- |
4 |
- |
- |
0,6 |
|
Контроль, 5-кратно, самки |
500 |
5 |
5 |
3 |
2 |
- |
- |
1,0 |
2.3. Оценка уровня доминантных летальных мутаций
Уровни доминантных летальных мутаций в зародышевых клетках мыши оценивали по количеству постимплантационных потерь у самок. Полученные результаты свидетельствуют о том, что ни в одном случае уровень постимплантационных потерь не был статистически достоверно повышен ни в один из сроков наблюдения (таблица 6). Таким образом, введение препарата в исследуемой дозе не индуцировало доминантные летальные мутации ни на одной из стадий сперматогенеза.
Таблица 6
Влияние препарата «Лизаргам» на уровень доминантных летальных мутаций в зародышевых клетках мышей
|
Стадия сперматогенеза |
Группы |
Кол-во беременных самок |
Фертиль- ность, % |
Постимпланта-ционные потери |
χ2 |
|
Зрелые спермии |
Контроль |
26 |
87 |
0.04 |
|
|
«Лизаргам», 6 мг/кг |
27 |
90 |
0.05 |
||
|
Поздние сперматиды |
Контроль |
27 |
90 |
0.05 |
0.42 |
|
«Лизаргам», 6 мг/кг |
28 |
93 |
0.06 |
||
|
Ранние сперматиды |
Контроль |
26 |
87 |
0.04 |
|
|
«Лизаргам», 6 мг/кг |
27 |
90 |
0.06 |
Заключение
Таким образом, результаты показали, что введение потенциального ЛС «Лизаргам» самцам и самкам крыс в течение гаметогенеза в дозе, в 250 раз превосходящей терапевтическую дозу для человека (5 мг/кг), не нарушало генеративную функцию самцов и самок. Также не выявлено негативного влияния на эмбриональное развитие потомства крыс, которым вводился «Лизаргам». Показано отсутствие достоверного воздействия препарата на пренатальное и постнатальное развитие потомства при введении его беременным самкам в высоких дозах (до 5 мг/кг). Результаты тестов подтвердили, что «Лизаргам» не проявлял мутагенной активности. Препарат в концентрациях 0,1-1000 мкг/чашку не вызывал увеличения генных мутации у бактерий Salmonella typhimurium линий ТА98, ТА 1537 и ТА100. Не было выявлено увеличения уровня хромосомных аберраций в клетках красного костного мозга у мышей после однократного или пятикратного введения препарата в дозе 6 мг/кг. Применение «Лизаргама» в исследуемой дозе (6 мг/кг) на разных стадиях сперматогенеза не индуцировало доминантные летальные мутации в зародышевых клетках мыши. Кроме того, поскольку у препарата отсутствуют эмбриотоксические и тератогенные свойства, можно заключить, что потенциальное ЛС «Лизаргам» является безопасным в плане возможного канцерогенного действия.
Конфликт интересов: конфликт интересов отсутствует.
Работа выполнена в ФГУП «Гос.НИИ ОЧБ» ФМБА России по Государственному контракту №14.N08.11.0096 от 25 августа 2016 г.
Библиографическая ссылка
Колобов А.А., Смирнова М.П., Кампе-Немм Е.А., Шпень В.М., Вирцев А.А., Варюшина Е.А., Александров Г.В., Захаров М.С., Кирьянова А.С., Хуттунен О.Э., Румянцева А.Б., Митрофанов И.Д., Бендт И.В., Крылова А.Э., Чистякова А.Б. ДОКЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ РЕПРОДУКТИВНОЙ ТОКСИЧНОСТИ, МУТАГЕННОСТИ И КАНЦЕРОГЕННОСТИ ПОТЕНЦИАЛЬНОГО ЛЕКАРСТВЕННОГО СРЕДСТВА НА ОСНОВЕ ПЕПТИДЭРГИЧЕСКОГО НЕЙРО- И СТРЕСС-ПРОТЕКТОРА // Современные проблемы науки и образования. 2020. № 5. ;URL: https://science-education.ru/ru/article/view?id=30172 (дата обращения: 11.03.2026).
DOI: https://doi.org/10.17513/spno.30172



