Остеопения и остеопороз представляют собой сложные метаболические заболевания скелета. Они приводят к снижению плотности костной ткани и нарушениям строения костей скелета на различных уровнях организации, что в свою очередь способствует снижению прочности костей и возникновению патологических переломов [1]. Проблема остеопоротических переломов является чрезвычайно масштабной и важной. Например, в Российской Федерации в группе риска остеопоротических переломов находятся 24% (34 млн) жителей. По прогнозам к 2050 г. эта цифра может увеличиться на 35% [2, 3].
Развитие остеопении и остеопороза обусловлено различными факторами, прямо или опосредованно влияющими на кости скелета [4]. К таковым факторам можно отнести: препубертатный скачок роста, старение, гиподинамию, применение различных лекарственных средств, в частности противоэпилептических средств и глюкокортикоидных гормонов. Остеопения и остеопороз также могут развиваться при заболеваниях пищеварительной, мочеполовой, эндокринной и иммунной систем. К факторам, вызывающим системное снижение плотности костной ткани, относятся также переломы, при которых возникает ряд адаптивных реакций на уровне целостного организма [5]. Сердечно-сосудистые реакции наблюдаются непосредственно после травматического повреждения, неспецифические иммуновоспалительные реакции развиваются через несколько часов или дней после повреждения, после чего наступает черед метаболических изменений, направленных на заживление перелома.
Изменения обменных процессов костной ткани при переломах приводят к значительному высвобождению солей кальция и фосфора из неповрежденных костей скелета, что необходимо для обеспечения процессов репаративной регенерации кости, а следовательно, и заживления перелома [6]. Многочисленные исследования доказывают, что при любом переломе потеря костной массы может составлять 2–15% по сравнению с аналогичными показателями у лиц того же возраста, не имеющих переломов костей [7]. Следовательно, возникает высокий риск развития вторичных переломов в месте возникновения первичной костной мозоли. Заживление вторичных переломов значительно осложняется ввиду недостаточного количества солей кальция, фосфора, необходимых для заживления вторичного перелома, что приводит к необходимости оперативного вмешательства для лечения такого перелома [8]. Все вышеперечисленное говорит о необходимости коррекции фосфорно-кальциевого обмена при лечении переломов костей, особенно в случае развития остеопороза.
Лекарственные средства, содержащие витамин D3 и различные соли кальция, с целью профилактики и лечения остеопении и остеопороза в ортопедии и травматологии применяются достаточно широко, основное внимание при этом направлено на оценку риска развития переломов [9, 10]. Лишь в единичных исследованиях на лабораторных животных показано положительное воздействие применения кальцийсодержащих средств на состояние зубочелюстной системы после повреждения большеберцовых костей. При аналогичных условиях эксперимента доказано корригирующее влияние кальцийсодержащих препаратов на состояние прочности плечевых костей [11, 12]. Однако всестороннего исследования морфогенеза системы скелета после имплантирования гидроксилапатитных материалов в поврежденную кость при введении кальцийсодержащих препаратов не производилось.
Цель исследования – изучить влияние имплантации в большеберцовую кость гидроксилапатита и перорального введения препаратов кальция на прочностные характеристики плечевых костей крыс.
Материал и методы исследования. Эксперимент поставлен на 210 самцах лабораторных крыс, имеющих исходную массу тела от 135 до 145 г, с использованием 5 групп: А-группа – контроль, в Б-группе крысам перфорировали обе большеберцовые кости в проксимальном метадиафизарном отделе (размер наносимого дефекта составлял 2,0 мм, что в отношении к ширине метадиафизарного отдела большеберцовой кости равнялось 1:2,5, а к длине всей кости – 1:19), пластику дефекта гидроксилапатитом биологического происхождения «Остеоапатит керамический» в виде блоков диаметром 2,0 мм (материал ОК-015) проводили в В-группе (производитель – ООО «ТЕРЕН», Украина, г. Киев, патент Украины № 43042, приоритет от 27.07.2009 г.). В Г-группе животные после перфорации большеберцовых костей получали «Биомин МК» (разработчик – ООО НПП «КЕРГАП», Украина, г. Киев, патент Украины № 47362 от 17.06.2002 г.) из расчета 90 мг/кг/сутки; в Д-группе животным после пластики дефекта также вводили корректор. Одна капсула «Биомина МК» содержала 200 мг кальция и 92 мг фосфора, что соответствует 500 мг гидроксилапатита, 10 мкг (400 МЕ) холекальциферола, а также 10 мг аскорбиновой кислоты.
Содержание и манипуляции с лабораторными животными осуществляли, руководствуясь правилами, принятыми European convention for the protection of vertebrate animals used for experimental and other scientific purpose (Strasbourg, 1986 г.). Под эфирным наркозом проводили эвтаназию спустя 7, 15, 30, 60, 90 и 180 суток после операции. Плечевые кости тестировали на универсальной нагрузочной машине Р-0,5 при изгибе со скоростью нагрузки 0,25 мм/мин до обратимого разрушения. По деформационной кривой производили расчет значений разрушающего момента, предела прочности, модуля упругости и минимальной работы разрушения кости [13].
Все полученные цифровые данные оценивались с использованием статистического раздела Microsoft Office Excel и программы Biostat. Рассчитывали среднюю арифметическую (М), среднюю ошибку средней арифметической (m) и t-критерий Стьюдента. Статистически значимой принималась вероятность различия р>95,0% (р£0,05).
Результаты исследования и их обсуждение. Перфорация большеберцовой кости (Б-группа) сопровождалась нарушением прочности плечевых костей: величина минимальной работы разрушения от 7 до 180 суток после перфорации отставала от значений А-группы на 5,38%, 9,65%, 12,72%, 9,78%, 9,23% и 6,70%, величина разрушающего момента от 7 до 90 суток – на 8,54%, 4,95%, 17,11%, 12,40% и 8,09%, а величина предела прочности через 30 суток – на 19,18% (все цифровые отличия, приведенные в тексте, являются статистически значимыми, р£0,05). Значение модуля упругости, напротив, превышало данные А-группы через 7, 15, 60 и 90 суток на 9,59%, 14,30%, 18,57% и 13,65% соответственно.
Из этого следует, что перфорация большеберцовых костей сопровождалась нарушением прочности плечевых костей в ходе всего эксперимента. Максимальные проявления регистрировались через 30 суток после перфорации. Это происходит потому, что при переломе одной из костей ионы кальция накапливаются в области формирования регенерата, и развивается гипокальциемия [14]. Инактивация кальциевых рецепторов в паращитовидных железах в результате падения уровня кальция в крови стимулирует высвобождение паратиреоидного гормона. В результате в почках усиливаются реабсорбция кальция, экскреция фосфатов и синтез 1,25-дигидроксивитамина D3 [8]. Паратиреоидный гормон и 1,25-дигидроксивитамин D3, связывая собственные рецепторы на остеобластах, увеличивают экспрессию RANKL (лиганд рецептора активатора NF-κB (ядерного фактора-κB)), что стимулирует остеокластическую резорбцию на системном уровне и, как следствие, выделение ионов фосфатов и кальция [6].
Концентрация кальция в крови возрастает, и это приводит к секреции кальцитонина в щитовидной железе, что понижает реабсорбцию кальция в кишечнике и почках, при этом угнетается активность остеокластов, уровень кальция в крови поддерживается в пределах физиологического диапазона [9].
После имплантирования в дефект большеберцовых костей материала ОК-015 (В-группа) минимальная работа разрушения через 7 и 30 суток отставала от результатов тестирования в Б-группе на 8,35% и 5,54%. Величина разрушающего момента через 7 и 60 суток отставала от Б-группы на 12,03% и 6,46%, а через 90 и 180 суток уже превышала эти значения на 8,57% и 5,97%. Аналогично величина предела прочности через 7 суток после имплантации была меньше, чем в Б-группе, на 9,00%, а через 30 и 180 суток превышала эти значения на 5,75% и 6,57% (табл.).
Прочность плечевых костей белых крыс при изгибающей деформации после имплантирования в большеберцовые кости ОК-015 и применения препарата «Биомин МК» (M±m)
|
Группа |
Сроки в сутках |
Разрушающий момент, НмМ |
Предел прочности, гПа |
Модуль упругости, гПа |
Работа разрушения, мДж |
|
А |
7 |
78,25±1,19 |
116,41±1,71 |
4,47±0,06 |
48,41±0,80 |
|
15 |
80,92±1,13 |
118,97±1,53 |
4,75±0,07 |
49,51±0,82 |
|
|
30 |
85,58±1,18 |
123,48±1,90 |
4,92±0,07 |
53,08±0,79 |
|
|
60 |
94,23±1,40 |
134,17±2,13 |
5,18±0,09 |
59,62±0,88 |
|
|
90 |
99,72±1,66 |
141,53±2,54 |
5,33±0,07 |
65,65±1,08 |
|
|
180 |
105,30±1,39 |
146,87±2,17 |
5,51±0,09 |
78,93±0,92 |
|
|
Б |
7 |
77,97±1,07 |
112,40±1,66 |
4,90±0,08* |
45,81±0,60* |
|
15 |
74,01±1,03* |
122,36±1,75 |
5,43±0,10* |
44,73±0,68* |
|
|
30 |
81,34±1,09* |
99,80±1,47* |
4,89±0,06 |
46,33±0,61* |
|
|
60 |
78,11±1,14* |
138,13±1,68 |
6,14±0,09* |
53,79±1,06* |
|
|
90 |
87,16±1,25* |
142,83±2,07 |
6,06±0,08 |
59,59±0,87 |
|
|
180 |
96,78±1,12* |
141,27±1,93 |
5,28±0,08 |
73.64±1,00* |
|
|
В |
7 |
65,46±1,11*^ |
102,29±1,35*^ |
4,27±0,07^ |
41,98±0,63*^ |
|
15 |
75,89±1,10* |
122,98±1,67 |
5,60±0,07* |
43,49±0,67* |
|
|
30 |
82,69±1,10 |
105,53±1,67*^ |
5,37±0,08*^ |
43,76±0,60*^ |
|
|
60 |
73,06±1,12*^ |
141,19±1,65* |
5,78±0,07*^ |
52,77±0,77* |
|
|
90 |
94,63±1,50*^ |
183,13±1,92 |
5,83±0,07* |
61,58±0,75* |
|
|
180 |
102,55±1,57^ |
150,54±1,81^ |
5,35±0,08 |
76,03±0,98 |
|
|
Г |
7 |
79,35±1,25 |
117,75±1,73^ |
4,19±0,05*^ |
47,62±0,70^ |
|
15 |
80,64±1,14^ |
119,57±1,86 |
4,68±0,07^ |
47,89±0,67^ |
|
|
30 |
84,55±1,31 |
109,63±1,60*^ |
5,03±0,07 |
50,38±0,70*^ |
|
|
60 |
82,83±0,99*^ |
126,31±1,78*# |
5,45±0,08^ |
56,92±0,70*^ |
|
|
90 |
91,84±1,16*^ |
142,12±1,53 |
5,63±0,08*^ |
63,93±0,93^ |
|
|
180 |
102,75±1,45^ |
145,95±2,06 |
5,43±0,07 |
77,58±1,23^ |
|
|
Д |
7 |
70,45±1,02*# |
93,89±1,40*# |
3,86±0,06*# |
42,79±0,63* |
|
15 |
79,77±1,19# |
116,56±1,76# |
5,07±0,07*# |
45,57±0,63*# |
|
|
30 |
89,71±1,15*# |
113,34±1,74*# |
4,88±0,07# |
51,77±0,67# |
|
|
60 |
78,33±0,10*# |
142,90±1,99* |
5,30±0,07# |
54,81±0,84* |
|
|
90 |
101,59±1,68# |
143,42±1,94 |
5,44±0,07# |
66,0,9±0,84# |
|
|
180 |
196,28±1,74 |
146,35±1,96 |
5,53±0,09 |
79,42±1,16# |
Примечание: * – означает достоверное отличие (р<0,05) от А-группы; ^ – означает достоверное отличие (р<0,05) от Б-группы; # – означает достоверное отличие (р<0,05) от В-группы.
Несколько иначе изменялись показатели, характеризующие состояние органического компонента плечевой кости. Модуль упругости к 7-м суткам эксперимента отставал от показателей Б-группы на 12,89%, к 30-м суткам увеличивался на 9,94%, а к 60-м суткам вновь понижался на 5,79%.
Следовательно, нарушение прочности плечевых костей также наблюдается и при имплантировании в дефект большеберцовых костей гидроксилапатитного материала ОК-015. Амплитуда отклонений от 7-х до 15-х суток превосходит показатели Б-группы, после 30-х суток от момента оперативного вмешательства процессы адаптации проходят интенсивнее.
Следует полагать, что при имплантировании в большеберцовую кость гидроксилапатита возникает необходимость в его биологической резорбции, и уровень резорбтивных процессов в ранние сроки после костной пластики нарастает [15]. Однако при биорезорбции костно-пластического материала выделяются ионы кальция и фосфатов, поэтому их уровень в крови восстанавливается раньше, и восстановление структуры диафиза плечевых костей также происходит быстрее.
Интрагастральное зондовое введение препарата «Биомин МК» после перфорации (Г-группа) сопровождалось более быстрым восстановлением прочности плечевых костей: величина минимальной работы разрушения превышала значения Б-группы с 15-х по 180-е сутки на 7,07%, 8,74%, 5,81%, 7,29% и 5,34% (рис. 1), а величина разрушающего момента через 15, 60, 90 и 180 суток – на 8,96%, 6,04%, 5,37% и 6,17% соответственно.
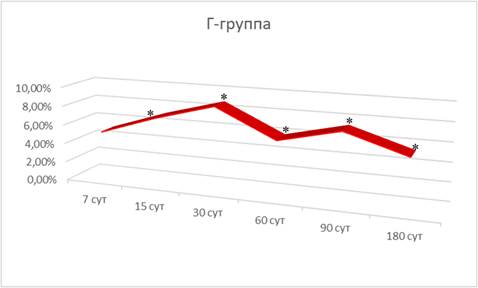
Рис. 1. Динамика изменений значений минимальной работы разрушения плечевых костей у белых крыс после интрагастрального зондового введения препарата «Биомин МК» и перфорации большеберцовой кости (Г-группа) (в % по отношению к параметрам Б-группы); * – достоверные отличия от аналогичного параметра Б-группы при р<0,05
Также и значение предела прочности через 7 и 30 суток превышало значения Б-группы на 4,76% и 9,86%. На этом фоне величина модуля упругости через 7, 15, 60 и 90 суток после перфорирования отставала от значений Б-группы на 14,49%, 13,93%, 11,26% и 7,01% соответственно.
Исходя из этого введение препарата «Биомин МК» интрагастрально после перфорирования большеберцовых костей сопровождается увеличением прочности и пластичности плечевой кости в сравнении с результатами в Б-группе.
После пластики большеберцовых костей материалом ОК-015 и применения препарата «Биомин МК» величина разрушающего момента с 7-е по 90-е сутки превышала значения этого показателя в В-группе на 7,62%, 5,12%, 8,49%, 7,21% и 7,36% (рис. 2), а величина минимальной работы разрушения через 15, 30, 90 и 180 суток – на 4,76%, 18,29%, 7,33% и 4,45% соответственно. Также значение модуля упругости с 7-е по 90-е сутки эксперимента отставало от значений В-группы на 9,64%, 9,47%, 9,10%, 8,35% и 6,62%. Наконец, значение предела прочности через 7 и 15 суток отставало от показателей В-группы на 8,21% и 5,22%, а к 30-м суткам уже возрастало на 7,40%. Это свидетельствует о том, что с 30-х суток после имплантирования прочность и пластичность плечевой кости являются более оптимальными, нежели в В-группе.
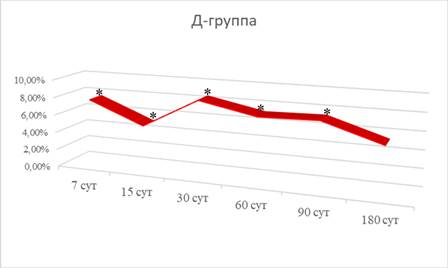
Рис. 2. Динамика изменений значений разрушающего момента плечевых костей у белых крыс после интрагастрального зондового введения препарата «Биомин МК» и пластики большеберцовых костей материалом ОК-015 (Д-группа) (в % по отношению к параметрам В-группы); * – достоверные отличия от аналогичного параметра В-группы при р<0,05
В данном случае интрагастральное введение препарата «Биомин МК», как после перфорации большеберцовых костей, так и после оперативного вмешательства (при всасывании его в кишечнике) также сопровождается восстановлением уровня ионов кальция и фосфатов в крови, что приводит к активизации восстановительных процессов в скелете как при перфорации, так и при имплантировании в костный дефект гидроксилапатита.
Заключение. Сквозная перфорация большеберцовых костей между проксимальным метафизом и диафизом у половозрелых белых крыс сочеталась со снижением прочности плечевых костей в ходе всего эксперимента; максимальные проявления регистрировались через 30 суток после перфорации. Имплантирование в дефект большеберцовой кости костно-пластического гидроксилапатита ОК-015 также сопровождается явлениями снижения прочности плечевых костей; амплитуда отклонений от 7 до 15 суток превосходит показатели Б-группы, а после 30 суток с момента имплантирования компенсаторные процессы ускоряются. Интрагастральное применение препарата «Биомин МК», как при перфорации большеберцовых костей, так и при костной пластике дефекта материалом ОК-015, сопровождается восстановлением прочности плечевых костей.
Авторы заявляют об отсутствии конфликтов интересов, связанных со статьей.
Библиографическая ссылка
Кочьян А.Л., Лузин В.И., Морозов В.Н., Морозова Е.Н. ВЛИЯНИЕ ИМПЛАНТАЦИИ В БОЛЬШЕБЕРЦОВУЮ КОСТЬ ГИДРОКСИЛАПАТИТА И ПЕРОРАЛЬНОГО ВВЕДЕНИЯ ПРЕПАРАТОВ КАЛЬЦИЯ НА ПРОЧНОСТНЫЕ ХАРАКТЕРИСТИКИ ПЛЕЧЕВЫХ КОСТЕЙ // Современные проблемы науки и образования. 2020. № 5. ;URL: https://science-education.ru/ru/article/view?id=30123 (дата обращения: 11.03.2026).
DOI: https://doi.org/10.17513/spno.30123



