Птеригиум является распространенным офтальмологическим заболеванием, связанным с пролиферацией фиброваскулярной ткани со стороны конъюнктивы через лимбальную зону на роговицу. Птеригиум на первых стадиях развития заболевания, как правило, является причиной возникновения жалоб у пациентов субъективного характера – на «косметический дефект». Птеригиум III–V степени (при классификации по степени нарастания фиброваскулярной ткани на роговицу), влияя на одну из основных функций органа зрения – центральное зрение, не только обусловливает снижение остроты зрения (ОЗ), но и ухудшает качество зрения [1].
Основной проблемой при хирургии птеригиума, с которой в отдаленном исходе сталкиваются хирурги и пациенты более чем в 50% случаев, является большая вероятность неоднократного рецидивирования [2–4]. В современной офтальмохирургии методом выбора хирургического лечения птеригиума считается его резекция с последующей аутоконъюнктивопластикой, амниопластикой, а при III–V степени – с выполнением послойной периферической кератопластики. При высоком риске возможного рецидива птеригиума с профилактической целью авторами рекомендуется сочетать хирургические методы с проведением адъювантной, антирецидивной терапии, включающей применение цитостатиков (митомицина-С, 5-фторурацила) и дополняемой локальными инъекциями ингибиторов VEGF [1, 3, 4].
К настоящему времени накоплен достаточно большой арсенал различных хирургических техник и подходов к хирургическому лечению птеригиума, но поиск адекватного метода лечения птеригиума, сочетающего простоту выполнения, минимальный риск рецидивов и осложнений, оптимальный медицинский результат и косметический эффект, остается актуальной проблемой [4–6]. Несмотря на ряд разработанных новых методик лечения и хирургии рецидивирующего птеригиума, еще нет должной уверенности хирурга, что в данном конкретном случае птеригиум более не рецидивирует [1, 3, 6, 7].
В нашей практической работе мы использовали большинство современных методик хирургии птеригиума, но полученными результатами оставались не удовлетворены. Так, например, применение метода лимбальной аллотрансплантации, считающегося одной из наиболее современных хирургических технологий, по истечении трехмесячного послеоперационного периода сводило на нет все наши труды. После резорбции лимбального аллотрансплантата рубцовая ткань на месте птеригиума прорастала через создаваемый аллотрансплантатом барьер, птеригиум рецидивировал вновь. Применение анти-VEGF курсом в количестве трех инъекций с двухнедельным интервалом в тело птеригиума также давало временный «WOW-эффект»: сосуды спадались, гиперемия уменьшалась, на первое время достигался эффект остановки роста, но через месяц после прекращения введения анти-VEGF рост возобновлялся.
Неудовлетворенность достигаемым процентом стойкой ремиссии после выполненной хирургии птеригиума обусловила наш поиск по определению и разработке нового более результативного метода, заключающегося в объединение двух наиболее перспективных, на наш взгляд, методик – аутоконъюнктивопластики и лимбальной аллотрансплантации.
Цель исследования – создание инновационного комбинированного метода хирургического лечения рецидивирующего птеригиума, позволяющего достигнуть стойкий отдаленный послеоперационный результат – в максимальной степени предотвратить рецидивирование заболевания.
Материал и методы исследования
В качестве источника мультипотентных мезенхимальных стромальных клеток (ММСК) использовались фрагменты лимба от неинфицированных трупов-доноров обоих полов в возрасте от 18 до 30 лет (средний возраст 24,9 М±3,90), получаемые при заготовке роговично-склеральных дисков с целью кератопластики по описанному С.А. Борзенком и соавт. (2013) способу [8], с некоторыми изменениями питательной среды. Данная модификация питательной среды была разработана нами ранее для выращивания ММСК лимбальной зоны глаза человека [9].
Хирургическое выделение лимба во время заготовки роговично-склеральных дисков проводилось по всей окружности роговицы. Хирургическим лезвием для офтальмологических операций поверхностно проводились два кольцевых надреза. Первый надрез производился по роговичному краю лимба, второй – по склеральной зоне лимба, затем лимбальная зона отсепаровывалась от глазного яблока фрагментами длиной 3–6 мм и помещалась в пробирки Эппендорфа, заполненные питательной средой. После этого аллолимбальные фрагменты переносились в культуральные флаконы на питательную среду и помещались в CO2-инкубатор на 15–25 суток.
В качестве лимбальных аллотрансплантатов мы также использовали фрагменты децеллюляризированной донорской склеры, получаемой по методу, описанному в патенте РФ № 2627453 (А.В. Киселев и соавт., 2019) [10], с культивированными на ней ММСК в питательной среде следующего состава: среда DMEM/F12, содержащая дополнительно (на 1000 мл) декстран 40 000 – 50 г, инсулин – 0,8 мл, HEPES 1M – 15 мл, 7,5%-ный раствор бикарбоната натрия – 10 мл, 40%-ный раствор глюкозы – 10 мл, L-глутамин – 1,5 г, дексаметазон с молярностью 10-8 – 0,5 мл, амфотерицин В – 1,4 мг, пенициллин – 250 000 Ед., стрептомицин – 200 мг и фетальная лошадиная сыворотка – 200 мл (биоэтическое разрешение научно-методического совета Краснодарского филиала ФГАУ «МНТК “Микрохирургия глаза” им. акад. С.Н. Федорова» Минздрава России № 2/18 от 24.04.2018 г.).
Инновационное комбинированное лечение рецидивирующего птеригиума выполнялось следующим образом (рис. 1.).
1. Тело ранее оперированного рецидивирующего птеригиума стандартно отсепаровывалось от подлежащих тканей роговицы, лимба и склеры и максимально возможно иссекалось.
2. Лимбальный либо склеральный (обогащенный ММСК) аллотрансплантат, культивируемый при нормотермии по описанному выше способу, фиксировали к склере, используя рассасывающийся шовный материал (полиглид или ПГА 6.0 – 7.0), 2–4 узловыми швами, отступив 1 мм от лимба в зоне иссеченного птеригиума.
3. Сверху, на 12 часах, формировался аутоконъюнктивальный лоскут размерами, соответствующими иссеченной зоне птеригиума, при этом лимбальный край лоскута помечался красителем, а зона палисады Фогта разделялась вдоль пополам так, чтобы половина зоны осталась в месте иссечения аутоконъюнктивального лоскута, а половина – непосредственно на лоскуте.
4. Затем зону иссеченного птеригиума накрывали аутолимбальным трансплантатом так, чтобы прикрыть лимбальный аллотрансплантат полностью, и фиксировали «половинную» зону палисады Фогта в зоне лимба на месте иссеченного птеригиума, а оставшиеся края расправляли и фиксировали узловыми швами к склере и конъюнктиве, закрывая оставшуюся зону иссеченного птеригиума.
По описанному нами методу комбинированного лечения рецидивирующего птеригиума было проведено 10 операций. Возраст пациентов составил от 40 до 55 лет. Большинство –80% пациентов – составили мужчины. У 1 пациента мужского пола 55 лет операция выполнена сразу на двух глазах.
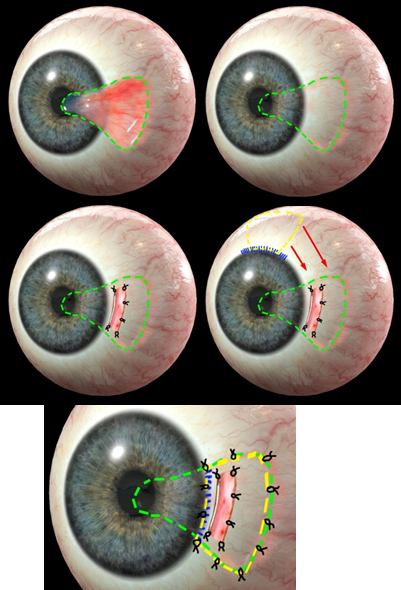
Рис. 1. Поэтапная схема комбинированного метода лечения рецидивирующего птеригиума.
(Обозначения: зеленый пунктир – место иссечения птеригиума, желтый пунктир – аутоконъюнктивальный лоскут, синие линии – зона палисады Фогта)
Результаты исследования и их обсуждение
Полная эпителизация зоны иссеченного птеригиума в проекции роговицы достигалась уже на следующий день после операции. Следует отметить, что ранний послеоперационный период протекал спокойно, ни аллергических, ни воспалительных реакций со стороны конъюнктивы не наблюдалось, тем самым устранялась одна из причин рецидива птеригиума – выраженный воспалительный процесс из-за хирургической травмы с вазодилатацией и нарушением проницаемости паралимбальной микрососудистой сети, как следствие – замедление эпителизации, неоваскуляризация, рецидив заболевания. Несмотря на ранее неоднократно развивавшиеся рецидивы птеригиума, у всех пациентов, прооперированных по предложенной методике, каких-либо нежелательных эффектов в 1–2-й годы наблюдения нами не отмечалось. Клиническое наблюдение пациентов с анализом исходов комбинированного лечения в более отдаленные сроки продолжается.
Всем пациентам в послеоперационном периоде назначались следующие официнальные препараты: инстилляции раствора дексаметазона 4 раза в день в течение 2 недель с последующим переходом на 2-кратное закапывание в течение 1 месяца; репарант – стандартизованный депротеинизированный диализат из крови здоровых молочных телят в виде глазного геля – 6 раз в день в течение 2 недель, в последующий месяц – 2 раза в день. В качестве санирующих капель назначался 4 раза в день раствор пиклоксидина – 2 недели. Швы снимались на 10–14-й день после операции. Повторная явка на контрольный амбулаторный осмотр к врачу-офтальмологу назначалась пациентам через 1, 3, 6 и 12 месяцев после операции, в дальнейшем – по самообращению пациента. Считаем необходимым отметить, что полное замещение лимбальных аллотрансплататов собственной тканью происходило в сроки от 4 до 6 месяцев. В качестве наглядной иллюстрации результативности хирургии птеригиума по предлагаемому подходу на рисунке 2 представлен пример клинического случая успешного лечения ранее неоднократно оперированного (трижды) рецидивирующего птеригиума правого глаза у пациента Н., 54 лет.
а) 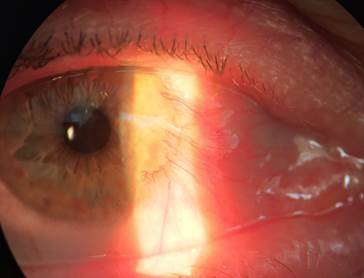
б) 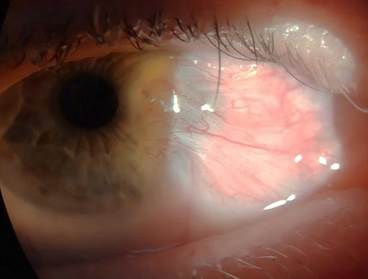
в) 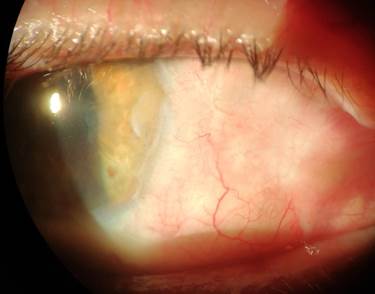
Рис. 2. Клинический пример. Процесс активного роста и четвертого рецидива птеригиума
у пациента Н. (54 года) до операции (а) и (б) (интервал между снимками 2 недели).
Зона операции через 6 месяцев (в) после хирургического вмешательства по комбинированному методу
Учитывая специфичность исходного состояния остроты зрения (ОЗ), во многом зависящей в предоперационном периоде от степени птеригиума и исходов предыдущих хирургических вмешательств, при рецидивах последнего послеоперационная динамика величины ОЗ у наших пациентов не являлась патогномоничной характеристикой в оценке текущих результатов хирургии птеригиума и ее отдаленных исходов. В то же время во всех наблюдаемых случаях отрицательная динамика ОЗ в раннем и отдаленном послеоперационных периодах по причинам, связанным с операцией, отсутствовала.
Комбинация двух наиболее перспективных методик аутоконъюнктивопластики и трансплантации фрагментов консервированного при нормотермии лимба либо децеллюляризированной склеры с культивированными на ней ММСК привела к созданию инновационного метода хирургического лечения птеригиума, позволяющего минимизировать воспалительную реакцию тканей глаза на оперативное вмешательство и тем самым уменьшить вероятность послеоперационных рецидивов. Использование широкого диапазона терапевтического потенциала ММСК в применяемых трансплантатах дает возможность создать локальный источник противовоспалительных, регенеративных цитокинов, обеспечивает местную иммуносупрессию, подавляет рост сосудистой ткани, ускоряет эпителизацию роговицы и позволяет запустить процесс регенерации вместо репарации зоны локальной лимбальной недостаточности.
Заключение
Разработанный комбинированный метод хирургического лечения рецидивирующего птеригиума в максимальной степени предотвращает рецидивирование заболевания, обеспечивая достижение стойкого отдаленного послеоперационного результата.
Библиографическая ссылка
Киселев А.В., Заболотний А.Г., Калинина Н.Ю. ЛИМБАЛЬНАЯ АЛЛОТРАНСПЛАНТАЦИЯ В КОМБИНАЦИИ С АУТОКОНЪЮНКТИВОПЛАСТИКОЙ – МЕТОД ВЫБОРА ПРИ ЛЕЧЕНИИ РЕЦИДИВИРУЮЩЕГО ПТЕРИГИУМА // Современные проблемы науки и образования. 2020. № 4. ;URL: https://science-education.ru/ru/article/view?id=30083 (дата обращения: 01.01.2026).
DOI: https://doi.org/10.17513/spno.30083



