Краниопластика – операция, направленная на восстановление утраченной части черепа пациента. Несмотря на ее многовековую историю и неизменность концептуальных принципов самого хирургического вмешательства, по мнению многих авторов, она является актуальной современной проблемой [1–3]. Интерес к подобного рода операциям поддерживается не только эволюцией взглядов [4] на оказываемые клинические эффекты [5–7], но и поиском «идеального имплантата» для закрытия дефекта. За всю историю их было проанализировано огромное множество: от подручных материалов древнейших цивилизаций [8] и отливаемых инками золотых пластин [9] до современных высокотехнологичных полимеров, используемых в аэрокосмической промышленности [3, 10]. Как итог в арсенале современного нейрохирурга имеется внушительный арсенал: PMMA (полиметилметакрилат), PEEK (полиэфирэфиркетон), HA (гидроксиапатит), TiAlV (титановый сплав), PE (полиэтилен), TCP (трикальцийфосфат), тканое синтетическое волокно (Codubix®), PU (полимеры полиуретанового ряда). За последние 20 лет в России разработано и введено в клиническую практику два полимерных материала для краниопластики: «Реперен» [11] и «Рекост» [12]. Тем не менее поиск новых материалов и способов изготовления имплантатов продолжается, и в наши дни он обусловлен еще одним фактором – появлением аддитивного производства. Трехмерная печать меняет промышленные парадигмы, что не может не сказываться и на медицинской отрасли. Уже сейчас в промышленных трехмерных принтерах доступно использование двух биосовместимых материалов [13–15]: титанового сплава (TiAlV) и полиэфирэфиркетона (PEEK), что реализовалось в создании индивидуальных медицинских изделий [16–18], в том числе и для проведения реконструктивных операций на костях черепа [19–21]. В связи с этим требуются исследования, направленные на анализ эффектов, оказываемых биосовместимыми имплантатами, полученными методом трехмерной печати.
Целью исследования была сравнительная оценка местных реакций мягких тканей животного, развивающихся в ответ на имплантацию фрагментов титановых пластин для краниопластики, произведенных двумя различными способами: 1) литья, с последующим штампованием и 2) трехмерной печати методом прямого лазерного спекания металла (DMLS – Direct Metal Laser Sintering).
Исследование состояло из двух блоков: 1) в группе № 1 животным (крысам) изделия имплантировали подкожно в области спины; 2) в группе № 2 животным (кроликам) проводили симуляцию краниопластики – формировали дефект костей черепа, который затем закрывали с помощью указанных изделий.
Материалы и методы исследования
Экспериментальное исследование было одобрено локальным этическим комитетом ФГБУ «Новосибирский НИИТО им. Я.Л. Цивьяна» Минздрава России (протокол № 094/17-1 от 06.12.2017), проводилось в соответствии с приказом Минздрава России от 01.04.2016 № 199н «Об утверждении Правил надлежащей лабораторной практики», а также в соответствии с Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях: EST № 123 от 18 марта 1986 г., Страсбург.
Типы имплантатов
Каждому испытуемому животному в ходе хирургического вмешательства устанавливали два типа изделий из титан-алюминий-ванадиевого (TiAlV) сплава (далее по тексту – титановые имплантаты), отвечающих ГОСТу Р ИСО 5832-3-2014 [22] «Имплантаты для хирургии. Металлические материалы»: фрагмент стандартного литого штампованного имплантата для краниопластики, имеющего гладкую поверхность, и имплантат, имеющий шероховатую поверхность, изготовленный по технологии прямого лазерного спекания металла (DMLS) на принтере EOS 290 из порошка титанового сплава с размером частицы от 20 до 45 мкм.
Группы исследования, сроки наблюдения, методика хирургических вмешательств, вывод из эксперимента
Группа № 1 была представлена 20 самцами крыс породы «Вистар», возрастом 3 месяца, весом 200–250 г, разделенных на три подгруппы исходя из сроков наблюдения (табл. 1). Техника имплантирования была следующей: испытуемое животное наркотизировали раствором золетил-100 из расчета 30 мг/кг внутривенно. После наступления глубокого сна на спине выбривали и обрабатывали спиртовым раствором поля хирургических вмешательств. Первым этапом в области грудопоясничного отдела позвоночника, парамедианно справа производили разрез мягких тканей до апоневроза длиной 2 см. Здесь же формировали подкожный карман, в который укладывали и фиксировали за отверстия нерассасывающейся нитью 2/0 к апоневрозу и мышцам спины фрагмент стандартного штампованного титанового имплантата. Далее выполняли гемостаз, кожу ушивали внутрикожным швом синтетической рассасывающейся нитью 5/0, накладывали асептическую повязку.
Второй этап операции выполняли аналогично первому, при этом разрез мягких тканей производили в области грудопоясничного отдела позвоночника парамедианно слева. В сформированный карман укладывали титановый имплантат, полученный методом трехмерной печати, и фиксировали к апоневрозу и мышцам нерассасывающейся нитью 2/0 за специальные фиксационные отверстия. После выполненных хирургических вмешательств животных наблюдали в условиях вивария. Вывод животных из эксперимента производили путем ингаляции избытка углекислоты в течение 15 мин, после чего выполняли забор мягких тканей из области хирургического вмешательства с установленными имплантатами единым блоком для дальнейшей морфологической оценки.
Таблица 1
Количество животных на сроках наблюдения в группах
|
Группы животных |
7 суток |
14 суток |
60 суток |
Итого |
|
№ 1 (крысы) |
6 |
7 |
7 |
20 |
|
№ 2 (кролики) |
3 |
2 |
5 |
10 |
Примечание: сравнительный анализ между группами не проводился.
Группа № 2 была представлена 10 самцами новозеландских белых кроликов, возрастом 4 месяца, весом 3000–3500 г, разделенных на три подгруппы исходя из сроков наблюдения (табл. 1). Техника имплантирования была следующей: испытуемое животное наркотизировали тиопенталом натрия 1000 мг, разведенным на 10 мл 0,9% NaCl из расчета 0,2 мг на 1 кг, через ушную вену. После наступления глубокого сна выбривали и обрабатывали спиртовым раствором поле хирургического вмешательства. Разрез мягких тканей выполняли на своде черепа по средней линии длиной 3,5–4 см, далее производили скелетирование лобной и теменных костей с двух сторон. Края раны фиксировали ранорасширителем Янсена. При помощи высокооборотной дрели с наборами лепестковых фрез парамедианно в левой и правой теменных костях формировали трепанационные окна размерами 1,5х1,5 см, после чего справа устанавливали и фиксировали внахлест кости клеевой композицией (сульфакрилат) фрагмент штампованного титанового имплантата (рис. 1а); слева устанавливали и также фиксировали клеевой композицией титановый имплантат, изготовленный методом трехмерной печати (рис. 1с).
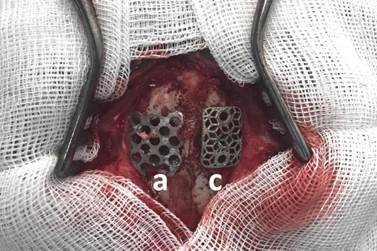
Рис. 1. Имитация краниопластики в эксперименте: парамедианно, в левой и правой теменных костях животного группы № 2 сформированы трепанационные отверстия, справа (а) установлен фрагмент стандартного штампованного имплантата;
слева (с) – имплантата, изготовленного методом трехмерной печати
Осуществляли гемостаз, производили послойное закрытие раны. Кожу ушивали внутрикожным швом синтетической рассасывающейся нитью 5/0. Накладывали асептическую повязку. После выполненных хирургических вмешательств животных наблюдали в условиях вивария. Вывод животных из эксперимента производили путем внутрибрюшинного введения летальной дозы тиопентала натрия, после чего выполняли забор мягких тканей из области хирургического вмешательства с установленными имплантатами единым блоком для дальнейшей морфологической оценки.
Методика подготовки тканей и морфологическая оценка полученного материала
Для морфологического исследования в группе № 1 были взяты фрагменты мягких тканей спины над имплантатом, которые в расправленном виде на пластине фиксировали в 10%-ном нейтральном формалине, затем подвергали стандартной обработке на гистологическом комплексе «MICROM» с последующей заливкой в парафиновые блоки. Срезы толщиной 4 мкм окрашивали гематоксилином и эозином, толуидиновым синим для выявления железа в клетках по Перлсу, по методу ШИК – гематоксилин – оранжевый G. Препараты исследовали в проходящем свете на микроскопе «Axioskop 40», микрофотографии сделаны фотокамерой AxioCam MRc5 (CarlZeiss, Германия).
После извлечения образцов тканей в группе № 2 их помещали в забуференный (рН 7,4) 10%-ный водный раствор формалина (BioVitrum, Россия). После суточной фиксации в формалине (2 смены раствора формалина по 12 ч каждая) биоматериал постфиксировали 1%-ным тетраоксидом осмия в 0,1M фосфатном буфере в течение 12 ч, затем окрашивали 2%-ным тетраоксидом осмия в бидистиллированной воде в течение 48 ч. Далее образцы обезвоживали в серии спиртов возрастающей концентрации (50%, 60%, 70%, 80% и 95% этанол, все по две смены, каждая смена по 15 мин), окрашивали 2%-ным уранилацетатом (Electron Microscopy Sciences, США) в 95%-ном этаноле (5 ч), обезвоживали 99,7%-ным изопропанолом (Bio Vitrum, Россия) в течение 5 ч и ацетоном (Реахим, Россия) в течение 1 ч, пропитывали смесью ацетона с эпоксидной смолой Epon (Electron Microscopy Sciences, США) в соотношении 1:1 (6 ч), после чего переносили в свежую порцию эпоксидной смолы (на 24 ч) и далее проводили ее полимеризацию в емкостях FixiForm (Electron Microscopy Sciences, США) при 60°С. После этого образцы в эпоксидных блоках подвергали шлифовке и полировке на установке TegraPol-11 (Struers, США). Контрастирование цитратом свинца проводили по Рейнольдсу в течение 7 мин путем нанесения раствора на поверхность шлифованного образца с последующей его отмывкой бидистиллированной водой. Далее проводили напыление на полированную поверхность эпоксидных блоков углерода (толщина покрытия 10–15 нм) с помощью вакуумного напылительного поста (EM ACE200, Leica). Визуализацию структуры образцов при помощи сканирующей электронной микроскопии в обратно-рассеянных электронах проводили на электронном микроскопе Hitachi-S-3400N (Hitachi, Япония) в режиме BSECOMP при ускоряющем напряжении 10 кВ. На цифровых микрофотографиях оценивали особенности гистологической структуры тканей, окружающих материал имплантата.
С целью объективизации результатов исследования плотности васкуляризации сосудов до 15 мкм в диаметре проводилась их морфометрическая оценка на 1000 мкм2 в сроки 7, 14 и 60 суток. Наряду с этим морфометрически на основании 41 замера параметров для каждой группы исследовалась тканевая реакция в области имплантации путем измерения ширины соединительной ткани. Данные анализировались с помощью программного обеспечения OLYMPUS Stream Версия 2.4.2.
Результаты исследования и их обсуждение
Животных обеих групп после оперативных вмешательств наблюдали в условиях вивария. Досрочно выбывших из эксперимента животных зафиксировано не было, послеоперационный период протекал без особенностей, питание было достаточным, поведение – адекватным, раны заживали первичным натяжением, без признаков инфицирования и несостоятельности. Общий статус не страдал, животных с наличием токсических и аллергических реакций зафиксировано не было.
При морфологическом исследовании образцов тканей животных группы № 1 через неделю после проведения операции в зоне контакта стандартного имплантата преобладали два типа тканевой реакции. При первом типе участки с картиной локальной деструкции шириной до 50 мкм были представлены организующимся тканевым дебрисом с единичными фибробластами. В таких участках наблюдались группы крупных веретенообразных клеток с гиперхромными, удлиненными ядрами, вероятно, ангиальных предшественников (рис. 2А). При втором типе определялись участки с преобладанием фибропластической реакции и началом формирования упорядоченных соединительнотканных волокон, где также определялись крупные удлиненные гиперхромные клетки (рис. 2Б). Одновременно в прилегающем слое поперечнополосатой мускулатуры наблюдались стромальный отек, плазморрагия и фокальный миолиз волокон (рис. 2В).

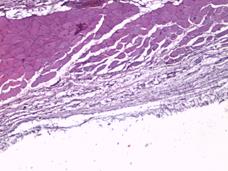
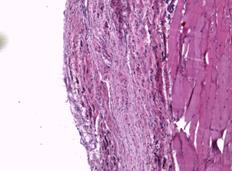
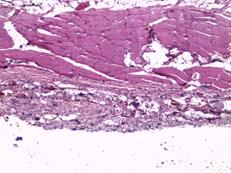
Рис. 2. Участки с картиной локальной деструкции, шириной до 50 мкм, представленные организующимся тканевым дебрисом с умеренной фибробластатической реакцией, группами крупных удлиненных веретенообразных клеток с гиперхромными ядрами. Увеличение х40, группа сравнения (А); участки с преобладанием фибропластической реакции и началом формирования упорядоченных соединительнотканных волокон. Увеличение х40, группа сравнения (Б); иллюстрация стромального отека, плазморрагии и фокального миолиза в прилегающем слое поперечнополосатой мускулатуры. Замещение волокон рыхлой соединительной тканью. Увеличение х40, группа сравнения (В); плазморрагия волокон, элементы фокального миолиза и стромального отека с незначительной фибропластической реакцией. Увеличение х40, исследуемая группа (Г)
В группе с имплантатом, изготовленным методом трехмерной печати, на 7-е сутки после выполненной операции в участках поперечнополосатой мускулатуры наблюдались плазморрагии, элементы фокального миолиза и стромального отека с незначительной фибропластической реакцией (рис. 2Г). Наряду с этим в значительной части исследуемой области определялась преобладающая фибропластическая реакция. В таких местах выявлялась значительная очаговая ангиоматозная реакция из сосудов, просвет которых был не более 10х15 мкм (рис. 3А).
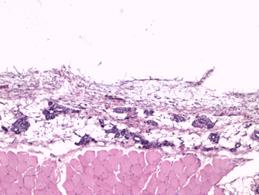
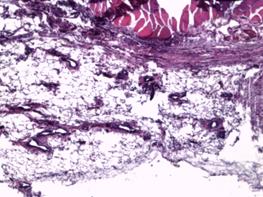
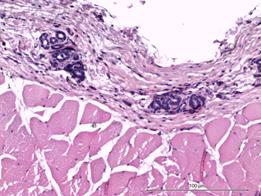
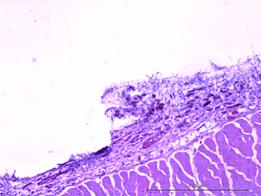
Рис. 3. Значительная очаговая ангиоматозная реакция из групп сосудов, просвет которых не более 10х15 мкм. Увеличение х40, исследуемая группа (А); рыхлая соединительная ткань в зоне контакта. Сосуды преимущественно щелевидной формы, эндотелий сосудов резко гиперхромен, медиальный слой сосудистых стенок акцентирован. Увеличение х150, группа сравнения (Б); зрелая соединительная ткань с очаговым ангиоматозом в месте контакта с имплантатом. Увеличение х150, группа сравнения (В); зрелая соединительная ткань с равномерно распределенными сосудистыми образованиями, овальной формы, с диаметрами просветов не более 15–20 мкм. Увеличение х150, исследуемая группа (Г)
На сроках 14 суток в группе стандартного имплантата в половине участков в зоне контакта отмечалась рыхлая соединительная ткань, замещавшая слой поперечнополосатой мускулатуры, преобладали сосуды щелевидной формы, располагавшиеся группами, неравномерно. Эндотелий сосудов резко гиперхромный, медиальный слой сосудистых стенок акцентирован (рис. 3Б). В другой половине формировалась зрелая соединительная ткань с очаговым ангиоматозом (рис. 3В).
На идентичных сроках наблюдения в группе индивидуального имплантата характерной чертой морфологического материала являлась относительно мономорфная реакция: зрелая соединительная ткань с равномерно распределенными сосудистыми образованиями, овальной формы, с диаметрами просветов не более 15–20 мкм (рис. 3Г и 4А).
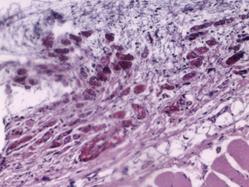
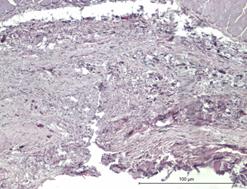
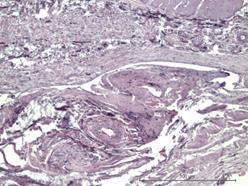
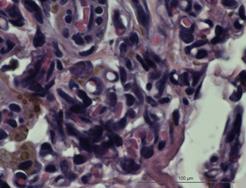
Рис. 4. Зрелая соединительная ткань с равномерно распределенными сосудистыми образованиями высокой плотности с диаметрами просветов не более 15–20 мкм. Увеличение х380, исследуемая группа (А); зрелая соединительная ткань с незначительной васкуляризацией, сосудами с диаметрами просветов не более 10–15 мкм. Увеличение х150, группа сравнения (Б); сформированный ангиоматоз представлен клубками толстостенных сосудов в фиброзированной ткани. Увеличение х150, группа сравнения (В); сформированный ангиоматоз, представленный мелкими, медузообразно ветвящимися сосудами с гиперхромным эпителием. Увеличение х380, группа сравнения (Г)
Через 60 суток после операции с использованием стандартного имплантата основной характеристикой места контакта являлась неоднородность формирования ткани. Определялись участки зрелой соединительной ткани с незначительной васкуляризацией сосудами не более 10–15 мкм (рис. 4Б). Другой тип тканевой реакции был представлен сформированным ангиоматозом, клубками толстостенных сосудов в фиброзированной ткани (рис. 4В), а также формирующимся ангиоматозом в виде мелких, медузообразно ветвящихся сосудов с гиперхромным эпителием (рис. 4Г).
В зоне контакта мягких тканей с индивидуальным имплантатом через 2 месяца после вмешательства характерной морфологической картиной являлось равномерное распределение толстостенных сосудов с диаметром небольшого просвета, от 10 до 15 мкм, в зрелой соединительной ткани; более того, часть просветов таких сосудов была облитерирована (рис. 5).
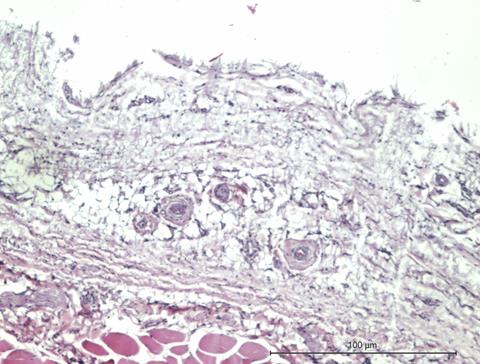
Рис. 5. Равномерное распределение толстостенных сосудов с диаметром небольшого просвета (от 10 до 15 мкм) в зрелой соединительной ткани, часть просветов таких сосудов облитерирована. Увеличение х150, исследуемая группа
Морфометрические результаты исследования плотности васкуляризации сосудами до 15 мкм в диаметре представлены в таблице 2.
Таблица 2
Сопоставление морфометрических результатов плотности васкуляризации сосудами диаметром до 15 мкм в зоне контактов стандартных и индивидуальных имплантатов
на 1000 мкм2 на сроках 7, 14 и 60 суток
|
Сроки наблюдения |
Плотность васкуляризации в зоне контактов мягких тканей и имплантатов на 1000 мкм2 |
|
|
Стандартный |
Индивидуальный |
|
|
7 суток |
– |
25±8 |
|
14 суток |
94±10 |
132±14 |
|
p<0,05 |
||
|
60 суток |
53±9 |
10±1 |
|
p<0,05 |
||
Примечание. *Результаты достоверны при р≤0,05 по критерию Стьюдента
С целью исследования реакции мягких тканей в области имплантации была изучена зона адаптации имплантатов к тканям с измерением ширины соединительной ткани (табл. 3). Выполнено по 41 замеру параметров для каждой группы.
Таблица 3
Результаты измерения ширины соединительной ткани в области установки имплантатов
|
Сроки наблюдения |
Группа исследования |
Среднее значение ± Стандартная ошибка, мкм |
Значение p |
|
7 суток |
Индивидуальный имплантат |
57,5±12,2 |
p<0,05 |
|
Стандартный имплантат |
94,9±22,9 |
||
|
14 суток |
Индивидуальный имплантат |
69,8±21,6 |
p<0,05 |
|
Стандартный имплантат |
88,3±45,1 |
||
|
60 суток |
Индивидуальный имплантат |
128,5±44,1 |
p<0,05 |
|
Стандартный имплантат |
179,3±69,9 |
Примечание: t-критерия Стьюдента для независимых выборок p≤0,05
При интерпретации объективных данных микроскопического исследования препаратов на стороне имплантации фрагментов стандартных титановых сеток было отмечено увеличение объема образующейся соединительной ткани на фоне выраженной сосудистой реакции с формированием межтканевого отека, что явилось следствием травматизации вышележащих мягких тканей. Это объяснялось тем, что биологическая фиксация в области имплантации штампованных титановых сеток из-за их гладкой поверхности минимальна, в результате чего возникала постоянная подвижность мягких тканей над имплантатом, это и приводило к повреждению гладкомышечного слоя с формированием межтканевого отека и нарушению заживления в области хирургического вмешательства.
В гистологических препаратах, взятых из областей, где были использованы титановые пластины, изготовленные методом трехмерной печати, отчетливо визуализировалась рыхлая соединительная ткань с минимальным наличием межтканевой жидкости и формированием оформленной, зрелой ткани в зоне имплантации. Это было связано с тем, что установка титанового имплантата с шероховатой поверхностью приводит к значительно выраженной биологической фиксации между поверхностью и прилегающими тканями за счет увеличения площади контакта в идентичном объеме ткани. Данный факт способствовал максимальному сцеплению тканей с имплантатом и его максимальной ретенции, минимизируя дополнительную подвижность кожи и прилегающих структур. Как следствие, регенеративные процессы на стороне использования напечатанных имплантатов протекали быстрее по сравнению со стороной, где устанавливали фрагменты стандартной титановой сетки. Полученные результаты свидетельствуют о статистически значимых различиях.
Морфологическая оценка материала в группе № 2 проводилась при помощи сканирующей электронной микроскопии в обратно-рассеянных электронах на электронном микроскопе (увеличение х100–1000). На сроках 7 суток после установки фрагмента стандартного имплантата в окружающих мягких тканях наблюдали минимальные проявления реакции организма на наличие инородного материала, которые проявлялись в виде присутствия небольшого количества диффузно расположенных лейкоцитов, не контактирующих с материалом имплантата, что, вероятно, было обусловлено реакцией на оперативное вмешательство. Вблизи образца присутствовал сплошной слой соединительно-жировой ткани, не имеющей плотного контакта с материалом изделия. Исследование тканей, окружающих индивидуальный имплантат на аналогичных сроках после проведенного оперативного вмешательства, продемонстрировало плотный контакт рыхлой соединительной ткани с поверхностью изделия. Реакция на имплантацию, так же как и в случае с фрагментом стандартного имплантата, была минимальной, выражалась в виде присутствия небольшого количества диффузно расположенных лейкоцитов. Сам имплантат имел неровную поверхность, эти неровности были разнообразны по форме. При малых увеличениях большая их часть имела очертания округлых выпуклостей, чередующихся с углублениями. Углубления имели различную форму, направление и протяженность. При больших увеличениях отмечали, что поверхность образца имеет значительные неровности.
На 14-е сутки после имплантации на стороне стандартного имплантата плотная соединительная ткань имела различные степени примыкания. Часть поверхности имплантата не имела прямого контакта с поверхностью сплава, между ней и соединительной тканью находилось пространство, не содержащее в своем составе электронно-плотных элементов (рис. 6А). В области углов, во внутренней структуре окружающей ткани, наблюдали наличие клеток, относящихся к воспалительной группе, главным образом макрофагов. Этот участок был окружен плотной соединительной тканью, содержащей в своем составе крупные кровеносные сосуды. Другая часть поверхности имела тесный контакт с плотной соединительной тканью. В третьем варианте на границе со сплавом наблюдали наличие тонкого слоя рыхлой соединительной ткани. В этом случае плотный контакт отсутствовал, на границе отмечалось большое количество пустот. Кроме того, в этой области наблюдали присутствие макрофагов, содержащих большое количество вакуолей.
К этому сроку на стороне индивидуального имплантата последний находился в составе соединительной ткани, представленной преимущественно фиброцитами. В отличие от стороны, где устанавливали стандартный имплантат, наблюдали плотный контакт вновь образованной ткани с поверхностью изделия (рис. 6Б).
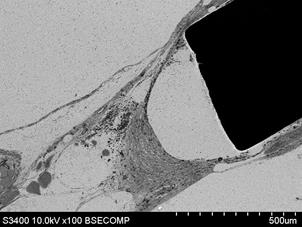

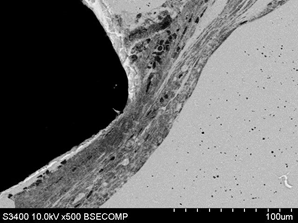
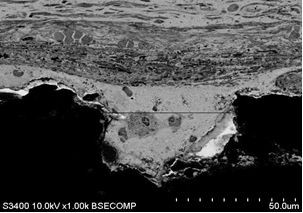
Рис. 6. Контакт тканей с фрагментом стандартного имплантата (А – увеличение х100) и индивидуального имплантата (Б – увеличение х1000), полученного методом трехмерной печати, на сроке 14 суток после выполненного хирургического вмешательства; контакт тканей с фрагментом стандартного имплантата (В – увеличение х500) и полученного методом трехмерной печати (Г – увеличение х1000) на сроке 60 суток после проведения оперативного вмешательства
В образцах материалов с фрагментом стандартного штампованного имплантата на 60-е сутки исследования последний находился в составе биологических тканей и был окружен неравномерным слоем соединительной ткани. Наиболее плотный контакт вновь образованной ткани наблюдался на внешних поверхностях имплантата, наименьший – на боковых. На угловых частях имплантата отмечали плотное примыкание соединительной ткани с внешней стороны, переходящей в слой рыхлой соединительной ткани, содержащей макрофаги, а затем – в тонкий слой уплотненного материала, контактирующего с боковой поверхностью (рис. 6В). Между этим слоем и плотной соединительной тканью находилось свободное пространство. На указанном сроке имплантации сохранялся слабо выраженный процесс пролиферативного воспаления и формирования окружения из плотной соединительной ткани.
В образцах тканей с установленным индивидуальным имплантатом на сроке 60 суток структурные элементы были окружены неравномерным слоем соединительной ткани. По всему периметру образца отмечался плотный контакт соединительной ткани с материалом сплава (рис. 6Г), в ее составе часто наблюдалось присутствие кровеносных сосудов.
Ежегодно количество медицинских имплантатов, изготавливаемых путем аддитивных технологий, увеличивается, растет их использование в клинической практике, что позволяет в полной мере реализовывать концепцию персонализированной медицины [23–25]. Производственный процесс при трехмерной печати отличается от традиционного литейного: титановый сплав (TiAlV) в виде порошка подается в рабочую камеру трехмерного принтера в количествах, необходимых для нанесения одного слоя. Специальный валик выравнивает поданный порошок в ровный слой и удаляет излишний материал из камеры, после чего лазерная головка спекает частицы свежего порошка между собой и с предыдущим слоем согласно контурам, определенным цифровой моделью. После завершения вычерчивания слоя процесс повторяется: валик подает свежий материал, и лазер начинает спекать следующий слой [26]. Так слой за слоем формируется объект заданной формы. Изделия, получаемые данным способом, имеют шероховатую поверхность, показатели которой соответствуют Rz 20–50 мкм.
Несмотря на значительное количество работ [27–29], в основном в области стоматологии, травматологии и ортопедии, по изучению реакции тканей человека и животных [30], а также остеоинтеграции титановых имплантатов [31–33], проведение эксперимента было продиктовано необходимостью исследования реакций мягких тканей организма на новые типы изделий, получаемых методом трехмерной печати. В области нейрохирургии изучение морфологических изменений в окружающих имплантат мягких тканях имеет больший приоритет, чем при интеграции имплантата в плоские кости черепа. Это объясняется тем, что имплантаты для краниопластики не испытывают постоянной динамической нагрузки, они статичны и защищают мозг от воздействия внешних причин. В то же время количество научных работ, фокусирующихся на указанной проблеме, не так велико [34–35]. В отличие от большинства имплантатов, используемых в травматологии и ортопедии, которые, как правило, прикрыты слоем мышц и сухожилий, имплантаты черепа контактируют с апоневрозом головы. Последний, в свою очередь, подвержен трофическим дегенеративным изменениям, являющимся следствием предыдущих нейрохирургических вмешательств. Помимо этого, после краниопластики развивается сокращение кожно-апоневротического лоскута, и после установки имплантата может наблюдаться натяжение тканей. Перечисленные обстоятельства повышают риски трофических нарушений мягких тканей головы с формированием свищей и обнажением установленных краниальных имплантатов [36]. Эти данные явились дополнительным основанием для проведения морфологических исследований по изучению реакции мягких тканей на имплантат, изготовленный методом трехмерной печати.
В ходе формирования дизайна эксперимента нами была выдвинута гипотеза, что шероховатая поверхность имплантата будет способствовать лучшей интеграции изделия в окружающие мягкие ткани. В остальном не ожидалось, что реакции организма на имплантаты будут различаться, поскольку, хоть они и были изготовлены двумя различными способами: литья и трехмерной печати, но производились из идентичного титан-алюминий-ванадиевого (TiAlV) сплава, разрешенного для использования в клинической практике.
Подтверждение этому предположению было получено в проведенном эксперименте: раны у всех исследуемых животных заживали первичным натяжением, без признаков инфицирования и несостоятельности. Локальные реакции были схожи и проходили через стадии локального асептического воспаления, формирования рыхлой соединительной ткани и последующего формирования зрелого соединительнотканного рубца. На стороне имплантации изделий, полученных методом трехмерной печати, отмечались плотный контакт окружающих тканей ко всем шероховатостям имплантата, а также более выраженная пролиферация сосудов. Это, как нам представляется, объясняется значительно выраженной биологической фиксацией индивидуального шероховатого имплантата к прилегающим мягким тканям в сравнении со стандартным гладким имплантатом, что приводит к максимальному сцеплению тканей с имплантатом и минимизирует дополнительную подвижность кожи и прилегающих структур. В результате этого регенеративные процессы протекают быстрее по сравнению с группой сравнения.
Полученные результаты подтверждены объективными морфометрическими методами исследования плотности васкуляризации сосудов и изучением ширины соединительной ткани в зоне имплантации. Они свидетельствуют о статистически значимых различиях и преимуществе индивидуального имплантата, изготовленного методом трехмерной печати из титанового порошка, который быстрее и полноценнее интегрируется с окружающими мягкими тканями животных.
Выводы
1. В группах с различными типами имплантируемых изделий морфологические локальные реакции мягких тканей были однотипны и проходили через стадии локального асептического воспаления, формирования рыхлой соединительной ткани с последующим образованием зрелого соединительнотканного рубца.
2. Значительно выраженная биологическая фиксация индивидуальных шероховатых имплантатов к прилегающим мягким тканям в сравнении со стандартным гладким имплантатом приводит к максимальному сцеплению тканей с имплантатом, ускорению регенеративных процессов и формированию зрелого соединительнотканного рубца.
Авторы заявляют об отсутствии конфликтов интересов, связанных со статьей.
Библиографическая ссылка
Мишинов С.В., Копорушко Н.А., Ларионов П.М., Мухамадияров Р.А., Зайдман А.М., Базлов В.А., Ступак В.В. МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА РЕАКЦИЙ МЯГКИХ ТКАНЕЙ ПРИ ИМПЛАНТАЦИИ ТИТАНОВЫХ ИМПЛАНТАТОВ ДЛЯ КРАНИОПЛАСТИКИ. ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ // Современные проблемы науки и образования. 2020. № 4. ;URL: https://science-education.ru/ru/article/view?id=29999 (дата обращения: 31.01.2026).
DOI: https://doi.org/10.17513/spno.29999



