Ламинэктомия является одним из наиболее часто выполняемых хирургических вмешательств на позвоночнике при лечении широкого спектра его патологий, в частности: при стенозах позвоночного канала дегенеративного генеза; при онкологических заболеваниях и травмах позвоночника с использованием стабилизирующих металлоконструкций и без них [1]. Основные цели ламинэктомии – это декомпрессия сосудисто-невральных структур позвоночного канала и создание благоприятных условий для восстановления их функций и регресса неврологической симптоматики. При ламинэктомии может формироваться синдром неудачно оперированного позвоночника (Failed Back Surgery Syndrome – FBSS), имеющий гетерогенную структуру с хирургическими и нехирургическими причинами, которые в 100% случаев сочетаются в послеоперационном периоде с эпидуральным фиброзом различной степени его выраженности. Основным клиническим проявлением FBSS является болевой синдром различной степени интенсивности, который вынуждает пациента повторно обращаться за медицинской помощью. Сохранение болевого синдрома при лечении пациента консервативными методами в течение 4–6 недель заставляет хирурга задумываться о причинах сохранения стойкого болевого синдрома в послеоперационном периоде и решении вопроса о проведении повторного хирургического вмешательства [2]. При ламинэктомии нарушается биомеханика в оперированном позвоночно-двигательном сегменте и смежных с ним уровнях, что приводит в дальнейшем к прогрессированию дегенеративно-дистрофических изменений в зоне оперативного вмешательства с последующим формированием спондилоартроза, болезни смежного уровня и т.д. [3, 4]. В отдаленном периоде хирургического лечения больных могут формироваться эпидуральный фиброз, нейропатический болевой синдром и происходить прогрессирование дегенеративного процесса в зоне хирургического воздействия [4, 5]. Механическая перегрузка позвоночно-двигательного сегмента является важным фактором риска дегенерации межпозвонкового диска, которая вызывается посредством апоптоза клеток, в связи с чем его механическое сжатие является важным регулятором клеточной биологии [6, 7, 8]. В работе Xu Q показано, что механический фактор роста (Mechano Growth Factor – MGF) ингибирует апоптоз хондроцитов, вызванный механической перегрузкой за счет снижения активности пути p38 MAPK (митоген-активируемая протеинкиназа) в клетках пульпозного ядра, и является аутокринным и эндокринным фактором роста, экспрессия которого выявляется во многих тканях при определенных условиях [9, 10]. Кроме того, MGF способен регулировать пролиферацию клеток, дифференцировку и их миграцию и проявляет некоторые защитные эффекты против различных вредных стимулов [9], таких как механическая перегрузка клеток пульпозного ядра, которая ведет к увеличению активности пути p38 MAPK. Активация пути MAPK может запускаться различными внеклеточными и внутриклеточными стимулами [11], а также осуществлять регуляцию клеточной активности, включая их пролиферацию, дифференцировку, выживание и апоптоз [12]. Исследования показали, что сигнальный путь MAPK принимает участие в развитии фиброзного кольца межпозвонкового диска и важен для нормальной дифференцировки его клеток [13, 14]. Следует отметить, что сигнальный путь MAPK влияет на ремоделирование костной ткани за счет регуляции дифференцировки остеокластов [15]. Известно, что протеогликаны участвуют в регуляции органогенеза посредством модуляции множества сигнальных путей, включая пути TGF-β и MAPK [16]. Из этого следует, что репарация тканей при раневом процессе в зоне ламинэктомии осуществляется через МАР-киназный каскад, который регулируется транскрипцией генов в ответ на повреждение тканей во время оперативного вмешательства [17].
Митоген-активируемые протеинкиназы (MAPKs) представляют собой семейство внутриклеточных сигнальных молекул, которые эволюционно консервативны. Это семейство состоит из трех основных членов внеклеточной регулируемой по сигналу киназы (ERK, включая ERK1 / 2), p38 (включая p38α, p38β, p38γ и p38δ) и c-Jun N-терминальной киназы (JNK, включая JNK1, JNK2, JNK3, ERK5). Все MAPKs активируются путем фосфорилирования через различные восходящие MAPK-киназы (MKKs или MEKs), а MKKs активируются с помощью MAPK-киназных киназ (MEKKs) [18, 19, 20]. MAP-киназы в ответ на внешний стимул преобразуют спектр транскрипции определенных генов, изменяя активность их экспрессии, а следовательно, и синтез белков (продуктов), что приводит к специфическим морфологическим и функциональным изменениям в тканях [18]. JNK-киназы активируются провоспалительными цитокинами и играют важную роль в регуляции воспалительных реакций, нейродегенерации и гибели клеток [19]. p38 MAPK – это класс протеинкиназ, которые реагируют на стрессовые стимулы и участвуют в дифференцировке клеток и апоптозе [19].
Роль МАР-киназ в формировании соединительной ткани
Формирование соединительной ткани в зоне оперативного вмешательства является детерминированным репаративным процессом, который представляет взаимоотношение действия клеточных элементов в ограниченной области через МАР-киназный каскад и тесно взаимосвязан с многочисленными реакциями организма (функцией нервной и эндокринной систем, развитием шоковых состояний, с генетическими и фенотипическими особенностями организма и т.д.). Процесс заживления раны всегда цикличен и характеризуется фазностью и в 100% случаев сопровождается формированием соединительной ткани [21]. Сформированный эпидуральный фиброз сдавливает нервные корешки и приводит к нарушению ликвородинамики и венозному застою в корешке, вызывая атрофию его нейронов и демиелинизацию аксонов. Фиксация корешка спайками в одном положении повышает его чувствительность к растяжению и компрессии и приводит к нарушению обменных процессов в них из-за периневрального фиброза, так как корешки получают примерно 58% питательных веществ из окружающего их ликвора, поэтому даже небольшая компрессия корешка при эпидуральном фиброзе приводит к его ишемии [22, 23]. Сформированный соединительнотканный рубец в эпидуральном пространстве может иметь различное морфологическое строение. Коллагеновые волокна составляют основу соединительной ткани. Различают 28 видов коллагена, которые кодируются более чем 40 генами, которые различаются по молекулярной организации и тканевой принадлежности. Более 90% всего коллагена в организме представлено коллагеном I, II, III и IV типов [24]. Основой соединительной ткани является коллаген I и III типов. По данным иммуноморфологического анализа III тип коллагена образует основу коллагеновых волокон соединительной ткани и незрелых волокон грануляционной ткани, в то время как грубые и зрелые волокна соединительной ткани состоят в основном из коллагена I типа. В процессе биосинтеза коллагена во время формирования соединительнотканного рубца преобладает коллаген I типа, который синтезируется дифференцированными фибробластами. Общее накопление коллагена в рубцовой ткани является основным фактором, определяющим механические свойства рубца. Типы I, III, IV и VIII секретируются миофибробластами [25, 26], а остальные типы коллагена, по данным литературы, менее известны. Следует отметить, что миофибробласты только временно присутствуют в физиологическом процессе восстановления поврежденной ткани, а затем постепенно исчезают (возможно, подвергаются апоптозу или возвращаются к неактивному фенотипу, как только процесс формирования рубца завершается) [27, 28]. Напротив, миофибробласты сохраняются в активированном состоянии при фиброзных заболеваниях, характеризующихся чрезмерным отложением плотного внеклеточного матрикса, который в худшем случае вызывает нарушение не только структуры, но и функции органа [27, 28]. Поэтому формирование фиброза можно рассматривать как длительный, усугубленный и не всегда законченный процесс восстановления тканей, возникающий в ответ на повторные их повреждения независимо от этиологии. Понимание полученных новых знаний в регуляции формирования эпидурального фиброза в зоне оперативного вмешательства очень важно, ибо позволит клиницистам правильно оценивать механизмы его патогенеза, принимать соответствующие меры по профилактике и адресной коррекции при его формировании. Исследования И.А. Шурыгиной с соавт. свидетельствуют, что подавление активности JNK-каскада ведет к стимуляции р38 МАРК и способствует укорочению времени формирования соединительной ткани в зоне хирургического рубца в эксперименте [25]. Предложена и показана возможность управлять ростом соединительной ткани при влиянии на МАР-киназные каскады, пролонгируя блокаду р38 МАРК, что приводит к уменьшению ширины кожного рубца и плотности коллагеновых волокон в зоне образования послеоперационного рубца в эксперименте. Снижается приток прогениторных клеток фибробластического ряда в зону оперативного вмешательства при формировании послеоперационного рубца с повышением фиброкластической активности [25].
Участие МАР-киназ в развитии нейропатической боли
При ламинэктомии в отдаленном периоде хирургического лечения у пациентов формируется эпидуральный фиброз с разной степенью его выраженности, ведущий к компрессии сосудисто-невральных структур позвоночного канала с последующим формированием нейропатического болевого синдрома, неоднородного по интенсивности. Нейропатический болевой синдром не всегда коррелирует с морфологическими изменениями тканей в области оперативного вмешательства [29, 30]. В определение нейропатической боли входит стойкий, хронически изнуряющий болевой синдром, часто являющийся следствием повреждения нерва или вызванный поражением или болезнью соматосенсорной системы [31, 32]. Не у всех пациентов с периферической нейропатией или повреждением центральной нервной системы развивается нейропатическая боль [33, 34]. Так, известно, что ганглий дорсального корешка (DRG) в процессе развития хронической нейропатической боли является активной анатомической единицей, а не пассивной. DRG метаболически поддерживает физиологические функции между периферической нервной системой (ПНС) и центральной нервной системой (ЦНС). Периферические болевые стимулы передаются вдоль нейронов дорсальных корешковых ганглиев, что делает эти длинные биполярные нейроны, которые простираются от периферических рецепторов на конечностях до спинного мозга, важной мишенью для вмешательства при боли [35]. В работе Krames ES [36] показано, что DRG участвует в процессе генерации нейропатической боли при метаболических изменениях в нем. Отечественные и зарубежные авторы уделяют большее внимание механизмам формирования нейропатической боли, нежели этиологии ее возникновения [35, 36, 37]. При механическом повреждении к летки высвобождается большое количество медиаторов, которые могут воздействовать положительно или отрицательно на окружающие ткани и изменять ноцицептивные сигналы. На страницах литературы обсуждаются наиболее важные микроглиальные внутриклеточные сигнальные каскады (MAPKs, NF-κB, JAK / STAT, PI3K / Akt), которые участвуют в развитии и поддержании нейропатической боли. [20, 36]. При повреждении и воспалении периферической нервной системы генные изменения в нейронах DRG являются важной причиной возникновения нейропатической боли [36]. Так, длительный афферентный приток ноцицептивной информации может привести к пространственному и временному суммированию импульсов, что способно вызывать чрезмерную деполяризацию и расширение нейронных рецептивных полей. Изменения в периферическом нерве, вызванные его повреждением, включают как повышающую, так и понижающую регуляцию экспрессии различных генов в DRG, что может способствовать развитию гиперчувствительности сенсорных нейронов [20, 36]. Развитие нейропатической боли также сопровождается воспалительным компонентом в соматосенсорных волокнах периферической нервной системы. Воспалительные медиаторы, такие как провоспалительные цитокины (IL-1β, TNFα), простагландины, оксид азота и фактор роста нерва, высвобождаются в месте повреждения нерва. Эти факторы участвуют в генерации спонтанной активности и могут усиливать болевую гиперчувствительность. Известно, что активность первичных афферентов влияет на пластичность ноцицептивных нейронов на уровне ЦНС. Этот процесс в литературе известен как «центральная сенсибилизация». Механизмы, лежащие в основе этих процессов, включают усиленную возбуждающую или сниженную тормозную синаптическую передачу [20]. В литературе имеются данные использования ингибиторов р38 МАРК с эффективно доказанным лечением нейропатической боли в доклинических моделях. Применяемые ингибиторы изменяют экспрессию генов, которые осуществляют посттранскрипционный контроль и играют роль в восприятии болезненных раздражителей сенсорными нейронами [32, 38–41]. Известно, что фосфорилирование Na-каналов с помощью p38 МАРК увеличивает пиковую плотность тока в DRG и предполагает участие p38 МАРК в формировании не только болевого синдрома воспалительного генеза, но и в механизмах развития нейропатической боли [35, 42, 43]. В лечении нейропатического синдрома в литературе известны работы по интратекальному и эпидуральному введению препаратов, которые напрямую влияют на степень интенсивности нейропатической боли [40, 44]. В работе Jose C. et al. [44] обсуждается информация о том, что плазма, богатая факторами роста (PRGF), способна восстанавливать и регенерировать костную и хрящевую ткани и обладает высоким нейропротекторным и противовоспалительным действием, модулирует иммунный ответ, уменьшает нейропатический болевой синдром. Факторы роста, введенные в эпидуральное пространство, изменяют внутриклеточный МАР-киназный каскад, который изменяет клеточный хемотаксис, ангиогенез, синтез коллагенового матрикса и пролиферацию клеток [44, 45].
Заключение
Исходя из анализа данных литературы следует отметить важную роль МАР-киназ в репаративном процессе тканей операционной раны при ламинэктомии. В частности, раскрыты механизмы воздействия МАР-киназ на формирование эпидурального фиброза и нейропатического синдрома (рисунок).
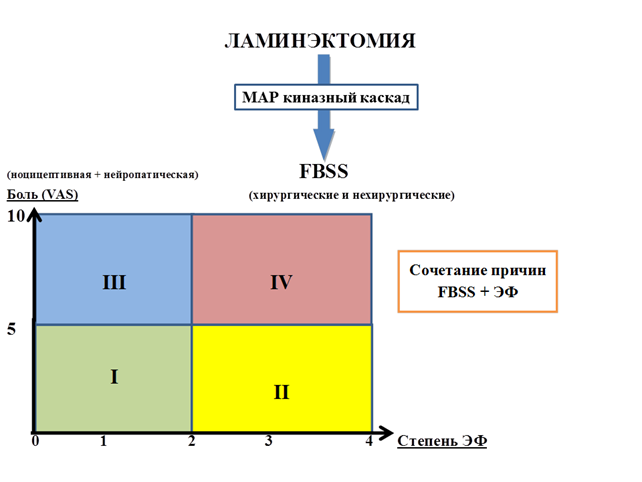
Роль МАР-киназ в репаративном процессе тканей операционной раны при ламинэктомии
Синдром неудачно оперированного позвоночника (FBSS) сопровождает боль и ЭФ, которые не коррелируют друг с другом в послеоперационном периоде, в связи с чем могут формироваться различные группы пациентов, которые отличаются по интенсивности болевого синдрома и степени эпидурального фиброза (ЭФ) от 0 до 4. Болевой синдром сочетает в себе ноцицептивный и нейропатический компоненты боли, которая чаще оценивается только визуальной аналоговой шкалой (VAS) боли. При повторных операциях рубцово-спаечный процесс в эпидуральном пространстве выявляется в 100% случаев и часто сочетается с другими причинами FBSS хирургического и нехирургического профиля, которые можно изменять, воздействуя на МАР-киназный каскад в период репаративного процесса в ране.
Библиографическая ссылка
Животенко А.П., Шурыгина И.А., Кошкарёва З.В., Гольберг О.А. МИТОГЕН-АКТИВИРУЕМЫЕ ПРОТЕИНКИНАЗЫ И ИХ ЗНАЧИМОСТЬ В РЕПАРАТИВНОМ ПРОЦЕССЕ ПРИ ЛАМИНЭКТОМИИ: ФУНДАМЕНТАЛЬНЫЕ АСПЕКТЫ // Современные проблемы науки и образования. 2020. № 4. ;URL: https://science-education.ru/ru/article/view?id=29919 (дата обращения: 15.02.2026).
DOI: https://doi.org/10.17513/spno.29919



