Менингиомы представляют собой наиболее распространенные первичные опухоли центральной нервной системы (ЦНС), на их долю приходится 36% всех первичных опухолей ЦНС. Менингиомы с доброкачественным течением и медленным ростом наиболее распространены [1]. Этот тип менингиом относится к менингиомам Grade I в соответствии с классификацией ВОЗ, при этом наиболее часто встречаются четыре гистологических варианта: менинготелиоматозные, фибробластические, переходные (смешанные) и псаммоматозные менингиомы [2]. Менее распространены более злокачественные варианты менингиом, которым присвоен Grade II в соответствии с классификацией ВОЗ, при этом чаще всего среди гистологических подтипов встречается атипическая менингиома. Менингиомы Grade III по классификации ВОЗ встречаются ещё реже и наиболее часто гистологически относятся к разряду анапластических менингиом. [2]. Несмотря на относительно благоприятное течение и прогноз менингиом Grade I при радикальном хирургическом удалении опухоли, 20–25% рецидивируют, подвергаясь в некоторых случаях малигнизации с переходом в атипическую, а иногда и анапластическую менингиому [3].
Определение степени злокачественности менингиом по критериям классификации ВОЗ играет важную роль в дальнейшей тактике лечения пациента [4]. Современные диагностические критерии основаны почти исключительно на гистологических параметрах, таких как количество митозов, наличие повышенной плотности клеточного слоя, увеличение ядерно-цитоплазматического соотношения, наличие некроза или инвазии опухоли в ткань мозга [2; 5]. Такой диагностический подход ненадежен и требует дальнейшего совершенствования, поскольку большинство представленных критериев не обладают высокой степенью чувствительности.
Для повышения точности диагностического процесса, а также для получения новых данных, которые могут сыграть основополагающую роль в разработке и применении новых терапевтических подходов, все больше внимания уделяется молекулярным свойствам опухолей, в том числе опухолей ЦНС. Во многих случаях молекулярные маркеры становятся наиболее важными прогностическими факторами, влияющими на все аспекты ведения пациентов [6]. Однако в случае менингиом молекулярный анализ все еще имеет ограниченную применимость. Наиболее частым молекулярным событием при менингиомах является мутация гена NF2, которая может быть как врожденной, так и приобретенной [7-9]. Также в отдельных узких гистологических видах менингиом различной степени злокачественности могут выявляться мутации генов SMARCB1, KLF4, TRAF7, SMO, AKT1, SMARCE1 и мутации промотора гена TERT [7; 10; 11]. Однако относительно низкая распространенность этих молекулярных событий, а также невысокая прогностическая ценность большинства описанных факторов не позволяют использовать их в качестве надежного диагностического инструмента [10; 11]. В то же время одним из важных аспектов современного понимания канцерогенеза является оценка не только межопухолевой, но и внутриопухолевой молекулярной гетерогенности. Для этой цели исследуется распределение популяций клеток внутри ткани опухоли, различающихся по своим молекулярным свойствам и играющих различную роль в прогрессировании заболевания. Такой подход позволяет более глубоко выявлять особенности патогенеза новообразований и более точно охарактеризовать молекулярные свойства опухоли [12-14]. Точная оценка характеристик распределения популяций клеток в каждой опухоли может быть важным диагностическим инструментом.
Таким образом, анализ клеточной внутриопухолевой гетерогенности менингиом с выделением клеточных популяций с различными молекулярными свойствами может быть очень перспективным направлением. В этом случае наиболее эффективным способом решения этой проблемы может стать использование современных методов компьютерного анализа больших данных. Такой пул данных может быть сформирован в результате оценки активности экспрессии наиболее важных маркеров, которые отражают функциональное состояние клеток, то есть параметры «динамического» характера, а не только изменения «статического» характера, в частности мутационные изменения. Такая комбинация данных, полученных в отношении различных популяций клеток, позволит более полно охарактеризовать весь «многогранный» профиль молекулярных изменений, которые имеют решающее значение для функционирования опухолевых клеток. Решение этих вопросов позволит качественно улучшить процесс диагностики и сформировать персонализированные высокотехнологичные подходы к диагностике и лечению менингиом с учетом особенностей их индивидуальных клеточных популяций и молекулярных свойств.
Целью данного исследования стал анализ клеточной гетерогенности менингиом различной степени злокачественности на основе оценки активности экспрессии наиболее важных молекулярных факторов в клетках, отражающих состояние метаболизма, а также пролиферативных и апоптотических процессов. С этой целью мы изучили активность экспрессии пролиферативного маркера Ki-67, маркеров апоптозного каскада каспазы 9, а также каспазы 3, маркера активности цикла Кребса сукцинил-КоА-синтетазы и маркера гипоксических изменений HIF-1α в различных гистологических типах менингиом, в частности в менинготелиоматозных, фибробластических, переходных, псаммоматозных, атипических и анапластических менингиомах. Полученные данные были использованы для проведения кластерного анализа и выделения кластеров клеток в каждом исследуемом образце менингиомы. Далее мы охарактеризовали распределение кластеров клеток в менингиомах различного гистологического типа и различной степени злокачественности и провели сравнительный анализ данного распределения.
Материал и методы исследования
Общая характеристика исследования
В рамках ретроспективного исследования были сформированы шесть групп менингиом, при этом ключевым группирующим фактором стал гистологический диагноз: менинготелиоматозные менингиомы, фибробластические менингиомы, переходные менингиомы, псаммоматозные менингиомы, атипические менингиомы и анапластические менингиомы. В состав каждой из групп были включены по 30 образцов опухолей от пациентов с подтвержденным гистопатологическим диагнозом по критериям классификации ВОЗ, которые прошли хирургическое лечение в ФГАУ «НМИЦ нейрохирургии имени акад. Н.Н. Бурденко» в 2012–2015 годах. Для всех пациентов во всех трех группах были соблюдены следующие критерии включения: отсутствие предшествующего лечения менингиомы до первой операции; отсутствие других онкологических заболеваний, кроме менингиомы; наличие опухолевого материала, фиксированного в парафиновых блоках, пригодного для иммуногистохимических исследований. Средний возраст пациентов в исследуемой когорте составил 64.38±2.86 года. Соотношение мужчин и женщин составило 41.11%:58.89%.
Иммуногистохимическое исследование
Срезы толщиной 3 микрометра изготавливали из парафиновых блоков с фиксированными в них образцами опухоли, депарафинировали ксилолом и повторно гидратировали с помощью различных концентраций этанола, срезы сушили при 45 °С. Затем срезы последовательно инкубировали с кроличьими моноклональными антителами против человеческого антигена Ki-67 (CONFIRM anti-Ki67, Roche-Ventana, США), кроличьими моноклональными антителами против человеческого антигена каспазы 9 (SAB3500405, Sigma-Aldrich, США), кроличьими моноклональными антителами против человеческого антигена каспазы 3 (C7729, Sigma-Aldrich, США), кроличьими моноклональными антителами против человеческого антигена сукцинил-КоА-синтетазы (SAB2700343, Sigma-Aldrich, США), кроличьими моноклональными антителами против человеческого антигена HIF-1α (H6536, Sigma-Aldrich, USA).
Первичный анализ изображений
Далее все препараты были оцифрованы с использованием сканера Aperio 3T (Leica Biosystems, GmbH). Полученные изображения для всех маркеров (Ki-67, каспаза 9, каспаза 3, сукцинил-КоА-синтетазы, HIF-1α) в формате ScanScope Virtual Slides (SVS) сопоставлялись между собой с максимальной точностью по координатным данным для получения сложных «многослойных» изображений с помощью программного обеспечения Aperio ImageScope (Leica Biosystems, GmbH), ImageJ (Национальный институт здравоохранения, США) и QuPath (Университет Эдинбурга, Великобритания). Кроме того, все сложные изображения подвергались медианной фильтрации для эффективного удаления шума при сохранении важных деталей для последующего распознавания с использованием программного обеспечения ImageJ, Adobe Photoshop (Adobe Systems, США) и QuPath. Затем для всех комплексных изображений проводилось нерезкое маскирование с использованием программного обеспечения Aperio ImageScope, ImageJ и QuPath, что позволило добиться эффекта большей резкости за счет увеличения контрастности тональных переходов. Затем на полученных изображениях с использованием программного обеспечения, описанного выше, полуавтоматическим способом были выделены клетки и ядра клеток, а также положительные метки для всех пяти исследованных маркеров: программный алгоритм контролировался двумя операторами.
После этого был выполнен кластерный анализ комплексных изображений с использованием программного обеспечения Matlab (The MathWorks, США) и SPSS Statistics 23 (IBM, США). Для этих целей использовался метод k-средних. В качестве исходных данных для кластеризации для каждой клетки на «многослойных» изображениях определялись координатная позиция клетки, наличие или отсутствие иммуногистохимических меток в клетке или ее ядре для всех пяти маркеров, значения цветового индекса меток для каждого из пяти маркеров в соответствии с эталонной моделью CIE XYZ (при отсутствии метки это значение принималось равным 0). Цветовые индексы рассчитывались и интерпретировались по методике, разработанной и описанной нами ранее [15]. Клетки были подвергнуты кластерному анализу с выделением групп клеток, образующих повторяющиеся скопления, которые мы назвали кластерами клеток. Для каждой опухоли кластеризация проводилась отдельно. Затем рассчитывался процент клеток, входящих в состав каждого кластера, от общего количества опухолевых клеток.
Вторичный анализ изображений
Затем был проведен вторичный анализ изображений, целью которого было рассчитать активность экспрессии изученных маркеров в каждом выбранном кластере во всех срезах. Для этого полуавтоматическим способом на основе ранее полученных данных о местонахождении и степени цветности иммуногистохимических меток в каждом выбранном кластере были рассчитаны следующие параметры: индекс мечения Ki-67 (ИМ Ki-67) – процент клеток с положительной экспрессией маркера Ki-67; активность экспрессии каспазы 9 (АЭ Cas9), каспазы 3 (АЭ Cas3), сукцинил-КоА-синтетазы (АЭ СКоАС) и HIF-1α (АЭ HIF-1α) – полуколичественная оценка активности экспрессии по принципу метода histoscore, при котором процент клеток со слабо положительным окрашиванием (низкая интенсивность экспрессии) умножали на единицу, процент клеток с умеренно положительным окрашиванием (средняя интенсивность экспрессии) умножали на два, и, наконец, процент клеток с выраженно положительным окрашиванием (высокая интенсивность экспрессии) умножался на три, после чего результаты суммировались.
Вторичный кластерный анализ
Данные, полученные при подсчете ИМ Ki-67, АЭ Cas9, АЭ Cas3, АЭ СКоАС и АЭ HIF-1α в каждом кластере, были использованы для вторичного кластерного анализа, в котором кластеры, выделенные в опухолевой ткани различных пациентов, были классифицированы и объединены в более крупные категории – типы кластеров (ТК). Для кластерного анализа использовался метод k-средних.
Статистический анализ
Для проведения статистического анализа применялось программное обеспечение Matlab и SPSS Statistics 23.0. Как указывалось выше, кластерный анализ проводился по методу k-средних. В рамках предварительного анализа, который предшествовал первичному и вторичному кластерному анализу, число потенциальных кластеров было оценено с использованием байесовского информационного критерия. Далее число кластеров, полученных в предварительном анализе, использовалось в качестве начального значения для кластеризации методом k-средних.
Результаты исследования и их обсуждение
Клеточные кластеры и ТК в менингиомах различных гистологических типов
Мы проанализировали активность экспрессии Ki-67, каспазы 9, каспазы 3, сукцинил-КоА-синтетазы и HIF-1α в ткани менингиом различных гистологических типов и разных степеней злокачественности, сравнив данные для всех маркеров в одном комплексном «многослойном» изображении для каждого пациента. Это позволило нам одновременно определить активность экспрессии всех пяти маркеров в одной опухолевой клетке. В результате кластерного анализа, основанного на характере распределения активности экспрессии всех маркеров, с учетом взаиморасположения клеток и их общего положения в координатной плоскости, во всех образцах опухолей были выделены клеточные кластеры. Во всех случаях кластеры хорошо разделялись в соответствии с байесовским информационным критерием. В большинстве менингиом (75.56%) были выделены два кластера, в других случаях (24.44%) были определены три клеточных кластера. В результате кластерного анализа полученных первичных кластеров было идентифицировано 8 ТК, которым были присвоены числовые имена – от типа 1 до типа 8, при этом увеличение номера сопровождается последовательным увеличением значений ИМ Ki-67, АЭ СКоАС, АЭ HIF-1α, а также медленным снижением АЭ Cas9 и АЭ Cas3 (табл.).
Характеристика типов клеточных кластеров в менингиомах
|
Типы кластеров |
ИМ Ki-67, % |
АЭ Cas9, % |
АЭ Cas3, % |
АЭ СКоАС, % |
АЭ HIF-1α, % |
|
1 тип кластеров |
0.88±0.70 |
26.24±2.54 |
28.21±5.73 |
44.58±6.44 |
1.64±0.85 |
|
2 тип кластеров |
4.68±0.48 |
16.46±4.22 |
18.74±2.81 |
56.48±8.41 |
6.26±2.35 |
|
3 тип кластеров |
9.84±0.68 |
14.44±2.44 |
16.44±2.57 |
68.46±6.43 |
16.16±4.72 |
|
4 тип кластеров |
12.28±2.76 |
10.48±4.50 |
12.38±2.55 |
72.26±8.71 |
26.25±6.44 |
|
5 тип кластеров |
16.43±4.94 |
8.75±4.62 |
12.36±2.48 |
74.37±4.32 |
32.34±6.28 |
|
6 тип кластеров |
21.72±4.38 |
8.73±2.22 |
8.28±2.32 |
78.30±6.55 |
32.87±4.42 |
|
7 тип кластеров |
37.68±4.84 |
6.14±2.48 |
6.44±1.72 |
78.26±6.32 |
35.65±4.76 |
|
8 тип кластеров |
70.82±8.56 |
6.64±2.76 |
6.26±2.78 |
82.46±4.48 |
35.58±4.58 |
Примечания. Для каждого типа кластера приведены средний индекс мечения Ki-67 (ИМ Ki-67), средняя активность экспрессии каспазы 9 (АЭ Cas9), каспазы 3 (АЭ Cas3), сукцинил-КоА-синтетазы (АЭ СКоАС), HIF-1α (АЭ HIF-1α).
Распределение кластеров и ТК в менингиомах различных гистологических типов
При проведении кластерного анализа было выявлено, что большинство менингиом разделяются на два пространственно разделенных кластера (79.44%), в то время как в меньшей части менингиом наблюдалось три кластера (20.56%). При этом сопоставление типичных профилей ТК в менингиомах позволило определить наиболее типичные комбинации ТК по качественному и количественному составу для каждого гистологического типа опухоли.
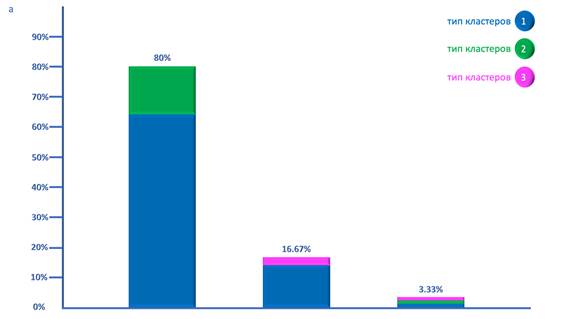
В менинготелиоматозных менингиомах было показано наличие трех вариантов комбинаций ТК. Наиболее часто, в 80% случаев, встречалась комбинация 1ТК и 2ТК, при этом в количественном отношении 1ТК значительно преобладал над 2 ТК и содержал существенно большее количество клеток в своем составе практически во всех случаях в данной группе менингиом. В 16.67% случаев наблюдалась комбинация 1ТК и 3ТК при значительном количественном преобладании 1ТК. Также в 3.33% случаев обнаруживалось сочетание трех ТК – 1ТК, 2ТК и 3ТК, причем 1ТК опять количественно преобладал (рис. а).
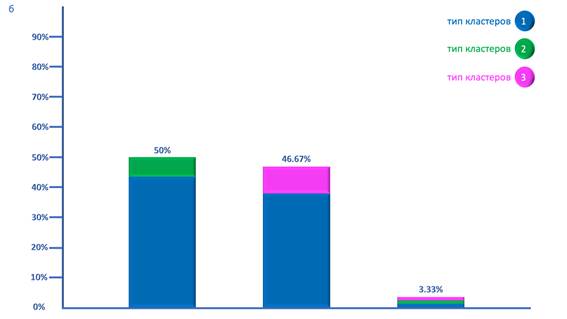
Для переходных менингиом было характерно более равновесное распределение комбинаций ТК. Так, наиболее часто в данной группе опухолей встречалась комбинация 1ТК и 2ТК, выявляемая в 50% случаев. Однако в 46.67% случаев наблюдалось наличие сочетания 1ТК и 3ТК. В то же время подобно менинготелиоматозным менингиомам в 3.33% случаев обнаруживалась комбинация 1ТК, 2ТК и 3ТК. При этом 1ТК также во всех комбинациях значительно преобладал в количественном отношении над всеми остальными ТК (рис. б).
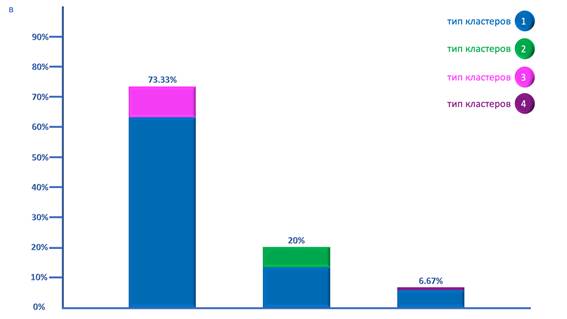
Фибробластические менингиомы характеризовались преимущественно комбинацией 1ТК и 3ТК кластеров, встречавшейся в 73.33% случаев. Стоит заметить также, что и здесь 1ТК количественно преобладал (78.44±4.24% клеток) над минорным 3ТК. В 20% случаев наблюдалось наличие сочетания 1ТК и 2ТК, а ещё в 6.67% случаев выявлялось сочетание 1ТК, 2ТК и 3ТК кластеров (рис. в).
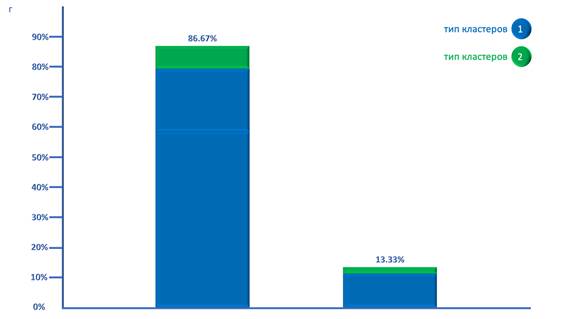
В псаммоматозных менингиомах выявлялась более монотонная картина распределения ТК. Наиболее частым вариантом комбинаций кластеров была комбинация трех кластеров, среди которых два принадлежали 1ТК, а ещё один 2ТК. Кроме того, в 13.33% случаев наблюдалось сочетание 1ТК и 2ТК кластеров (рис. г).
Атипические менингиомы выделялись существенной степенью гетерогенности в распределении ТК. В частности, наиболее распространенным вариантом распределения клеточных кластеров было сочетание 1ТК и 3ТК, выявленное в 30% случаев и напоминающее таковое в фибробластических менингиомах по качественным параметрам, в количественном отношении отличалось – в данном случае 1ТК также по большей части преобладал количественно, но преобладание это было существенно менее выраженным и составляло в среднем 54.26±2.32% клеток. Далее по частоте встречаемости следовала комбинация 1ТК и 4ТК, составляющая 26.67% случаев. В данной ситуации также наблюдалось более ровное распределение типов кластеров в количественном отношении по сравнению с аналогичной по качественному параметру сочетания в фибробластических менингиомах. Следующей по частоте встречаемости стала комбинация 2ТК и 4ТК, выявленная в 23.33% случаев. Кроме того, в 13.33% случаев наблюдалось наличие сочетания 2ТК и 6ТК. Также в 6.67% случаев обнаруживалась комбинация 2ТК, 5ТК и 6ТК (рис. д).
В случае анапластических менингиом наблюдалось не меньшее разнообразие вариантов комбинаций ТК. Наиболее часто выявлялось сочетание 6ТК и 8ТК, встречавшееся в 36.66% случаев. Кроме того, в 23.32% случаев наблюдалась комбинация 2ТК, 6ТК и 7ТК. В 16.67% случаев выявлялось наличие сочетания 6ТК и 7ТК, при этом также в 16.67% случаев обнаруживалось сочетание 1ТК и 6ТК. Наконец, в 6.67% случаев наблюдалось сочетание 7ТК и 8ТК (рис. ж).
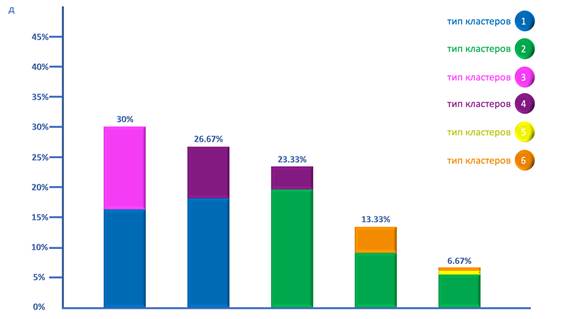
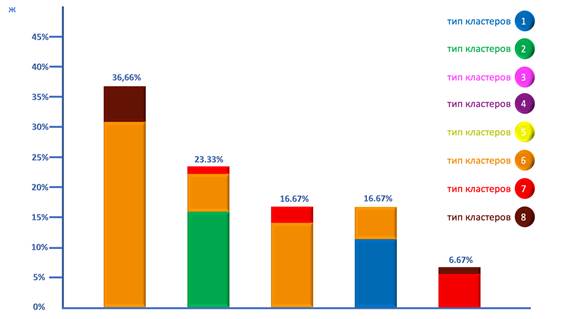
Возможные комбинации типов кластеров в различных гистологических вариантах менингиомы: а) менинготелиоматозная менингиома, б) переходная менингиома, в) фибробластическая менингиома, г) псаммоматозная менингиома, д) атипическая менингиома, ж) анапластическая менингиома
Примечание. Каждый столбец составной и обозначает одну возможную комбинацию типов кластеров с соответствующими цветовыми обозначениями, расшифрованными на рисунке. Высота столбца соответствует частоте встречаемости данной комбинации типов кластеров среди менингиом данного гистологического типа, точное значение частоты встречаемости приведено над каждым столбцом. Соотношение секторов различного цвета внутри столбцов отражает среднее соотношение количественного содержания клеток данных типов кластеров в данной комбинации.
Обсуждение
Результаты нашего исследования можно рассматривать как в практической, так и в фундаментальной плоскости. С практической точки зрения, выделение по функциональному принципу клеточных кластеров в пределах одной менингиомы делает возможным получить более полную картину функционального состояния опухолевой ткани и внутриопухолевой молекулярной неоднородности. Исходя из этой картины для менингиом различной степени злокачественности, можно прийти к следующим выводам. Для подавляющего большинства менингиом, определенных как менингиомы Grade I и II согласно классификации ВОЗ, преобладающими типами кластеров являются 1ТК или 2ТК. При этом можно заметить, что, как правило, ТК с наибольшим количеством опухолевых клеток в своем составе и наибольшей занимаемой площадью опухолевой ткани имеет самую низкую пролиферативную, метаболическую и антигипоксическую активность и являются наиболее консервативными среди всех других типов. Данные ТК, по-видимому, не определяют потенциальную биологическую агрессивность опухоли, но в то же время формируют ее гистологическую и клеточную основу. При этом второй или реже третий по величине тип кластеров в менингиомах Grade I и II определяет злокачественный потенциал опухоли. Для опухолей Grade I наиболее типичным минорным кластером был 2ТК, однако в переходных (смешанных) менингиомах и фибробластических менингиомах также часто встречался и 3ТК, но его количественное содержание было достаточно низким. В то же время для менингиом Grade II вторыми наиболее распространенными ТК были 3ТК с практически паритетным содержанием клеток в сравнении с преобладающим 1ТК, а также 4ТК, обладающие более высокой пролиферативной, метаболической, антигипоксической активностью и более низкой апоптозной активностью.
Таким образом, в фундаментальном смысле полученные данные демонстрируют наличие трех потенциально возможных функциональных ролей для изученных типов клеточных популяций. Первая роль заключается в создании консервативного пула клеток, который может служить источником сохранения молекулярно-клеточной идентичности опухоли и её репопуляции, пополняя более активные пулы клеток. При этом стоит заметить, что в некоторых гистологических типах менингиом, в частности в анапластических менингиомах, данный пул сам по себе может быть весьма активен в сравнении с доброкачественными вариантами менингиом. Вторая функциональная роль состоит в обеспечении прогрессирования, роста и распространения опухоли, фактически популяция опухолевых клеток, обеспечивающая реализацию данной роли, является драйверной. Наконец, третья клеточная популяция, которая выявляется лишь в некоторых случаях, выполняет роль переходной, транзитной от первого состояния ко второму, при этом внутренние и внешние условия существования опухоли по различным причинам способствовали сохранению данной популяции, что может отражать более сложную стадийность патогенетической цепочки в подобных опухолях.
В практическом отношении полученные результаты предлагают новый подход к диагностике менингиом, основанный на сложной кластерной оценке молекулярных свойств клеток. Ориентируясь на наиболее типичные варианты распределения ТК в ткани опухоли, можно с высокой долей вероятности предположить её истинную гистологическую природу. Данный подход может послужить основой для создания нового диагностического алгоритма, однако, несомненно, требуются дополнительные исследования для выявления самостоятельной прогностической значимости предложенной методики.
Заключение
Таким образом, выделение клеточных кластеров на основе их функциональной активности позволило глубже изучить особенности развития опухоли. Оценка степени злокачественности менингиомы с использованием исключительно гистопатологического подхода оставляет без внимания ряд свойств и внутренних особенностей опухоли, которые скрыты за пределами разрешения простых гистопатологических методов исследования. Под покровом относительно однородной морфологической картины в клеточных кластерах сосуществуют клеточные популяции, различающиеся по своим функциональным свойствам. Стоит отметить, что функциональные изменения, без сомнения, являются как следствием, так и проявлением соответствующих молекулярных изменений, происходящих на генетическом, эпигенетическом, транскриптомном, трансляционном уровнях. Однако современные средства оценки молекулярно-генетического профиля опухоли чаще всего выявляют изменения и модификации, которые происходят на уровне целостной опухоли, без учета внутриопухолевой молекулярной гетерогенности. По-видимому, это является одной из причин низкой применимости этих методов в современной рутинной практике при диагностике менингиом. Наше исследование демонстрирует важность более тонкого подхода для идентификации молекулярных свойств опухоли с более тонкой оценкой характеристик внутриопухолевой гетерогенности.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-29-01214 мк.
Библиографическая ссылка
Никитин П.В., Галстян С.А., Мусина Г.Р., Зубова И.В., Хохлова Е.А. РАСПРЕДЕЛЕНИЕ КЛЕТОЧНЫХ КЛАСТЕРОВ В РАЗЛИЧНЫХ ГИСТОЛОГИЧЕСКИХ ПОДТИПАХ МЕНИНГИОМ // Современные проблемы науки и образования. 2020. № 2. ;URL: https://science-education.ru/ru/article/view?id=29683 (дата обращения: 05.01.2026).
DOI: https://doi.org/10.17513/spno.29683



