Распространенность метаболического синдрома (МС) в настоящее время принимает глобальные размеры и имеет также этнические и гендерные различия, что указывает на влияние генетических факторов в этиологии данного заболевания [1]. Проведенные многочисленные исследования позволяют рассмотреть генетическую обусловленность мультифакториально развивающихся заболеваний, таких как ожирение, атеросклероз, нарушение толерантности к глюкозе и сахарный диабет (СД), артериальная гипертензия (АГ), дислипидемии, которые являются компонентами метаболического синдрома (МС) [2]. Однако рост частоты МС во всех социально-демографических группах еще раз доказывает влияние экологических факторов [3, 4]. Изменения в химии ДНК часто изучаются на клетках или тканях, несущих метаболическую нагрузку. Экспериментально доказано, что эпигенетические факторы наследуются и могут передаваться из поколения в поколение [1, 5]. Экспериментально при поиске различных биомоделей МС доказано, что метаболический синдром является полигенной патологией, при которой взаимодействие генов может добавлять и (или) усугублять метаболические нарушения [6].
Цель исследования – изучить сочетанное влияние генетических ассоциаций на развитие метаболических нарушений среди молодых жителей Севера.
Материалы и методы исследования
В ходе проспективного когортного исследования из 882 пациентов с МС были выделены следующие группы: городское население – 245 человек (146 женщин и 99 мужчин), сельское население – 354 человека (108 мужчин и 246 женщин), коренное население Севера – 283 ханты, из них 72 мужчины и 211 женщин [7]. У всех пациентов получено информированное согласие. Определением МС является наличие трех из пяти метаболических нарушений: повышенная окружность талии (ОТ) (в норме у женщин 80 см, у мужчин 94 см), уровень АД >140 и 90 мм рт. ст., повышение уровня триглицеридов (≥1,7 ммоль/л), снижение уровня липопротеидов высокой плотности (ХС ЛПВП) (3,0 ммоль/л), нарушенная гликемия натощак (уровень глюкозы плазмы натощак ≥6,1) [8]. Молекулярно-генетическое исследование выполнено в НИИТПМ – филиале ФГБНУ «Федеральный исследовательский центр ИЦиГ СО РАН». Геномную ДНК выделяли из венозной крови методом фенол-хлороформной экстракции. Полиморфизм генов тестировали с помощью полимеразной цепной реакции с полиморфизмом длин рестрикционных фрагментов (ПЦР с ПДРФ) [7]. В таблице 1 представлена информация о локализации, кодируемом белке и функции исследованных однонуклеотидных полиморфизмов генов.
Таблица 1
Информация по изученным однонуклеотидным полиморфизмам генов
|
Однонуклеотидный полиморфизм (SNP) гена |
Локализация в хромосоме |
Кодируемый белок или гены |
Функция |
|
rs1378942 CSK |
15q24.1 |
Рядом ген CYP1A2, кодирует изофермент цитохром P450-зависимой монооксигеназы |
Кодирует различные семейства тирозинкиназ, фосфорилирует С-концевой участок киназ Src-семейства, играющих роль в регуляции клеточного роста и дифференцировке нормальных клеток [9] |
|
rs1801133 (С677Т) MTHFR |
1p36.3 |
Метилентетрагидрофолатредуктаза |
Связан с нарушениями обмена гомоцистеина, оказывающего атерогенное действие (ингибирование роста эндотелиальных клеток, прооксидантное воздействие, митогенное влияние на гладкомышечные клетки, стимулирование аккумуляции белков в атероме и биосинтез коллагена) [10] |
|
ITGA2B |
17q21.32 |
Мембранный белок, димерный интегрин, состоящий из альфа цепи αIIb и бета цепи β3 |
Экспрессируется на поверхности тромбоцитов, являясь рецептором фибриногена [11] |
|
rs7903146 TCF7L2 |
10q25.3 |
T-клеточный транскрипционный фактор 4 |
Регуляция секреции проглюкагона, влияющего на секрецию инсулина и на созревание ß-клеток поджелудочной железы, из стволовых клеток [12] |
|
rs1799752
АСЕ |
17q23 |
Ангиотензин-превращающий фермент (АПФ) |
Регулирует кровяное давления и баланс электролитов, катализирует расщепление неактивного ангиотензина I до активного ангиотензина II [13] |
Все этапы предобработки и анализа данных проводились с использованием среды для статистических вычислений R 3.5.3 (R Foundation for Statistical Computing) [14]. Описательные статистики для категориальных переменных представлены в процентах, для количественных переменных – в виде медианы (1-й и 3-й квартили выборочного распределения).
Для выявления отклонения наблюдаемых частот генотипов от теоретических частот, определяемых равновесием Харди–Вайнберга, использовался тест χ2 для когорты в целом и групп участников (городские, сельские жители и ханты), отклонения считали статистически значимыми при p<0,05. Для анализа совместного распределения частот пар генетических маркеров использовалась goodness-of-fit стратегия (тест χ2) для тестирования гипотезы о равновесном сцеплении генетических маркеров, нулевая гипотеза отклонялась при p<0,05. В качестве оценок размера эффекта применялись отношения шансов с соответствующими 95%-ными доверительными интервалами. При выявлении значимых предикторов нами дополнительно исследовались взаимодействия данного гена с другими изучаемыми генами, для определения статистической значимости взаимодействия применялся тест отношения правдоподобий, взаимодействие расценивалось как статистически значимое при p<0,05.
Результаты исследования и их обсуждение
В таблице 2 представлены эмпирические распределения изучаемых аллелей и генотипов в когорте участников исследования в целом и в группах.
Таблица 2
Обобщенная характеристика эмпирических распределений переменных, включенных в обобщенные линейные модели
|
|
Когорта |
Город |
Село |
Ханты |
p-значение* |
|
|
Изучаемые полиморфные локусы |
||||||
|
ACE (rs1799752) |
DD |
190 (21,6%) |
63 (22,7%) |
69 (20,5%) |
58 (21,9%) |
0,9132 |
|
ID |
453 (51,5%) |
138 (49,8%) |
175 (51,9%) |
140 (52,8%) |
||
|
II |
236 (26,8%) |
76 (27,4%) |
93 (27,6%) |
67 (25,3%) |
||
|
D |
833 (47,4%) |
264 (47,7%) |
313 (46,4%) |
256 (48,3%) |
0,8039 |
|
|
I |
925 (52,6%) |
290 (52,3%) |
361 (53,6%) |
274 (51,7%) |
||
|
TCF7L2 (rs7903146) |
TT |
52 (5,9%) |
20 (7,2%) |
18 (5,3%) |
14 (5,3%) |
0,8099 |
|
CT |
285 (32,3%) |
90 (32,5%) |
112 (33,0%) |
83 (31,2%) |
||
|
CC |
545 (61,8%) |
167 (60,3%) |
209 (61,7%) |
169 (63,5%) |
||
|
C |
1375(77,9%) |
424 (76,5%) |
530 (78,2%) |
421 (79,1%) |
0,5769 |
|
|
T |
389 (22,1%) |
130 (23,5%) |
148 (21,8%) |
111 (20,9%) |
||
|
ITGA2B
|
DD |
130 (14,7%) |
44 (15,9%) |
53 (15,6%) |
33 (12,4%) |
0,7597 |
|
ID |
397 (45,0%) |
121 (43,7%) |
154 (45,4%) |
122 (45,9%) |
||
|
II |
355 (40,2%) |
112 (40,4%) |
132 (38,9%) |
111 (41,7%) |
||
|
D |
657 (37,2%) |
209 (37,7%) |
260 (38,3%) |
188 (35,3%) |
0,5392 |
|
|
I |
1107 (62,8%) |
345 (62,3%) |
418 (61,7%) |
344 (64,7%) |
||
|
CSK (rs1378942) |
GG |
174 (19,8%) |
63 (22,8%) |
58 (17,2%) |
53 (19,9%) |
0,1985 |
|
GT |
446 (50,7%) |
134 (48,6%) |
186 (55,2%) |
126 (47,4%) |
||
|
TT |
259 (29,5%) |
79 (28,6%) |
93 (27,6%) |
87 (32,7%) |
||
|
G |
794 (45,2%) |
260 (47,1%) |
302 (44,8%) |
232 (43,6%) |
0,4989 |
|
|
T |
964 (54,8%) |
292 (52,9%) |
372 (55,2%) |
300 (56,4%) |
||
|
MTHFR (rs1801133) |
TT |
88 (10,0%) |
30 (10,8%) |
33 (9,7%) |
25 (9,4%) |
0,8588 |
|
CT |
328 (37,2%) |
98 (35,4%) |
133 (39,2%) |
97 (36,5%) |
||
|
CC |
466 (52,8%) |
149 (53,8%) |
173 (51,0%) |
144 (54,1%) |
||
|
C |
1260(71,4%) |
396 (71,5%) |
479 (70,6%) |
385 (72,4%) |
0,8054 |
|
|
T |
504 (28,6%) |
158 (28,5%) |
199 (29,4%) |
147 (27,6%) |
||
Примечание: p – значения были получены с использованием теста χ2 Пирсона для тестирования независимости распределения генотипов от принадлежности к группе; для тестирования различий групп по гендерному составу также использовался тест χ2 Пирсона; для количественных переменных применялся тест Краскела–Уоллиса.
При анализе распределения частот генотипов и аллелей полиморфных локусов исследуемых генов среди молодых жителей Севера нами не было выявлено статистически значимых различий между группами. Наиболее распространены в когорте были мутантные аллели T rs1378942 гена CSK (54,8%), D гена ITGA2B (37,2%), D rs1799752 гена ACE (47,4%). При исследовании соответствия наблюдаемых частот генотипов теоретическим частотам, определяемым равновесием Харди–Вайнберга, нами не было определено значимых отклонений для большинства полиморфных локусов в когорте в целом и в группах участников. Статистически значимое отклонение частоты генотипов выявлено в когорте (p=0,0104) и в группе городских жителей (0,0278) для полиморфного локуса гена участников MTHFR, а также для исследуемого локуса гена CSK в группе сельских жителей (p=0,0370). Результаты анализа равновесия представлены в таблице 3.
Таблица 3
P-значения для теоретических и наблюдаемых частот с использованием теста χ2
|
|
Когорта |
Город |
Село |
Ханты |
|
ACE |
0,3438 |
1,0000 |
0,4453 |
0,3901 |
|
TCF7L2 |
0,0778 |
0,1306 |
0,5273 |
0,3559 |
|
ITGA2B |
0,2800 |
0,2505 |
0,4909 |
1,0000 |
|
CSK |
0,4962 |
0,7170 |
0,0370 |
0,5354 |
|
MTHFR |
0,0104 |
0,0278 |
0,3586 |
0,1669 |
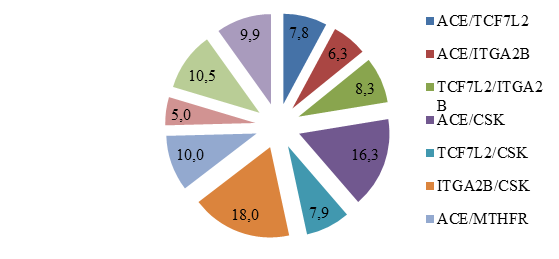
Рис. 1. Распределение частот пар генотипов среди обследованных пациентов с МС в когорте
На рисунке 1 представлено распределение частот пар генотипов среди всех обследованных пациентов с МС. Наиболее частые сочетания были выявлены при комбинации ITGA2B/CSK в 18,0% случаев, ACE/CSK у 16,3% пациентов с МС. Нами было определено, что изучаемые полиморфные локусы генов ACE и CSK (p=0,0053) встречались часто среди когорты. Выявленная ассоциация может представлять интерес с точки зрения механизма, поскольку гены расположены на разных хромосомах (17q23.3 и 15q24.1 соответственно), однако ввиду небольшого размера (D = –0,0166) данная ассоциация, вероятно, не является клинически значимой (табл. 4).
Таблица 4
Результаты анализа совместного распределения частот пар генотипов
|
|
D-статистика |
Статистика χ2 |
P-значение |
|
ACE/TCF7L2 |
–0,0004 |
0,0068 |
0,9343 |
|
ACE/ITGA2B |
–0,0036 |
0,4012 |
0,5265 |
|
TCF7L2/ITGA2B |
–0,0038 |
0,6355 |
0,4254 |
|
ACE/CSK |
–0,0166 |
7,7739 |
0,0053 |
|
TCF7L2/CSK |
0,0015 |
0,0889 |
0,7656 |
|
ITGA2B/CSK |
0,0013 |
0,0490 |
0,8248 |
|
ACE/MTHFR |
0,0019 |
0,1261 |
0,7225 |
|
TCF7L2/MTHFR |
–0,0002 |
0,0027 |
0,9586 |
|
ITGA2B/MTHFR |
0,0115 |
4,8474 |
0,0277 |
|
CSK/MTHFR |
–0,0097 |
3,2429 |
0,0717 |
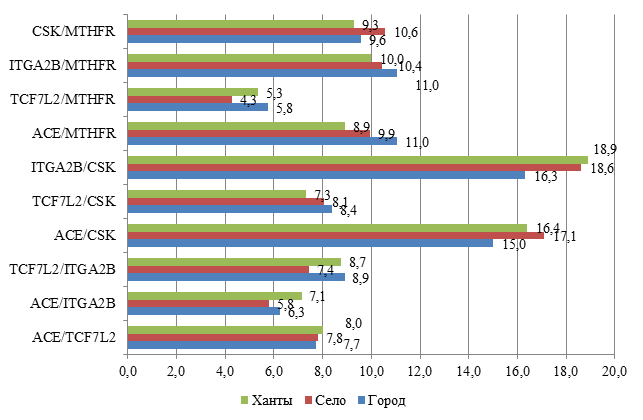
Рис. 2. Распределение частот пар генотипов среди обследованных пациентов города, села и коренных жителей (хантов)
При сравнительном анализе распределения частот среди коренного и некоренного населения в равной степени встречался вариант сочетания пар генотипов ITGA2B/CSK с незначительным преобладанием среди хантов. Вариант сочетания ACE/CSK был распространен среди некоренных жителей села (в 17,1%). В меньшей степени встречалось сочетание TCF7L2/MTHFR среди сельских пациентов с МС (4,3%) (рис. 2).
Изучение генетических факторов, способствующих развитию МС, демонстрирует полигенность данной патологии. Поиск и изучение генетических факторов метаболических нарушений часто оценивают как ассоциацию полиморфизма генов с отдельными компонентами МС, контролирующими адипогенез, липидный и углеводный обмен, участие факторов в развитии артериальной гипертензии. Много работ посвящено исследованиям нарушений одного гена или его полиморфизму. Так, согласно результатам ранее проводившихся исследований ген CSK регулирует через ферменты тирозинкиназ клеточный рост и дифференцировку нормальных клеток. При нарушении экспрессии данного гена происходит увеличение активности sck-тирозинкиназы в клетках-мишенях сердечно-сосудистой системы, почек, эндокринных органов и центральной нервной системы, тем самым потенцируется развитие артериальной гипертензии [9]. Известно, что гены TCF7L2 экспрессируются в жировой ткани и участвуют в Wnt-зависимой регуляции адипогенеза, поддерживающей преадипоциты в недифференцированном состоянии. При снижении или потере TCF7L2 в адипоцитах развивается инсулинорезистентность, при этом адипоциты гипертрофируются, нарушается липолиз, развивается гипертриглицеридемия [12]. При ожирении основным компонентом МС, патогенетическим фактором атеротромбогенеза является гиперактивность тромбоцитов, связанная с повреждением мембран тромбоцитов. Агрегация тромбоцитов происходит благодаря присутствию на поверхности белков-интегринов (рецепторов), в частности гена ITGA2B [11]. Ген АСЕ кодирует ангиотензин-превращающий фермент (АПФ), играющий важную роль в регуляции кровяного давления и баланса электролитов, катализируя расщепление неактивного ангиотензина I до активного ангиотензина II [13]. Однонуклеотидный полиморфизм гена rs1801133 (С677Т) MTHFR связан с нарушениями обмена гомоцистеина, оказывающего атерогенное действие на эндотелиальные клетки, прооксидантное воздействие путем стимуляции аккумуляции белков в атероме и биосинтеза коллагена [10].
Но в настоящее время все больше работ посвящено изучению взаимодействия генов-кандидатов и их совместного влияния на развитие МС. Сочетание полиморфизма ряда генов и определяет генетическую основу МС. Однако мутации генов в различных популяциях будут зависеть от гендерных, возрастных, этнических и средовых причин, увеличивая тем самым число вариантов МС [15]. Предрасположенность к МС чаще проявляется в результате сочетанного эффекта нескольких генов. При исследовании ассоциации генотипов и маркеров МС (увеличение ОТ, артериальная гипертензия, гипертриглицеридемия, гиперхолестеринемия, гипергликемия) в когорте и подгруппах участников были определены эффекты изучаемых полиморфных локусов генов. В результате были выявлены 10 статистически значимых двухлокусных моделей, определяющих предрасположенность к МС в когорте. Во всех парных моделях изучаемые гены присутствуют в равных долях, что свидетельствует об их вкладе в развитие МС. Но варианты изученных генов влияют на клиническое проявление МС неодинаково. Наиболее частое сочетание встречалось в следующих парных вариантах: ITGA2B/ CSK (18,0%) и ACE/CSK (16,3%). Среди коренных жителей и жителей сельской местности сочетание генов ITGA2B/ CSK встречалось в 18,9% и 18,6% соответственно. Встречаемость генотипов ACE/CSK чаще отмечалась среди жителей села (17,1%). Парные полиморфизмы генов TCF7L2/MTHFR и ACE/ITGA2B имели место в меньшей степени как в когорте, так и в этнических группах (рис. 3) – среди 4,3% сельских жителей, 5,3% хантов и 5,8% городского населения.
Заключение
Таким образом, каждый изученный однонуклеотидный полиморфизм пяти генов: ACE, TCF7L2, ITGA2B, CSK, MTHFR – вносит по отдельности вклад в клиническое проявление МС. При анализе взаимодействий генов выявлены чаще встречающиеся статистически значимые двухлокусные варианты ITGA2B/ CSK и ACE/CSK, из которых ген CSK играет существенную роль в развитии МС. Определение генетических детерминант развития МС позволяет своевременно выявлять лиц с повышенным риском метаболических нарушений и проводить профилактические мероприятия, направленные на снижение проявлений метаболического синдрома.
Библиографическая ссылка
Корнеева Е.В., Воевода М.И., Семаев С.Е., Максимов В.Н. РОЛЬ МЕЖГЕННЫХ ВЗАИМОДЕЙСТВИЙ В РАЗВИТИИ МЕТАБОЛИЧЕСКИХ НАРУШЕНИЙ СРЕДИ МОЛОДЫХ ЖИТЕЛЕЙ СЕВЕРА // Современные проблемы науки и образования. 2020. № 2. ;URL: https://science-education.ru/ru/article/view?id=29668 (дата обращения: 18.02.2026).
DOI: https://doi.org/10.17513/spno.29668



