По современным представлениям и данным литературы, единственным радикальным методом лечения цирроза печени (ЦП) является её трансплантация [1-3]. Несмотря на рост числа ортотопических пересадок печени в Российской Федерации, лист ожидания с каждым годом пополняется всё большим количеством пациентов с ЦП [4-6]. Использование альтернативных методик снижения давления в воротной вене, способных продлить предтрансплантационный период, остается актуальным и нацеливает специалистов, занимающихся данной проблемой, на поиск новых способов их выполнения и особенно оптимизации ведения периоперационного периода этой сложнейшей категории пациентов. На сегодняшний день таким вмешательством является операция трансъюгулярного внутрипеченочного портосистемного стент-шунтирования (TIPS/ТИПС) [7-9].
Но в то же самое время, увеличивая предтрансплантационный период, мы сталкиваемся с дисфункцией шунта в виде его стеноза (18-78%), окклюзии (3,1%) или тромбоза (10-15%) [10; 11], зачастую приводящих к повторным кровотечениям из пищеводно-желудочных вариксов. Наше исследование посвящено изучению проблемы профилактики дисфункции шунта – его тромбоза.
Целью работы является улучшение результатов лечения больных с осложненными формами ЦП путем оптимизации мероприятий, направленных на профилактику нарушений проходимости внутрипеченочного портосистемного шунта.
Материалы и методы исследования. Хирургическая клиника Ростовского государственного медицинского университета обладает уникальным опытом выполнения операции TIPS/ТИПС у более 200 больных с ЦП за последние 13 лет. И, конечно же, в последние годы у нас появились пациенты, находящиеся в листе ожидания трансплантации, которым уже выполнили данную операцию в регионе, – так как с 2015 года в ГБУ РО «Ростовская областная клиническая больница» полноценно функционирует Программа трансплантации органов и тканей.
Как известно, показательным и абсолютно объективным методом эффективности выполненного вмешательства является оценка отдалённых результатов лечения. Нами были сформированы две группы исследования, включающие в себя 31 и 30 пациентов, которым было выполнено TIPS/ТИПС без эмболизации гастроэзофагеальных вен. Для формирования сопоставимых по основным показателям групп мы сформировали критерии включения и исключения, основными из которых были: объективные признаки гипокоагуляции по данным обследования свертывающей системы крови, класс В печеночно-клеточной недостаточности, вирусная этиология ЦП, использование стент-графта с PTFE-покрытием, применение теста «Тромбодинамика», а также способа определения риска развития гиперкоагуляции у больных с ПГ цирротического генеза после проведения портосистемного шунтирования (Патент РФ на изобретение №2665118). Разницей в ведении периоперационного периода в I (контрольной) группе наблюдения было назначение лекарственных препаратов согласно стандарту лечения пациентов с ЦП, а больным II (основной) группы наблюдения по результатам теста «Тромбодинамика» при необходимости назначалась корригирующая антикоагулянтная терапия. Срок наблюдения в обеих группах сравнения составил от 6 до 36 месяцев.
Контроль эффективности проведённого лечения осуществляли путем выполнения комплекса неинвазивных методик, включающего в себя клиническую оценку (наличие или отсутствие в послеоперационном периоде пищеводно-желудочных кровотечений), ультразвуковые (УЗ-сканирование в В-режиме и режиме цветовой доплерографии) и лабораторные (коагулограмма и тест «Тромбодинамика») исследования.
Статистическая обработка полученных данных проводилась с использованием пакета лицензированной прикладной программы STATISTIСA for Windows 6.1 (StatSoft Inc., USA). Сбор и первичную обработку данных по полученным в ходе исследований параметрам производили в электронных таблицах лицензионной программы Microsoft Office Excel 2017 (Microsoft, США). Для анализа данных использовались рекомендации, данные Ребровой О.Ю., отражённые в учебном пособии по медицинской статистике.
В качестве меры центральной тенденции при представлении непрерывных данных приводилась медиана (Me). С целью характеристики вариабельности показателей использовались значения квартилей: нижний квартиль – Q1, верхний квартиль – Q3 (Ме [Q1; Q3]). Категориальные показатели представлены частотой (n) и процентами (%). Значимость различий непрерывных данных оценивалась с помощью непараметрического критерия Манна и Уитни. При сравнении связанных групп использовался критерий Вилкоксона. Бинарные данные сравнивали с применением точного критерия Фишера и хи-квадрата. При этом в исследовании был использован общепринятый уровень значимости – p<0,05. Оценка выживаемости и эпизодов пищеводно-желудочных кровотечений в послеоперационном периоде осуществлялась с помощью метода множительных оценок Каплана-Мейера. Оценку связи показателей осуществляли с применением коэффициента корреляции Спирмена, а также Фи-коэффициента для анализа 4-польных таблиц.
Результаты исследования и их обсуждение. Основным клиническим признаком адекватного функционирования внутрипеченочного портосистемного шунта в обеих клинических группах сравнения являлось отсутствие рецидива кровотечения из варикозно расширенных вен пищевода и желудка (ВРВПЖ), так как в случае нарушения его проходимости возникает повышение внутрипортального давления, влекущее за собой сброс крови в область естественных портокавальных анастомозов, являющийся причиной возникновения кровотечения.
В послеоперационном периоде эпизоды кровотечения были зарегистрированы у 5 пациентов I группы: в срок до 3 месяцев – у 1 пациента, до 6 месяцев – у 2 больных и в срок более 1 года – у 2 пациентов. Ни у одного пациента II группы рецидива пищеводно-желудочного кровотечения в послеоперационном периоде за срок наблюдения за больными зарегистрировано не было.
Сравнительная оценка возникших осложнений в виде пищеводно-желудочных кровотечений в сроке до 36 месяцев выполнялась с использованием метода множительных оценок Каплана-Мейера и представлена на рисунке 1.
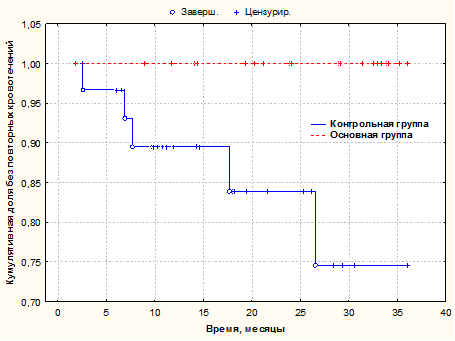
Рис. 1. Оценка рецидивов пищеводно-желудочных кровотечений по Каплану-Майеру для пациентов I и II групп сравнения в течение 36 месяцев.
Статистическая значимость различий между сравниваемыми группами
p=0,020 по критерию Вилкоксона
УЗИ печени, селезенки и сосудов портальной системы выполнялось всем пациентам обеих групп наблюдения после операции в различные сроки (через 3, 6, 12 месяцев и далее один раз в год). К критериям оценки проходимости внутрипеченочного шунта мы относили: регистрацию мощного кровотока по шунту, изменение характера кровотока в воротной вене на гепатопетальный (если ранее он имел гепатофугальный характер), а также уменьшение диаметра воротной вены (табл. 1).
Таблица 1
Результаты сонографического исследования до и после операции в сроке до 36 месяцев
|
Показатель |
Значение нормы по Митькову В.В. (2002) |
I (контрольная) группа, n=31 |
II (основная) группа, n=30 |
p |
||||
|
Медиана (Ме) |
Нижний квартиль (Q1) |
Верхний квартиль (Q3) |
Медиана (Ме) |
Нижний квартиль (Q1) |
Верхний квартиль (Q3) |
|||
|
ДО ОПЕРАЦИИ |
||||||||
|
Диаметр воротной вены, мм |
10,4±2,08 |
15,0 ↑ |
13,0 |
16,0 |
13,6 ↑ |
12,0 |
16,0 |
0,26 |
|
Линейная скорость кровотока воротной вены max., см/с |
23,9±3,3 |
18,0 ↓ |
13,0 |
22,0 |
16,0 ↓ |
13,0 |
21,0 |
0,77 |
|
ПОСЛЕ ОПЕРАЦИИ |
||||||||
|
Диаметр воротной вены, мм |
10,4±2,08 |
11,32 |
9,0 |
12,0 |
11,67 |
10,0 |
14,0 |
00,26 |
|
Линейная скорость кровотока воротной вены max., см/с |
23,9±3,3 |
24,7 |
19,0 |
29,0 |
23,6 |
20,0 |
28,0 |
00,77 |
|
Кровоток по шунту, см/с |
Больше 60, |
110 |
103 |
117 |
112 |
106 |
120 |
00,67 |
Признаком тромбоза шунта во время проведения описываемого метода исследования было отсутствие кровотока по нему. Тромбоз шунта был диагностирован у 5 пациентов I группы, – у этих же больных были отмечены рецидивные кровотечения из ВРВПЖ в послеоперационном периоде. Во II группе ни у одного пациента в течение периода наблюдения тромбоза шунта диагностировано не было.
Сравнительная оценка возникших осложнений в виде тромбоза внутрипеченочного портосистемного шунта (с использованием метода множительных оценок Каплана-Мейера) представлена на рисунке 2.
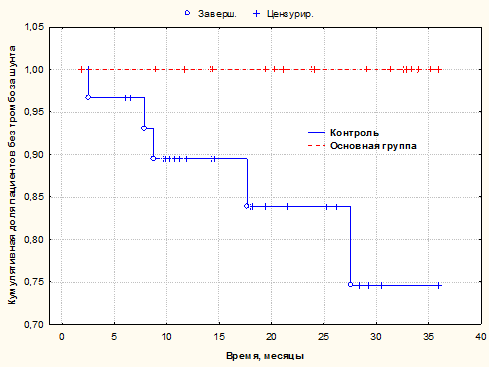
Рис. 2. Оценка по Каплану-Майеру частоты послеоперационных осложнений в виде тромбоза шунта для пациентов I и II групп сравнения в течение 36 месяцев. Статистическая значимость различий между сравниваемыми группами p=0,019 по критерию Вилкоксона
Послеоперационный лабораторный контроль гемостаза у всех пациентов осуществлялся путем определения коагулограммы и выполнения теста «Тромбодинамика» в период через 6-12 месяцев после выполнения оперативного вмешательства. Значения показателей коагулограммы у больных обеих изучаемых групп существенно не изменялись, независимо от наличия или отсутствия проведения корригирующей терапии. В подавляющем большинстве случаев при наличии отклонений от нормы в значениях показателей коагулограммы они оценивались как гипокоагуляционные. Значения показателей теста «Тромбодинамика» спустя 6-12 месяцев после операции у пациентов I (контрольной) группы существенно не изменялись, – все зарегистрированные в дооперационном периоде изменения сохранялись и в период после операции и расценивались как гиперкоагуляционные. У пациентов II (основной) группы в послеоперационном периоде отмечались изменения некоторых показателей (скорости и стационарной скорости), расцениваемые как сдвиг гиперкоагуляционных изменений в сторону нормальных значений показателей, что можно расценить как результат проводимой антитромботической терапии, которая, очевидно, оказала влияние на отсутствие в данной группе у пациентов гиперкоагуляционных осложнений в виде тромбоза шунта.
В соответствии с поставленными задачами исследования, для наглядного представления описания клинических и диагностических критериев оценки отдалённых результатов лечения больных ПГ цирротического генеза мы сформировали таблицу, включающую в себя два, на наш взгляд, возможных клинических результата: удовлетворительный и неудовлетворительный (табл. 2).
Таблица 2
Клинические и сонографические критерии оценки отдалённых результатов лечения больных портальной гипертензией цирротического генеза в сроке до 36 месяцев
|
Удовлетворительный результат |
Неудовлетворительный результат |
|
· Отсутствие эпизодов варикозного пищеводно-желудочного кровотечения. · Степень варикозного расширения вен пищевода уменьшается или сохраняется без изменений. · Проходимость портосистемного шунта |
· Рецидив варикозного пищеводно-желудочного кровотечения. · Тромбоз портосистемного шунта. · Летальный исход |
Указанные в приведенной таблице критерии оценки отдаленных результатов оперативного лечения пациентов с ПГ цирротического генеза продиктованы анализом наблюдений за клиническим течением послеоперационного периода и определением наиболее информативных признаков функционирования портосистемного шунта. В таблице 3 представлены результаты применения предложенных критериев оценки отдаленных результатов лечения применимо к исследуемым нами пациентам обеих групп сравнения.
Таблица 3
Отдаленные результаты после выполнения TIPS/ТИПС у пациентов с внутрипеченочной портальной гипертензией в сроке до 36 месяцев
|
Отдаленный результат |
I контрольная группа, n=31 |
II основная группа, n=30 |
||
|
Абсолютное число |
% |
Абсолютное число |
% |
|
|
Удовлетворительный |
26 |
83,87 |
30 |
100,00 |
|
Неудовлетворительный |
5 |
16,13 |
0 |
0,00 |
Значимость различий между соотношением удовлетворительных и неудовлетворительных результатов в основной и контрольной группах составила p<0,001 (использован точный двусторонний критерий Фишера).
У 83,87% пациентов I группы и 100% пациентов II группы в соответствии с предложенной схемой оценки в отдаленном периоде наблюдения после операции были получены «удовлетворительные» результаты. «Неудовлетворительный» результат лечения определялся у 16,13% пациентов (5 человек) I группы, причиной которого у 5 пациентов служило возникновение рецидивного варикозного пищеводно-желудочного кровотечения на фоне инструментально подтвержденного тромбоза портосистемного шунта, 2 из которых (6,45%) завершились летальными исходами. При наблюдении в срок от 6 до 36 месяцев в послеоперационном периоде за пациентами отсутствуют статистически достоверные различия выживаемости между обеими группами больных.
Важным критерием эффективности применяемого хирургического пособия является сравнительная оценка выживаемости по Kaplan-Meier для обеих групп наблюдения в срок до 36 месяцев после операции, результат которой представлен на рисунке 3.
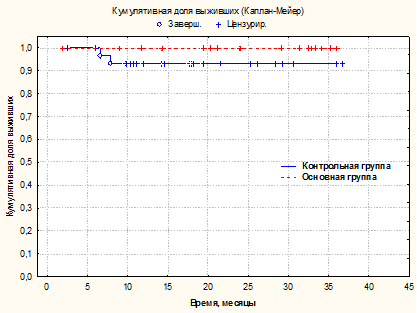
Рис. 3. Оценка по Каплану-Мейеру летальных исходов I и II групп сравнения в течение 36 месяцев. Статистическая значимость различий между сравниваемыми группами p=0,15 по критерию Вилкоксона
Доля выживших в течение 36 месяцев в I группе составила 93,55%, во II группе – 100%.
В завершение описания полученных в ходе нашего исследования результатов приведем клинические примеры, демонстрирующие клиническую значимость сделанных нами выводов.
Клинический пример 1. Больной З., 62 лет, включен в I контрольную группу нашего исследования. В октябре 2016 года поступил в клинику с диагнозом ЦП, вирус ассоциированный по гепатиту В, ПГ, ВРВПЖ III ст., состоявшееся пищеводное кровотечение (сентябрь, 2016 г.), спленомегалия, хроническая печёночная недостаточность класса «В» по Child-Turcotte-Pugh, MELD – 11 баллов, состояние после эндоскопического лигирования вен пищевода (2013 г.). Болеет в течение 11 лет, когда впервые был установлен диагноз вирусного гепатита В. На момент осмотра отмечает жалобы на повышенную утомляемость, общую слабость, ноющие боли непостоянного характера в поясничной области и эпигастрии. По данным УЗИ органов брюшной полости выявляются увеличения размеров печени и селезёнки. Из анамнеза: эпизоды кровотечения из ВРВПЖ были отмечены дважды, в 2013 г. и в сентябре 2016 г. В отделении больному была выполнена операция в объёме ТИПС/TIPS по стандартной методике с установкой стент-графта. Состояние гемостаза до операции оценивалось «базисными» тестами (определение уровня тромбоцитов, МНО, АЧТВ, фибриноген, активность протромбина по Квику, ПТВ, ПТИ, ТВ) и выполнением теста «Тромбодинамика». По результатам коагулограммы у больного отмечались признаки умеренной гипокоагуляции, однако тест «Тромбодинамика» выявил у больного гиперкоагуляционное состояние (табл. 4).
Таблица 4
Значения показателей коагулограммы и теста «Тромбодинамика» до операции (клинический пример 1)
|
Наименование показателя |
Значения нормы |
Полученные результаты исследования |
|
Коагулограмма |
||
|
ПТИ, % |
80-120 |
76 ↓ |
|
АЧТВ, сек. |
24-34 |
42,0 ↑ |
|
Фибриноген, г/л |
1,7-5,1 |
1,78 |
|
МНО |
0,8-1,2 |
1,78 ↑ |
|
Протромбиновое время, сек. |
10-13 |
17,2 ↑ |
|
Тромбиновое время, сек. |
11-17,8 |
18,0 ↑ |
|
Активность протромбина по Квику, % |
80-100 |
76 ↓ |
|
D-димер, нг/мл |
до 255 |
552 ↑ |
|
РФМК, мг/мл |
3,36-4,00 |
3,54 |
|
Тромбоциты, х109/л |
155-366 |
123 ↓ |
|
Тест «Тромбодинамика» |
||
|
Скорость формирования кровяного сгустка (V), мкм/мин. |
20-29 |
42,1 ↑ |
|
Задержка роста кровяного сгустка (Tlag), мин. |
0,6-1,5 |
1,3 |
|
Начальная скорость кровяного сгустка (Vi), мкм/мин. |
38-56 |
52,1 |
|
Стационарная скорость кровяного сгустка (Vst), мкм/мин. |
20-29 |
42,1 ↑ |
|
Размер сгустка через 30 мин. (Сs), мкм |
800-1200 |
1372 ↑ |
|
Плотность сгустка (D), усл. ед. |
15000-32000 |
24651 |
|
Время появления спонтанных сгустков (Tsp), мин. |
отсутствуют, больше 30 мин. |
23,2 |
По условиям нашего исследования, в периоперационном периоде ведение пациента проводилось в соответствии с имеющимися стандартами, поэтому, учитывая полученные данные коагулограммы, пациент во время операции получил профилактически 5000 Ед гепарина, а после проведения операции TIPS/ТИПС в послеоперационном периоде не получал антитромботическую терапию.
Используя способ определения риска развития гиперкоагуляции у больных с ПГ цирротического генеза после проведения портосистемного шунтирования (Патент РФ на изобретение №2665118) по предложенной нами шкале, мы провели подсчет суммы баллов, которая составила 10, что соответствует верхней границе допустимого количества баллов в группе риска В (табл. 5).
Таблица 5
Результаты «Прогноза развития тромботических осложнений» (клинический пример 1)
|
Группы риска |
Баллы |
Риск развития гиперкоагуляции |
Количество баллов у пациентки |
|
Группа риска В |
6-10 |
умеренный |
Группа риска В |
Кроме того, ретроспективно мы применили сформированный нами прогностический электронный калькулятор на основе таблиц Excel (Приоритетная справка №2019126976) и рассчитали вероятность тромбоза шунта у данного пациента, исходя из имеющихся лабораторных данных, получив результат положительного прогноза в виде «Тромбоз», визуальное подтверждение которого представлено на рисунке 4.
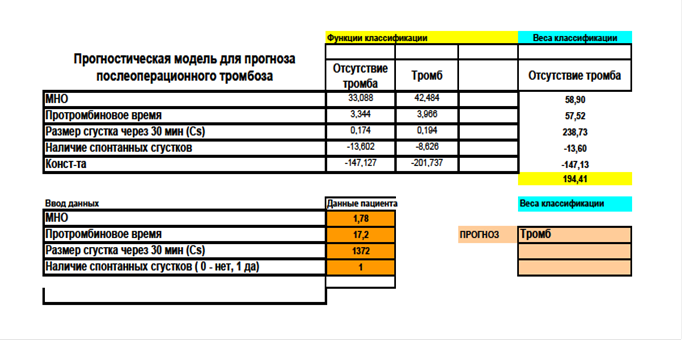
Рис. 4. Клинический пример 1.
Положительный прогноз «Тромбоз» у пациента З.
В апреле 2017 года у больного был отмечен третий эпизод кровотечения из ВРВПЖ, после которого пациенту было выполнено УЗДИ, по данным которого выявлено отсутствие кровотока по шунту. Результаты, полученные при исследовании свёртывающей системы крови, включающие коагулограмму и тест «Тромбодинамика», соответствовали полученным ранее при предоперационном исследовании, – гипокоагуляция в первом случае и гиперкоагуляционный сдвиг во втором (табл. 6).
Таблица 6
Значения показателей коагулограммы и теста «Тромбодинамика» через 6 месяцев после операции (клинический пример 1)
|
Наименование показателя |
Значения нормы |
Полученные результаты исследования |
|
Коагулограмма |
||
|
ПТИ, % |
80-120 |
76 ↓ |
|
АЧТВ, сек. |
24-34 |
41,0 ↑ |
|
Фибриноген, г/л |
1,7-5,1 |
1,78 |
|
МНО |
0,8-1,2 |
1,76 ↑ |
|
Протромбиновое время, сек. |
10-13 |
15,1 ↑ |
|
Тромбиновое время, сек. |
11-17,8 |
19,0 ↑ |
|
Активность протромбина по Квику, % |
80-100 |
70 ↓ |
|
D-димер, нг/мл |
до 255 |
511 ↑ |
|
РФМК, мг/мл |
3,36-4,00 |
3,50 |
|
Тромбоциты, х109/л |
155-366 |
132 ↓ |
|
Тест «Тромбодинамика» |
||
|
Скорость формирования кровяного сгустка (V), мкм/мин. |
20-29 |
41,1 ↑ |
|
Задержка роста кровяного сгустка (Tlag), мин. |
0,6-1,5 |
1,2 |
|
Начальная скорость кровяного сгустка (Vi), мкм/мин. |
38-56 |
52,1 |
|
Стационарная скорость кровяного сгустка (Vst), мкм/мин. |
20-29 |
41,1 ↑ |
|
Размер сгустка через 30 мин. (Сs), мкм |
800-1200 |
1382 ↑ |
|
Плотность сгустка (D), усл. ед. |
15000-32000 |
24817 |
|
Время появления спонтанных сгустков (Tsp), мин. |
отсутствуют, больше 30 мин. |
22,8 |
Анализ полученной информации подтверждает правильность выбора предложенной нами прогностической системы и электронного калькулятора. В случае своевременного назначения корригирующей антитромботической терапии в раннем послеоперационном периоде, исходя из полученных данных в ходе обследования пациента, а именно – значений показателей теста «Тромбодинамика» и результатов применения предложенных нами прогностических методов, можно предположить, что с большей долей вероятностью тромбоза портосистемного шунта можно было бы избежать.
Клинический пример 2. Больной Б., 52 лет, включен во II основную группу нашего исследования. В июне 2017 года поступил в клинику с диагнозом ЦП, вирус-ассоциированный по гепатиту В, ПГ, ВРВПЖ II ст., состоявшееся пищеводное кровотечение (май 2017 г.), спленомегалия, хроническая печёночная недостаточность класса В по Child-Turcotte-Pugh, MELD – 9 баллов. Болеет в течение 6 месяцев, когда впервые был установлен диагноз вирусного гепатита В. На момент осмотра отмечает жалобы на общую слабость, ноющие боли непостоянного характера в правом подреберье. По данным УЗИ органов брюшной полости выявляются увеличения размеров печени и селезёнки. Из анамнеза: однократно был отмечен эпизод кровотечения из ВРВПЖ в мае 2017 г. В отделении больному была выполнена операция в объёме TIPS/ТИПС. Состояние гемостаза перед операцией оценивалось «базисными» тестами (определение уровня тромбоцитов, МНО, АЧТВ, фибриноген, активность протромбина по Квику, ПТВ, ПТИ, ТВ) и выполнением теста «Тромбодинамика». По результатам коагулограммы у больного Б. отмечались признаки умеренной гипокоагуляции, тест «Тромбодинамика» выявил у больного гиперкоагуляционное состояние (табл. 7).
Таблица 7
Значения показателей коагулограммы и теста «Тромбодинамика» до операции (клинический пример 2)
|
Наименование показателя |
Значения нормы |
Полученные результаты исследования |
|
Коагулограмма |
||
|
ПТИ, % |
80-120 |
67 ↓ |
|
АЧТВ, сек. |
24-34 |
30,2 |
|
Фибриноген, г/л |
1,7-5,1 |
1,55 ↓ |
|
МНО |
0,8-1,2 |
1,63 ↑ |
|
Протромбиновое время, сек. |
10-13 |
16,2 ↑ |
|
Тромбиновое время, сек. |
11-17,8 |
20,3 ↑ |
|
Активность протромбина по Квику, % |
80-100 |
74 ↓ |
|
D-димер, нг/мл |
до 255 |
751 ↑ |
|
РФМК, мг/мл |
3,36-4,00 |
3,40 |
|
Тромбоциты, х109/л |
155-366 |
89 ↓ |
|
Тест «Тромбодинамика» |
||
|
Скорость формирования кровяного сгустка (V), мкм/мин. |
20-29 |
32,7 ↑ |
|
Задержка роста кровяного сгустка (Tlag), мин. |
0,6-1,5 |
0,9 |
|
Начальная скорость кровяного сгустка (Vi), мкм/мин. |
38-56 |
56,1 ↑ |
|
Стационарная скорость кровяного сгустка (Vst), мкм/мин. |
20-29 |
32,7 ↑ |
|
Размер сгустка через 30 мин. (Сs), мкм |
800-1200 |
1264 ↑ |
|
Плотность сгустка (D), усл. ед. |
15000-32000 |
13657 ↓ |
|
Время появления спонтанных сгустков (Tsp), мин. |
отсутствуют, больше 30 мин. |
23,2 |
Учитывая условия нашего исследования, получив данные предоперационного обследования пациента, в частности признаки гиперкоагуляции по результатам теста «Тромбодинамика», несмотря на гипокоагуляционные сдвиги значений показателей коагулограммы, в раннем послеоперационном периоде пациенту была назначена корригирующая антитромботическая терапия сроком на 3 месяца с контролем состояния системы гемостаза 1 раз в 1 месяц. Терапия включала в себя препарат группы прямых низкомолекулярных антикоагулянтов (действующее вещество – эноксапарин натрия), а также препарат группы дезагрегантов (действующее вещество – ацетилсалициловая кислота).
Используя способ определения риска развития гиперкоагуляции у больных с портальной гипертензией цирротического генеза после проведения портосистемного шунтирования (Патент РФ на изобретение №2665118) по предложенной нами шкале, мы провели подсчет суммы баллов, которая составила 11, что соответствует группе риска С (табл. 8).
Таблица 8
Результат «Прогноза развития тромботических осложнений» (клинический пример 2)
|
Группы риска |
Баллы |
Риск развития гиперкоагуляции |
Количество баллов у пациентки |
|
Группа риска С |
11-15 |
высокий |
Группа риска С |
Также ретроспективно мы применили сформированный нами прогностический электронный калькулятор на основе таблиц Excel и рассчитали вероятность тромбоза шунта у данного пациента, исходя из имеющихся лабораторных данных, получив результат положительного прогноза в виде «Тромбоз» (рис. 5).
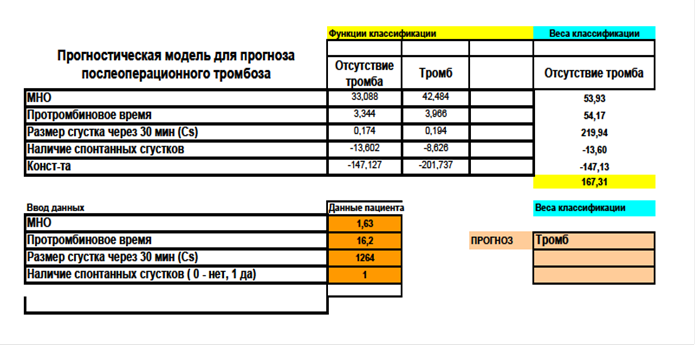
Рис. 5. Клинический пример 2.
Положительный прогноз «Тромбоз» у пациента Б. (до операции)
При контрольном исследовании свертывающей системы крови через 3 и 6 месяцев после операции была отмечена положительная динамика в виде улучшения показателей теста «Тромбодинамика», при этом значения показателей коагулограммы, несмотря на некоторые изменения, оставались характерными для гипокоагуляционных сдвигов. Приводим пример результата обследования через 6 месяцев после операции на фоне проведённого курса терапии в таблице 9.
Таблица 9
Значения показателей коагулограммы и теста «Тромбодинамика» после операции (клинический пример 2)
|
Наименование показателя |
Значения нормы |
Полученные результаты исследования |
|
Коагулограмма |
||
|
ПТИ, % |
80-120 |
70 ↓ |
|
АЧТВ, сек. |
24-34 |
30,1 |
|
Фибриноген, г/л |
1,7-5,1 |
1,40 ↓ |
|
МНО |
0,8-1,2 |
1,27 ↑ |
|
Протромбиновое время, сек. |
10-13 |
15,2 ↑ |
|
Тромбиновое время, сек. |
11-17,8 |
21,3 ↑ |
|
Активность протромбина по Квику, % |
80-100 |
70 ↓ |
|
D-димер, нг/мл |
до 255 |
521 ↑ |
|
РФМК, мг/мл |
3,36-4,00 |
3,42 |
|
Тромбоциты, х109/л |
155-366 |
112 ↓ |
|
Тест «Тромбодинамика» |
||
|
Скорость формирования кровяного сгустка (V), мкм/мин. |
20-29 |
28,9 |
|
Задержка роста кровяного сгустка (Tlag), мин. |
0,6-1,5 |
1,1 |
|
Начальная скорость кровяного сгустка (Vi), мкм/мин. |
38-56 |
56,1 ↑ |
|
Стационарная скорость кровяного сгустка (Vst), мкм/мин. |
20-29 |
28,9 |
|
Размер сгустка через 30 мин. (Сs), мкм |
800-1200 |
1198 |
|
Плотность сгустка (D), усл. ед. |
15000-32000 |
17621 |
|
Время появления спонтанных сгустков (Tsp), мин. |
отсутствуют, больше 30 мин. |
отсутствуют |
Используя прогностический электронный калькулятор, мы рассчитали вероятность тромбоза шунта у данного пациента, исходя из имеющихся лабораторных данных, полученных спустя 6 месяцев после операции и проведенной корригирующей антитромботической терапии. Результат расчетов визуально представлен на рисунке 6.

Рис. 6. Клинический пример 2.
Отрицательный прогноз «Отсутствие тромба» у пациента Б.
Анализ полученной информации подтверждает правильность выбора предложенной нами прогностической системы и использования электронного калькулятора. В случае своевременного назначения корригирующей антитромботической терапии в раннем послеоперационном периоде можно нивелировать риски развития тромбоза портосистемного шунта.
Заключение. Таким образом, расширение диагностического лабораторного арсенала путем выполнения теста «Тромбодинамика» у пациентов нередко позволяет определить характерные признаки гиперкоагуляционных сдвигов в системе гемостаза, несмотря на определяемые коагулограммой признаки гипокоагуляции, что обоснованно позволяет рекомендовать включение данного метода исследования в перечень необходимых диагностических мероприятий в предоперационном периоде у данной категории пациентов.
Разработанный нами способ определения риска развития гиперкоагуляции у больных с ПГ цирротического генеза после проведения портосистемного шунтирования (Патент РФ на изобретение №2665118) позволил на этапе предоперационной подготовки определить готовящихся к операции TIPS/ТИПС пациентов в группы низкого, среднего и высокого риска развития тромбообразования (А или В, или С), что позволило провести персонифицированную медикаментозную коррекцию в послеоперационном периоде. Также мы предлагаем использовать разработанный нами способ прогнозирования риска развития тромботических осложнений в послеоперационном периоде у больных ЦП после выполнения TIPS/ТИПС – прогностический калькулятор (Приоритетная справка №2019126976), который позволил на основании наиболее статистически значимых показателей лабораторного обследования пациента точно определить риск развития гиперкоагуляции и улучшить результаты лечения больных с осложненными формами ЦП.
Библиографическая ссылка
Сапронова Н.Г., Светова Э.В., Канцуров Р.Н., Ерошенко О.Л., Простов И.И., Стагниев Д.В. ОЦЕНКА ОТДАЛЕННЫХ РЕЗУЛЬТАТОВ ЛЕЧЕНИЯ ПАЦИЕНТОВ С ЦИРРОЗОМ ПЕЧЕНИ, ПЕРЕНЕСШИХ ОПЕРАЦИЮ ТРАНСЪЮГУЛЯРНОГО ВНУТРИПЕЧЕНОЧНОГО ПОРТОСИСТЕМНОГО СТЕНТ-ШУНТИРОВАНИЯ // Современные проблемы науки и образования. 2020. № 2. ;URL: https://science-education.ru/ru/article/view?id=29616 (дата обращения: 29.01.2026).
DOI: https://doi.org/10.17513/spno.29616



