Известные недостатки дооперационной дифференцировки стадии пищеводной карциномы в виде низкой чувствительности, точности и специфичности многочисленных диагностических методик были изложены и обсуждены нами в предыдущей статье [1]. В этой связи интраоперационная диагностика распространенности опухолевого процесса и уточнение стадии рака пищевода остаются актуальными задачами современной хирургической онкологии, поскольку именно стадирование опухолевой карциномы во время операции определяет резектабельность процесса, объем резекции, а также выбор пластического материала. От точности интраоперационного стадирования рака пищевода также зависят и радикализм вмешательства, уточненный прогноз для пациента, обоснование дальнейших лечебных модальностей. Однако визуального осмотра и пальпации часто недостаточно для хирурга, чтобы определить линии отграничения опухолевых масс от интактных тканей, выявить и подтвердить местонахождение метастазов. Традиционный метод определения стадии карциномы посредством интраоперационной физикальной ревизии не может быть точным, особенно для непальпируемых, невидимых, оккультных фокусов опухолевой ткани [2]. Физикальное выявление стадии рака пищевода часто затрудняет параканкрозное воспаление с вовлечением смежных структур, что вынуждает хирургов прибегать к резекции смежного органа или сокращать объем операции до паллиативного. Интраоперационная макроскопическая ревизия приводит к завышению степени инвазии опухоли у каждого пятого больного, поскольку морфологическое исследование удаленного препарата, дифференцированного как sT4, показывает истинное врастание опухоли в окружающие органы (pT4) в 80% случаев. Различие между sT и pT особенно значимо при интраоперационной оценке инвазии рака пищевода в легкие и перикард [3]. Макроскопически и физикально определить опухолевую инвазию слоев полого органа, в том числе пищевода, во время операции крайне затруднительно, потому это удается уточнить менее чем в трети случаев.
Как упоминалось нами ранее, другие методы интраоперационного стадирования, такие как срочное гистологическое исследование замороженного края опухоли и лимфоузла, интраоперационное ультразвуковое исследование, экспресс-цитология, далеко не всегда соответствуют клиническим ожиданиям. Эти трудоемкие методики, обладая недостаточной точностью, не обеспечивают непрерывного мониторинга ситуации в режиме реального времени во время вмешательства [4]. Известные методы, адаптированные к интраоперационному применению, такие как спиральная компьютерная томография (СКТ), магнитно-резонансная томография (МРТ), позитронно-эмиссионная томография (ПЭТ-КТ) и ультразвуковое исследование (УЗИ), могут предоставить большое количество информации для определения стадии и значительно облегчить интраоперационные манипуляции [5]. Однако они содержат множество ограничений, не находя широкого использования в хирургической практике. Громоздкость аппаратуры при размещении в операционной, сильные магнитные поля, ионизирующее излучение, использование радиоактивных веществ приводят к серьезным проблемам обеспечения безопасности больных и медперсонала [6]. Интраоперационная флуоресцентная визуализация в настоящее время активно внедряется в повседневную практику хирургической онкологии, соответствует современным требованиям к интраоперационным технологиям, а именно к визуализации опухолевых тканей в режиме реального времени, что позволяет оценивать происходящие в них изменения во время операции. Это предопределяет появление интраоперационных методов визуализации на основе флуоресценции и разработку концепции «fluorescence image-guided surgery» – хирургии с флуоресцентным наведением [7]. Одной из активно разрабатываемых технологий является интраоперационная навигация с оптической визуализацией в ближнем инфракрасном (NIR) спектре с длиной волны 700–900 нм. Флуоресцентный сигнал испускается контрастным агентом – веществом-флуорофором, поглощенным опухолевыми тканями. Видимый свет, освещающий флуорофор, проникает в ткани на глубину нескольких микрометров, тогда как ближний инфракрасный свет может проходить через кровь и ткани на несколько миллиметров, достигая глубины 1 см [1]. Флуоресцентную визуализацию отличают высокие контрастность, разрешение и безопасность по сравнению с другими методами [8]. В настоящее время в клинической практике для интраоперационной флуоресцентной визуализации наиболее широко используются контрастные вещества (или флуорофоры): индоцианиновый зеленый (ICG), 5-аминолевулиновая кислота – 5-Aminolevulinic acid (5-ALA) и метиленовый синий [9].
Впервые о применении интраоперационного выявления стадии местнораспространенного рака пищевода in humani с использованием ICG сообщено в 2018 г. O.T. Okusanya et al. Клиническое исследование преследовало цели коррекции объема лимфодиссекции, персонализации морфологического исследования наиболее значимых региональных лимфоузлов за пределами параэзофагеальных коллекторов, изучения труднопредсказуемого лимфатического пути метастазирования рака пищевода [10].
Насущной потребностью развития флуоресцентно-наведенной хирургии рака пищевода (РП) остается интраоперационное исследование смежных областей резекции, таких как аорта, трахея и область возвратных гортанных нервов. Пилотные исследования M. Motoori et al. с использованием в качестве флуорофора 5-аминолевуленовой кислоты по ИО ФДД резидуальных очагов рака в краях резекции вокруг трахеи были выполнены в 2015 г., но их трактовка оказалась чрезвычайно затруднительной, а сами результаты не опубликованы [11]. Но в то же время на фоне очевидных недостатков других методов стадирования рака пищевода интраоперационная флуоресцентная визуализация и фотодинамическая диагностика метастазов рака пищевода в лимфатические узлы на сегодняшний день являются выполнимыми при поиске новых комбинаций флуорофоров/фотосенсибилизаторов, хирургических доступов к лимфоколлекторам средостения и брюшной полости и при дальнейшем техническом совершенствовании интраоперационных систем флуоресцентной визуализации [12, 13].
Однако в изученной нами литературе не встречались публикации о диагностической ценности интраоперационного флуоресцентного исследования онкологической чистоты выполняемого резекционного вмешательства и поиска отдаленных метастазов рака пищевода. Продолжение исследований в этом направлении представляется актуальной задачей, способной сделать этот метод простым и быстрым интраоперационным диагностическим инструментом, что может революционизировать хирургическую стратегию рака пищевода.
Цели работы: сравнить возможности метода интраоперационной физикальной ревизии и метода интраоперационной фотодинамической диагностики в оценке радикализма резекционных вмешательств и верификации отдаленного метастазирования рака пищевода.
Материалы и методы исследования
В работе проведен сравнительный анализ диагностической эффективности двух методов интраоперационного определения стадии РП. Анализировались метод физикальной оценки распространенности эзофагеальной карциномы на основе макроскопической визуализации, пальпации и ревизии органов брюшной полости (ОБП) и органов грудной клетки (ОГК), использованный опытным хирургом у 109 оперированных больных (контрольная группа ИО физикального определения стадии), а также метод интраоперационной фотодинамической (флуоресцентной) диагностики рака пищевода (основная группа ИО ФДД), примененный у 101 пациента во время выполнения резекций пищевода по поводу рака. При этом методика выполнения ИО ФДД, а также характеристики фотосенсибилизаторов, режимы и дозировки их введения не отличались от представленных в предыдущей статье. Результаты ИО дифференцировки стадии опухолевого процесса по правилам TNM классификации 8-го издания, 2017 г., являлись основанием для выбора уровня резекции пищевода, формирования эзофагогастроанастомоза, объема резекции желудка, варианта лимфодиссекции и эзофагопластики. Методикой сравнения – эталоном выявления стадии опухолевого процесса – явились результаты патоморфологического исследования образца резекции по категориям pTNM 8th ed, 2017.
Степень радикальности оперативного вмешательства (sR статус) верифицировалась как до, так и после момента удаления препарата по флуоресцентным границам опухолевого очага и его распространению на соседние органы путем сравнения границ ярко флуоресцирующего очага относительной интенсивностью ≥ 0,3 Ед на мониторе «Флуовизора» с анатомическими границами пораженного органа и его лимфоколлекторов в средостении и/или верхнем этаже брюшной полости.
Отдаленное метастазирование (sM статус) карциномы констатировалось посредством поиска флуоресцентных очагов с интенсивностью ≥ 0,3 Ед в проекции анатомических образований средостения, брюшной полости и в мягких тканях шеи при выполнении шейного доступа.
После получения результатов патоморфологического исследования образца резекции, на основании сравнения sRM- и pRM-статусов каждого больного РП проводился подсчет истинно положительных (ИП), истинно отрицательных (ИО), ложноположительных (ЛП) и ложноотрицательных (ЛО) результатов. По количеству ИО, ИП, ЛО, ЛП результатов для изучаемых методик интраоперационного определения стадии рассчитывались процентные показатели чувствительности (ИП/ИП+ЛО)х100, специфичности (ИО/ИО+ЛП)х100 и точности (ИО+ИП/ИП+ИО+ЛО+ЛП)х100 с 95%-ным доверительным интервалом (ДИ).
Результаты исследования и их обсуждение
Как указано выше, поиск и верификация отдаленных метастазов рака пищевода, не осязаемых при ревизии и не определяемых визуально, осуществлялись с помощью ИО ФДД посредством применения «Флуовизора» в основной группе у 101 больного. В контрольной группе проведен анализ точности оценки M-статуса больных РП по результатам физикальной ревизии у 109 оперированных больных без использования методики ИО ФДД (табл. 1).
Таблица 1
Распределение оперированных больных по критерию M, оцениваемому при физикальной ревизии зоны операции (sM «физикально»), при патоморфологической верификации (pM) и их сравнение
|
Наличие отдаленных метастазов |
Число больных с критерием M, полученным |
Совпадение стадии sM и pM (ypM) |
||
|
физикально sM |
гистологически pM (ypM) |
число больных |
Точность, % (95% ДИ) |
|
|
M0 |
99 |
97 |
95 |
97,9 |
|
M1 |
10 |
12 |
8 |
66,7 |
|
Всего |
109 |
109 |
103 |
94,5 (88,4–97,9) |
Из таблицы 1 видно, что прогностическая ценность положительного результата физикальной интраоперационной диагностики отдаленных метастазов РП составляет 66,7%, что не может удовлетворять современным позициям в онкохирургии пищевода. Набольшую точность поиска отдаленных метастазов РП показала методика ИО ФДД (табл. 2).
Таблица 2
Распределение оперированных больных по критерию M, определенному с помощью ИО ФДД (sM), патоморфологически (pM), и их сравнение
|
Наличие отдаленных метастазов |
Число больных с критерием M, полученным |
Совпадение стадии sM и pM (ypM) |
||
|
при ИО ФДД sM |
гистологически pM (ypM) |
число больных |
Точность, % (95% ДИ) |
|
|
M0 |
88 |
87 |
86 |
98,9 |
|
M1 |
13 |
14 |
12 |
85,7 |
|
Всего |
101 |
101 |
98 |
97,0 (91,6–99,4) |
Данные таблицы 2 наглядно показывают, что прогностическая ценность положительного результата в оценке M-статуса при использовании ИО ФДД составила 85,7%, что почти в полтора раза выше, чем при использовании метода физикальной ревизии. Это объясняется способностью «Флуовизора» определять флуоресцентную активность очагов, визуально и/или пальпаторно подозрительных на метастазы, а также идентифицировать макроскопически невидимые, неосязаемые метастазы на поверхности органов и на серозных оболочках. Четыре случая макроскопически не видимого оператором канцероматоза брюшины, но выявленных «Флуовизором» (рис. 1), были гистологически подтверждены при аденокарциномах абдоминального отдела пищевода и расценены как sM1. В этих случаях паллиативный характер резекционного вмешательства являлся основанием избежать необоснованного расширения объема операции.
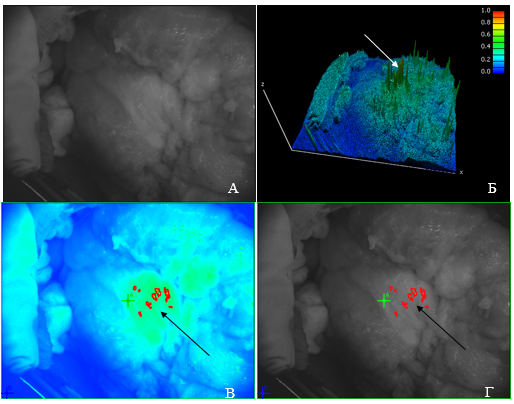
Рис. 1. Клинический пример. По результатам предоперационного стадирования установлен диагноз: аденокарцинома абдоминального отдела пищевода. cT4aN1M0G3. Стадия IIIВ.
А) нативное черно-белое изображение поверхности брюшины на поджелудочной железе;
Б) на трехмерной гистограмме пиками высокоинтенсивной флуоресценции показаны мелкие имплантационные метастазы аденокарциномы, не определяемые макроскопически;
В) изображение микрометастазов с границами в псевдоцвете; Г) черно-белое изображение с обозначением границ мелких опухолевых очагов. По результатам стадирования ИО ФДД установлены критерии: sT4aN1M1(peritoneum), стадия IVB. Истинно положительный результат по категории M. Патогистологическая стадия pT4aN1M1G3, стадия IVB
В шести случаях методом ИО ФДД зафиксированы флуоресцентные признаки наличия мелких (до 0,7 см) метастатических очагов в печени, легочной паренхиме и экстраогранных метастазов малых размеров (до 0,8 см). При этом методы дооперационного выявления стадии в трех из шести данных наблюдений расценивали статус пациентов как сM0. Два ложноотрицательных результата ИО ФДД отдаленных метастазов ретроспективно доказаны результатами аутопсии (в одном случае выявлены отдаленные метастазы в брыжейке тонкой кишки, в другом – в глубине легочной паренхимы). В одном случае система интраоперационной визуализации флуоресценции позволила получить истинно отрицательный результат M0 при интраоперационной дифференциальной диагностике хондромы и метастаза РП в правом легком. Лишь в одном исследовании зафиксирован ложноположительный результат sM1, что составило менее 1% всех результатов. Единственный в нашем исследовании ЛО результат был получен при последующей гистологической верификации выявленной гемангиомы правой доли печени.
Кроме того, после выполнения резекционного этапа осмотр операционного поля «Флуовизором» позволяет оценить резидуальный (sR) статус опухоли в ложе удаленной опухоли по радиальной (sRM), проксимальной (sPM) и дистальной (sDM) границам резекции. Выявление флуоресцентно активных остаточных опухолевых очагов на медиастинальной, костальной плевре, на перикарде, аорте, по ходу грудного лимфатического протока после удаления опухоли T4a, T4b может служить показанием для резекции соседнего органа – расширения вмешательства до объема комбинированной операции. При невозможности удаления остаточного опухолевого очага (в аорте, трахее, предсердии) пришлось констатировать паллиативный характер резекции. Чувствительность и специфичность ИО ФДД в оценке sR (sR0-2) статуса удаленной опухоли по sRM, sPM и sDM составили 87,5% и 98,6% соответственно.
Реализация принципов флуоресцентно-наведенной хирургии с использованием методики ИО ФДД нашла свое применение в расширении границы резекции пищевода проксимально, которая выполнена в восьми случаях. В трех случаях необходимость резекции пищевода аборально послужила основанием для переноса ЭГА на шею с выполнением эзофагэктомии типа Мак-Кеона. В пяти случаях при высокоинтенсивном (≥0,3 Ед) «флуоресцентном крае» проксимальной линии резекции пищевода анастомоз был перенесен в купол плевральной полости. В одном случае при плановом гистологическом исследовании в проксимальной границе резекции пищевода выявлена тяжелая дисплазия эпителия, не определенная «Флуовизором». У двух больных использованная в работе система изображения флуоресценции определила наличие интраорганных метастазов, удаленных проксимально от первичного очага, что в последующем было подтверждено гистологически. При этом в одном случае расширение границ резекции пищевода вверх объяснило недостаточную длину выкроенного заранее желудочного трансплантата, что привело к необходимости его удаления и использования тонкой кишки для пластики пищевода. Расширение границы резекции кардиального отдела желудка в дистальном направлении потребовалось выполнить в восьми случаях. Из восьми случаев у пяти больных интраоперационно «Флуовизором» показано массивное метастатическое поражение узлов зоны чревного ствола, паракардиальных и по ходу ветвей левой желудочной артерии (1, 3a, 3b, 7, 9 по классификации JES), что потребовало большего объема резекции кардиального отдела желудка с перевязкой нисходящей части левой желудочной артерии. Невозможность сохранить малую кривизну и, соответственно, кровоток по интраорганной сосудистой магистрали желудка оказалась поводом сформировать трансплантат в виде культи желудка на правых желудочно-сальниковых сосудах или узкого желудочного стебля при сохраненной дуге Галлера. В одном случае у пациента с синхронным поражением среднегрудного отдела пищевода плоскоклеточной карциномой и поражением аденокарциномой субкардиального отдела желудка положительная флуоресцентная граница линии проксимальной резекции желудка явилась обоснованием для экстирпации культи и выбора в качестве пластического материала тонкой кишки.
Контроль «чистоты» границ резекции основного очага первичной опухоли с помощью ИО ФДД во время 32 комбинированных операций показал частоту совпадений результатов с данными планового гистологического исследования в 90,3%. Чувствительность метода интраоперационного контроля онкологической полноты резекции составила 81,8%, а специфичность – 95,0%.
При высокой точности метода ИО ФДД в N-стадировании РП, доказанной выше, нами предложен вариант интраоперационной диагностики метастатического поражения лимфоузлов верхнего средостения (105, 106 recR и 106 recL). Фотодинамической диагностике прицельно подвергались ткани верхнего средостения после удаления опухоли и выполненного запланированного объема лимфодиссекции. По результатам ИО ФДД флуоресцентные маркеры метастатического поражения паратрахеальных лимфоузлов (106 pre) обнаружены в двух случаях, вовлечение в метастатический процесс узлов по ходу правого возвратного гортанного нерва (106 recR) отмечено у пяти, а левого (106 recL) – у одного больного. Гистологически наличие метастазов в указанных лимфоузлах подтверждено у семи больных. Таким образом, расширение медиастинальной ЛД после сеансов ИО ФДД до объема D2F и D2F+ оказалось обоснованным в 87,5% случаев.
Интраоперационный поиск дистально расположенных лимфогенных метастазов карцином с локализацией в верхне- и среднегрудном отделах выявил флуоресцентные признаки метастатического поражения узлов брюшной полости 4N этапа метастазирования по JES (3b, 4sa, 4sb, 4d, 5, 6, 8p, 10, 12, 13, 14a, 14v) у 12 больных (11,9%), которые при раке пищевода данных локализаций поражаются в 10–18% случаев. В отношении всех 12 больных с фотодинамическими признаками широкого лимфогенного метастазирования – выявления высокоинтенсивных очагов флуоресценции в лимфоколлекторах N4 этапа метастазирования по JES – принято решение о расширении объема абдоминальной лимфодиссекции методом «pick up» – сбора ягод. В дальнейшем получено 100%-ное патоморфологическое подтверждение метастатического поражения дополнительно «pick up» удаленных флуоресцентно активных лимфоузлов.
Таким образом, в случае метастатического поражения лимфоколлекторов, не входящих в стандартный объем торакальной и абдоминальной лимфодиссекции соответственно локализации первичного очага РП, использование ИО ФДД с 95%-ной точностью способно обосновать показания к расширению объема лимфодиссекции в грудной и/или брюшной полостях.
Вывод
Изучаемая методика дает возможность интраоперационно уточнить стадию процесса и определить более точный прогноз для пациента. Применение во время операции простой, безопасной ИО ФДД по принципам флуоресцентно-наведенной хирургии рака пищевода, реализованной в системе «Флуовизор», позволяет корригировать лечебную тактику, предоставляя хирургам возможность дифференцировать объем лимфодиссекции, повышать радикализм и онкологическую чистоту операции.
Библиографическая ссылка
Протченков М.А., Павелец К.В., Русанов Д.С., Павелец М.К., Карпова Р.А., Орел В.И., Антипова М.В., Синявская О.Л. ИНТРАОПЕРАЦИОННАЯ ФОТОДИНАМИЧЕСКАЯ ДИАГНОСТИКА И НОВЫЙ ВЗГЛЯД НА РАДИКАЛИЗМ ХИРУРГИЧЕСКОГО ВМЕШАТЕЛЬСТВА ПРИ РАКЕ ПИЩЕВОДА // Современные проблемы науки и образования. 2020. № 2. ;URL: https://science-education.ru/ru/article/view?id=29603 (дата обращения: 18.02.2026).
DOI: https://doi.org/10.17513/spno.29603



