По данным Всемирной организации здравоохранения заболеваемость раком неуклонно растет: по прогнозам распространенность онкологических заболеваний в мире к 2020 г. удвоится в сравнении с показателями 1999 г. Недостаток эффективных методов лечения онкологических заболеваний требует поиска новых лечебных методик.
Бор-нейтронозахватная терапия (БНЗТ) является перспективным и постоянно развивающимся методом лечения рака за счет возможности избирательно уничтожить клетки опухоли [1]. Методика основана на накоплении в опухолевых клетках стабильного изотопа бор-10 и последующего облучения нейтронами. В результате поглощения нейтронов ядрами бора происходит ядерная реакция (захват теплового нейтрона ядром 10B, что приводит к появлению ядра 11B в возбужденном состоянии, которое распадается на ядро лития 7Li и ядро гелия 4He) с выделением энергии в клетке на длине менее 10 мкм, что приводит к ее гибели, ограничивая при этом повреждения примерно размером одной клетки. Таким образом, селективное накопление изотопа бора-10 внутри клеток опухоли и последующее облучение тепловыми нейтронами приводят к разрушению клеток опухоли с относительно малыми повреждениями окружающих нормальных клеток. Эта инновационная методика лечения рака обеспечит прорыв в лечении пациентов, ранее считавшихся обреченными.
Исследования в области использования БНЗТ интенсивно ведутся во многих странах мира (Японии, ЕС, США, Аргентине, Тайване и др.). К настоящему времени в мире несколько тысяч пациентов успешно прошли процедуру БНЗТ на базе специализированных или переоборудованных ядерных реакторов – в Финляндии (FIR1), США (MIT-FCB), Нидерландах (HFR), Швеции (R2-0), Чехии (LVR-15), Японии (JRR-4 и KUR) [1].
В России БНЗТ проводилась в различных центрах: в Обнинске (ФЭИ и МРНЦ) – терапия быстрыми нейтронами на реакторе БР-10, в Снежинске совместно с Челябинским онкоцентром проводили терапию быстрыми нейтронами на нейтронном генераторе с пучком ионов дейтерия энергией 250 кэВ и с тритиевой мишенью, в Томске – быстрыми нейтронами на циклотроне с пучком ионов дейтерия энергией 13 МэВ и бериллиевой мишенью. В Москве (МИФИ совместно с Институтом биофизики и онкоцентром) проведены исследования на собаках, в качестве нейтронозахватного агента использовали гадолиний с целью проведения лечения меланомы слизистой ротовой полости [2].
Для дальнейшего развития метода необходимо продолжение разработки источников нейтронов, соединений бора и методов дозиметрии [3].
В качестве компактных, безопасных, относительно недорогих источников нейтронов могут использоваться ускорители заряженных частиц с соответствующими нейтрон-генерирующими мишенями и системами формирования пучка. За последние 30 лет было предложено большое количество таких проектов [4-7]. Ускорители позволяют получить лучший по качеству терапевтический пучок нейтронов, а также относительно просто и оперативно изменять спектр и поток нейтронов изменением энергии и тока пучка заряженных частиц и заменой мишени. Более того, ускорители нейтронов можно поместить в клинику. Оптимально терапевтический пучок нейтронов обеспечивается реакциями 7Li(p,n)7Be или 9Be(p,n)9B из-за низкой энергии генерируемых нейтронов [8].
В рамках одного из проектов в Институте ядерной физики им. Г.И. Будкера (Новосибирск) был разработан ускорительный источник нейтронов с твердой литиевой мишенью и током протонного пучка до 8,7 мА – ускоритель-тандем с вакуумной изоляцией и припороговым режимом генерации нейтронов в результате реакции 7Li(p,n)7Be, который наилучшим образом подходит для формирования потока эпитепловых нейтронов [9]. С участием международных и российских организаций создан прототип такой установки, на нем получен стабильный протонный пучок с рекордным током, осуществлена генерация нейтронов. Данная установка определяет мировой уровень и, в отличие от других разрабатываемых ускорительных источников, позволяет изменять энергию протонного пучка и тем самым модифицировать спектр нейтронов, что дает возможность проводить исследования для определения оптимальных параметров.
В Новосибирском национальном исследовательском государственном университете была создана лаборатория медико-биологических проблем БНЗТ с целью проведения экспериментальных исследований in vitro и in vivo для определения оптимальных параметров пучка нейтронов.
Для проведения БНЗТ также необходимы препараты адресной доставки бора, обеспечивающие его накопление в клетках опухоли. Борсодержащий препарат, обогащенный нуклидом бор-10, должен накапливаться в опухоли в концентрации более 20 мкг/г при отношении концентрации препарата в опухоли к нормальной ткани 3/1 и выше во время процедуры облучения. Однако существующие препараты боркаптат (BSH) и борфенилаланин (BPA) не обладают достаточной селективностью и не обеспечивают высокие концентрации бора в опухоли. Проблема адресного накопления в опухолевых клетках борсодержащих препаратов остается на данный момент нерешенной и ограничивает продвижение данного метода лечения в клиническую практику. На фоне успехов в разработке ускорительных источников в лаборатории медико-биологических проблем БНЗТ активно развиваются исследования, направленные на разработку борсодержащих препаратов, отвечающих требованию опухоль-специфичной таргетности.
Цель данного исследования – оценка оптимальных и максимальных доз облучения на ускорительном источнике нейтронов ИЯФ СО РАН для клеточных линий и животных с использованием линии клеток U87 (глиобластома), FetMSC (мезенхимальные клетки человеческого эмбриона) и SCID-мышей.
Материалы и методы исследования
Клетки культивировали в среде DMEM / F12 (1:1) (Биолот, Санкт-Петербург, Россия) с добавлением 10% фетальной бычьей сыворотки (Gibco, Thermo Fisher Scientific, Waltham, Массачусетс, США) и гентамицина 50 мкг/мл (Дальхимфарм, Хабаровск, Россия) при 37 ºC в атмосфере 5% CO2.
Для экспериментов in vitro образцы помещали в плексигласовый фантом под литиевой мишенью ускорителя. Облучение проведено с энергией протонов 2,0 МэВ и интегралом тока до 2,69 мА·ч. Через 48 и 96 часов после облучения 104 клеток на лунку помещали в 96-луночные пластины для МТТ-теста.
Все эксперименты на животных одобрены межинститутской комиссией по биоэтике и соответствуют принципам «Руководства по уходу и использованию лабораторных животных» [10].
В данном исследовании использовали мышей-самцов SCID (SHO-PrkdcscidHrhr) в состоянии SPF в возрасте 8–12 недель. Экспериментальные животные содержались в индивидуально вентилируемых клетках семейными группами по 2–5 особей в виварии SPF Института цитологии и генетики Сибирского отделения Российской академии наук (СО РАН). Мышей облучали пучком эпитермальных нейтронов с энергией протонов 2,0 МэВ и интегралом тока 3,78–4,48 мА·ч, а одну группу облучали до набора интеграла тока 7,56 мА·ч. В качестве контроля использовали необлученных животных.
Результаты исследования и их обсуждение
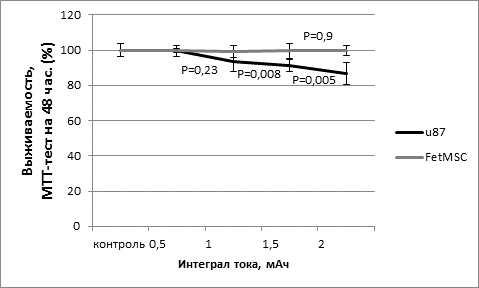
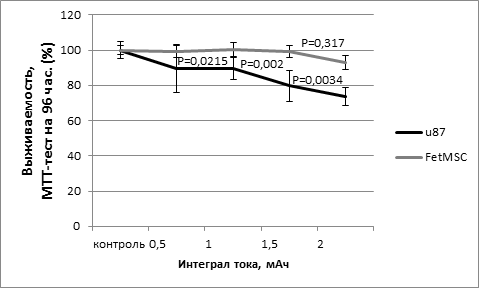
Поскольку нормальные ткани хорошо переносят нейтронное излучение, FetMSC – линия, полученная из нормальной эмбриональной ткани, оказалась более толерантной к эпитермальному нейтронному облучению, в то время как ответ опухолевой линии U87 был более заметным. Гибель клеток, основанная на времени, прошедшем с момента облучения, была очевидной: через 48 ч после облучения выживаемость U87 снизилась до 86,7% и через 96 ч – до 73,6%. Напротив, выживаемость FetMSC по сравнению с контролем уменьшилась незначительно: через 48 ч после облучения выживаемость снизилась менее чем на 1%, а через 96 ч – на 7% (рис. 1А, Б). Наши данные согласуются с предыдущими исследованиями по облучению клеточных линий U251MG, CHO-K1, V79 на ускорителе с током 1,5–3,0 мA при энергии протонов 2 МэВ [9], а также по аналогичному облучению клеточной линии U87 пучком с энергией протонов 2 МэВ и током 2,6 мА [11].
 А.
А.
 Б.
Б.
Рис. 1. Выживаемость клеток в зависимости от дозы облучения, МТТ-тест на 48 ч (А); выживаемость клеток в зависимости от дозы облучения, МТТ-тест на 96 ч (Б)
В экспериментах на животных изучали радиобиологические эффекты облучения пучком нейтронов с энергией протонов 2,0 МэВ в интегральных характеристиках тока от 3,78 до 7,56 мА·ч. По нашим наблюдениям, у мышей, подвергнутых облучению в дозах менее 4,48 мА·ч, не было выявлено в результате облучения патологических внешних признаков, снижения массы тела и летальных исходов в течение 30 дней после облучения. Внешние патологические признаки в виде трофических нарушений кожи (снижение эластичности, сухость, шелушение, эрозия) и снижение массы тела были обнаружены у мышей, получавших дозы от 4,48 мА·ч, но эти животные были живы через 1 месяц и постепенно набирали вес (рис. 2).
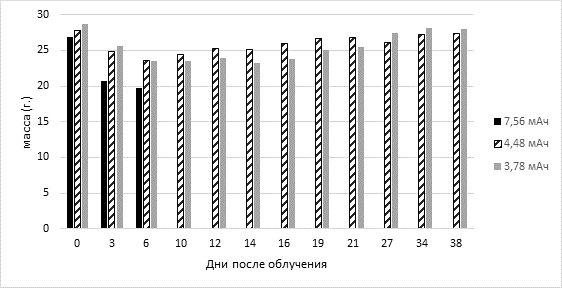
Рис. 2. Масса животных (мыши SCID) после облучения в дозах от 3,78 до 7,56 мА·ч
Доза облучения с энергией протонов 2,0 МэВ и интегралом тока 7,56 мА·ч была полностью летальной (LD100) для мышей, медиана выживаемости составила 4,7±3,2 дня. Эксперимент показывает, что терапевтические дозы, полученные здоровыми мышиными тканями во время облучения, хорошо переносятся. В предыдущих экспериментах по изучению радиобиологических эффектов in vivo доза облучения мышей, получавших инъекции боркаптата BSH (200 мг/кг внутрибрюшинно), не превышала 5,7 гр-экв и составляла 2 гр-экв у мышей, не получавших BSH [9].
Наши эксперименты показали оптимальные дозы для мышей SCID, которые хорошо переносимы животными и при которых не возникают патологические структурные изменения в исследуемых тканях и органах. Настоящее исследование также подтверждает результаты предыдущего морфологического исследования, в котором обратимые изменения в костном мозге и тонком кишечнике мышей наблюдались на 2-й и 9-й дни после высоких доз нейтронного облучения [9].
В настоящее время научно-исследовательская группа физиков Института ядерной физики им. Г.И. Будкера решает сложную научно-техническую задачу создания компактного источника эпитермальных нейтронов на основе ускорителя заряженных частиц. Созданный в ИЯФ СО РАН ускорительный источник, использующий наилучшую реакцию для генерации эпитепловых нейтронов, привлекателен как по компактности, так и по стоимости. На ускорителе получен стационарный протонный пучок с необходимой энергией и с током, рекордным для электростатических ускорителей. Достигнутый прогресс на установке значительно опережает мировой уровень и является важнейшей предпосылкой для создания в России специализированного центра нейтронозахватной терапии.
Очевидной является необходимость проведения всех этапов исследований на ускорительном источнике. Для биологов создана уникальная возможность провести экспериментальные исследования радиобиологических эффектов нейтронного потока, а также эффективности БНЗТ с использованием различных препаратов.
Наши эксперименты с нормальными и опухолевыми клеточными линиями, облученными различными дозами, свидетельствуют о том, что негативные эффекты облучения пучком нейтронов в рекомендуемых дозах незначительны. Так, клеточные линии могут быть облучены при энергии протонов 2,0 МэВ с интегралом тока до 2,69 мА·ч без значимых негативных последствий.
Пороговая доза облучения животных на ускорительном источнике нейтронов составила 4,48 мА·ч при энергии протонов 2,0 МэВ. Эксперимент показал, что данная доза хорошо переносилась животными, а патологические структурные изменения в исследуемых тканях, подвергшихся облучению, не выявлялись. Однако при более высоких дозах облучения были отмечены обратимые изменения в тканях, преимущественно в тонком кишечнике и костном мозге.
Наши результаты позволили сделать вывод о том, что полученный пучок является безопасным и наилучшим образом соответствует требованиям БНЗТ.
Заключение
БНЗТ является перспективной технологией в связи с нерешенной проблемой лечения злокачественных опухолей, значительным прогрессом в разработке новых источников нейтронов и препаратов. Однако пока этот метод находится в экспериментальной стадии из-за сложности его реализации. До сих пор не выработано единого механизма передачи данных, полученных в ходе оценки биологического влияния БНЗТ на клеточные линии и опухолевые модели животных в отношении человека. Для широкого внедрения БНЗТ в практику необходимо провести ряд клинических испытаний на ускорительных источниках нейтронов, которые могли бы показать эффективность данного метода. Проблема недостаточной селективности доставки бора-10 к опухоли может быть решена с помощью инновационных препаратов или способов доставки, что позволит значительно увеличить градиент концентрации бора на границе опухоли и здоровой ткани. Но самым важным фактором, значимым для успеха БНЗТ в будущем, будет налаженное сотрудничество специалистов различных дисциплин.
Авторы выражают благодарность А.Н. Макарову, И.М. Щудло, Д.А. Касатову, Я.А. Колесникову, Е.О. Соколовой, А.М. Кошкареву, Т.А. Быкову за обеспечение генерации нейтронов.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-29-01007 и за счет гранта Российского научного фонда (проект № 19-72-30005) при поддержке Института ядерной физики СО РАН.
Библиографическая ссылка
Каныгин В.В., Кичигин А.И., Завьялов Е.Л., Разумов И.А., Симонович А.Е., Таскаев С.Ю. РАДИОБИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ПУЧКА УСКОРИТЕЛЬНОГО ИСТОЧНИКА НЕЙТРОНОВ В ИНСТИТУТЕ ЯДЕРНОЙ ФИЗИКИ ИМ. Г.И. БУДКЕРА СО РАН // Современные проблемы науки и образования. 2019. № 6. ;URL: https://science-education.ru/ru/article/view?id=29498 (дата обращения: 22.02.2026).
DOI: https://doi.org/10.17513/spno.29498



