На сегодняшний день антибиотикорезистентность является глобальной проблемой – не только общероссийской, но и общемировой [1]. Риск селекции антибиотикорезистентных штаммов в отделении повышается при частом и длительном применении антибиотиков [2]. Поэтому подбор антибиотикотерапии для таких пациентов является актуальной задачей, ее решению посвящено много исследовательских работ [3-5]. Согласно последним данным, риск селекции резистентных штаммов повышается при сопутствующей патологии (сахарный диабет, хроническая почечная и сердечная недостаточность, цирроз печени и т.д.), при предшествующих госпитализациях и применении антибактериальных препаратов, пребывании в домах длительного ухода, проведении инвазивных процедур [6]. Пациенты с сахарным диабетом с множественными осложнениями – практически всегда мультиморбидные [7]. Соответственно, эти группы попадают в группу риска неудачи антибактериальной терапии. Отделения, где концентрируются такие пациенты, - потенциальные потребители большого количества антибиотиков. Изучение закономерностей потребления антибактериальных препаратов в зависимости от профиля отделения и данных микробиологического мониторинга – первый шаг на пути к оптимизации политики потребления антимикробных препаратов в стационаре [8].
Огромное количество АМП на фармацевтическом рынке расширяет возможности фармакотерапии, но и требует от врача умения ориентироваться в вопросах микробиологии, клинической фармакологии и других смежных дисциплин.
В связи с этим особую важность приобретают результаты микробиологических и фармакоэпидемиологических исследований, а также анализ типичной стационарной практики [9].
Целью фармакоэпидемиологии является рациональное использование лекарственных препаратов. Международным стандартом потребления ЛП является DDD-анализ (Defined Daily Dose - установленная суточная доза) [10].
DDD – анализ, позволяющий оценить реальную тенденцию потребления ЛП в медицинской организации, что позволяет выявить проблемы, связанные с чрезмерным либо недостаточным использованием лекарственных препаратов [11]. На основании полученных результатов можно повысить качество использования препаратов, а также оценить эффективность предпринятых мер.
Данные о потреблении лекарственных препаратов могут представляться в виде ряда показателей, которые позволяют не только оценить назначения в конкретной медицинской организации, но и сопоставить потребление лекарственных препаратов между медицинскими организациями и регионами, а также соотнести реальную практику назначения и потребления лекарственных препаратов с клиническими рекомендациями.
Для всесторонней оценки рациональности фармакотерапии разные виды анализа фармакоэпидемиологических данных могут использоваться как по отдельности, так и в комплексе в зависимости от приоритетной цели исследования, отражая различные стороны использования лекарственных препаратов.
Каждый из видов анализа несет соответствующую информацию. Фармакоэпидемиологический мониторинг практики назначения и потребления лекарственных препаратов позволяет провести оценку качества лекарственной терапии и является основанием для принятия управленческих решений в сфере лекарственного обеспечения [12].
Цель исследования – изучение потребления антибактериальных препаратов резерва в отделениях многопрофильной больницы, соотнесение результатов с данными микробиологического мониторинга, разработка возможных путей оптимизации антибиотикотерапии.
Материал и методы исследования Исследование выполнено на базе многопрофильного стационара г. Н. Новгорода на 200 коек, оказывающего как терапевтическую, так и высокотехнологичную хирургическую помощь. Изучалось потребление антибактериальных препаратов резерва, назначаемых решением врачебной комиссии с участием клинического фармаколога, за 2017 г. К антибактериальным препаратам резерва были отнесены: пиперациллин/тазобактам, цефоперазон/сульбактам, цефепим и цефтазидим, респираторные фторхинолоны, карбапенемы, гликопептиды, оксалидиноны, полимиксины, глицилциклины, а также все инъекционные системные антимикотики (эхинокандины, вориконазол, флуконазол).
Исследование потребления антибактериальных препаратов проведено с помощью DDDs – анализа, рассчитанного по рекомендованной ВОЗ методике. DDD-анализ – метод фармакоэпидемиологического анализа, позволяющий оценить уровень потребления лекарственных средств. Метод основан на расчете количества использованных средних суточных доз лекарственного средства (DDDs) за анализируемый период времени относительно 100 койко-дней в стационаре [12].
Произведен также анализ микробных патогенов, выделенных в отделениях центра. Для обработки материала использовали программу WHONET 5.4. Намечены пути оптимизации антибиотикотерапии.
Количественная обработка материала проведена при помощи математического комплекса методик, находящихся в программном обеспечении электронных таблиц Excel. В
работе использовали методы описательной статистики с оценкой значимости различий показателей по t-критерию Стьюдента и расчетом погрешностей непосредственных измерений.
Результаты исследования и их обсуждение Выявлено, что наибольшее количество антибактериальных препаратов резерва потребляется в отделении трансплантации органов - DDD составило 1936, при общем объеме потребленных доз 5015. Таким образом, отделение трансплантации органов за год потребило более одной трети от всех антибактериальных препаратов резерва. В урологических отделениях уровень потребления составил 1127 и 740 DDD соответственно, в онкологическом хирургическом отделении – 784 DDD. В гинекологическом отделении уровень потребления антибиотиков резерва составил 107 DDDs, в отделениях терапии – 208 и 81 DDD соответственно, в отделении рентгенохирургических методов лечения – 32 DDD (рис. 1).
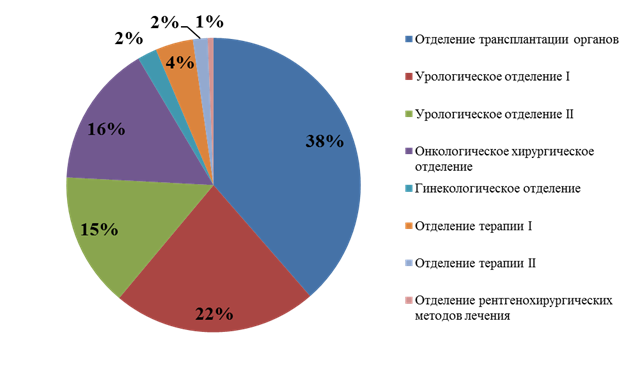
Рис. 1. Структура потребления антибактериальных препаратов резерва (DDDs) в зависимости от отделений в медицинской организации за расчетный период
При анализе микробиологического пейзажа выявлено, что в целом по стационару преобладает грамотрицательная флора (60%) (рис. 2).
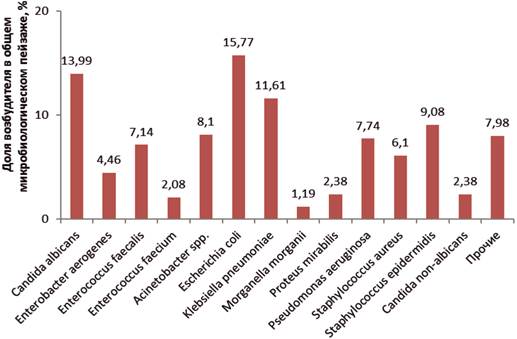
Рис. 2. Структура микробиологического пейзажа в 2017 г. по стационару
В микробиологическом пейзаже лидируют Esheriсhia coli, Klebsiella pneumoniae, Klebsiella oxytoca, грибы рода Candida. Значительную нишу занимают также энтерококки и стафилококки. Реже регистрируются Enterobacter aerogenes, Pseudomonas aeruginosa, что является относительно благоприятной тенденцией. Небольшой вклад вносят Proteus, Morganella.
В ходе оценки резистентности Esheriсhia coli отмечена чувствительность возбудителя к карбапенемам (рис. 3).
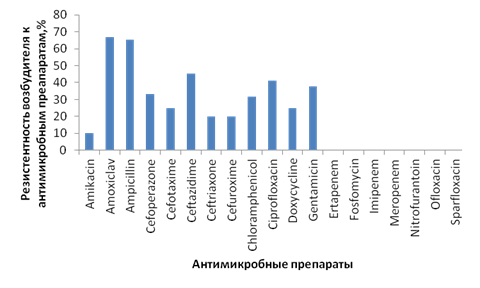
Рис. 3. Резистентность Esheriсhia coli к антимикробным препаратам
Относительно Klebsiella pneumoniae отмечается достаточно высокая резистентность к большинству антимикробных препаратов (рис. 4).
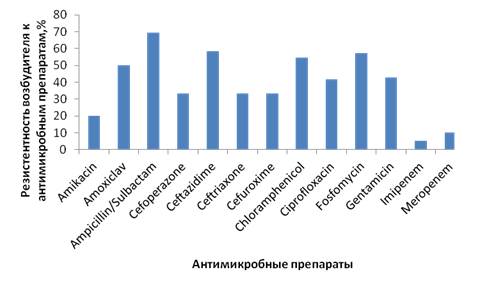
Рис. 4. Резистентность Klebsiella pneumoniae к антимикробным препаратам
Несмотря на то что Acinetobacter spp. не является лидером (он выявляется в 8,1% случаев), нельзя не учитывать, что инфекции, вызванные этим возбудителем, являются, как правило, сложными для терапии из-за проблемного профиля устойчивости данного патогена (рис. 5) [6].
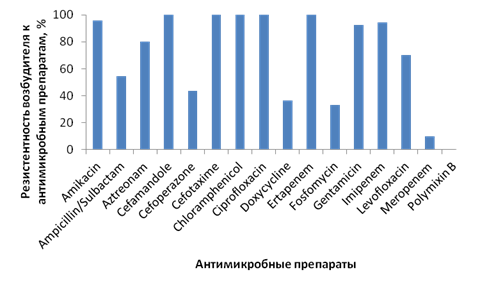
Рис. 5. Резистентность Acinetobacter baumanii к антимикробным препаратам
В отделении трансплантации органов значительную микробиологическую нишу занимают грибы рода Candida, Klebsiella pneumoniae, Klebsiella oxytoca, Esheriсhia coli, неферментирующие микроорганизмы. При анализе микробной резистентности выявлены штаммы с высоким и экстремальным уровнем устойчивости к антибиотикам, а также грибы рода Candida, устойчивые к флуконазолу. Около 70% штаммов семейства Enterobacteriaceae вырабатывали бета-лактамазы расширенного спектра, что обусловливало их устойчивость к целому ряду антибактериальных препаратов: цефалоспоринам I–III поколений, амоксициллину/клавуланату, ципрофлоксацину, аминогликозидам. Выделялись также карбапенемрезистентные возбудители инфекций, требующие терапии тигециклином, полимиксином в комбинации с азтреонамом и аминогликозидами.
В онкологическом и урологических отделениях имели место сходные закономерности, однако уровень продуцентов бета-лактамаз расширенного спектра в среднем составлял не более 60%, доля карбапенемрезистентных грамотрицательных возбудителей ограничивалась единичными штаммами.
Наиболее благоприятный микробиологический пейзаж имел место в гинекологическом и терапевтическом отделениях, а также в отделении рентгенохирургических методов лечения. Здесь превалировала грамположительная флора, доля метициллинрезистентных стафилококков составила не более 15%. Таким образом, для терапии пациентов данных отделений оптимально назначение антибиотикопрепаратов первого ряда: пенициллинов, цефалоспоринов I–III поколений, ципрофлоксацина, офлоксацина. Не рекомендовано начинать терапию с препаратов резерва. Выявленная закономерность, очевидно, связана с характером выполняемых операций (более обширные и тяжелые операции выполняются в отделении трансплантации органов, урологическом и онкологическом отделении), преморбидным статусом пациента (в отделении трансплантации органов оперативному вмешательству всегда предшествует тяжелое хроническое заболевание), иммуносупрессией, длительностью койко-дня.
Выводы
Потребление антибактериальных препаратов коррелирует с данными микробиологического мониторинга в отделениях. Преобладание проблемной грамотрицательной флоры ассоциировано с более высоким уровнем потребления антибиотиков. Схемы стартовой антимикробной терапии следует разрабатывать для каждого отделения индивидуально.
Библиографическая ссылка
Руина О.В., Жукова О.В., Хазов М.В., Борисов В.И., Мельниченко О.В., Новикова Р.А., Гнучина Д.С., Хорошавина Е.С. ВЗАИМОСВЯЗЬ ПОТРЕБЛЕНИЯ АНТИБИОТИКОВ И ЛОКАЛЬНОЙ МИКРОБИОТЫ // Современные проблемы науки и образования. 2020. № 1. ;URL: https://science-education.ru/ru/article/view?id=29488 (дата обращения: 08.02.2026).
DOI: https://doi.org/10.17513/spno.29488



