В настоящее время большинство исследователей сходятся во мнении, что избыточная внутрипочечная экспрессия компонентов ренин-ангиотензиновой системы (РАС) приводит к гипертонии [1, 2], при этом циркулирующая и локальная РАС могут независимо регулировать гомеостаз артериального давления [3] или быть ассоциированы [4]. Однако показано, что нарушения локальной экспрессии компонентов РАС сопряжены с опухолевым ростом в почках [5, 6]. Так, повышенная тканевая экспрессия ангиотензинрегулирующих ферментов (АПФ и АПФ2) сопряжена с агрессивностью почечно-клеточного рака [7]. Выявлены достоверные корреляции между риском развития рака почки и нарушениями в генах, регулирующих артериальное давление: ангиотензиногена [8] и рецептора ангиотензина первого типа [9]. Показано, что содержание ангиотензина 2 и активность ангиотензинпревращающих ферментов на системном уровне сопряжены с опухолевым ростом в почке [10]. При этом некоторые авторы обнаружили разнонаправленную корреляцию активности АПФ с агрессивностью почечно-клеточного рака: положительную с тканевой экспрессией и отрицательную с уровнем в сыворотке крови [11]. Тканевая экспрессия АПФ2 достоверно выше в агрессивных опухолях у пациентов раком почки с плохим прогнозом, тогда как в сыворотке крови сопряженности с прогнозом заболевания не выявлено [12]. Таким образом, на сегодняшний день остаются нерешенными вопросы: участвуют ли местногенерируемые компоненты РАС в патогенезе рака почки и артериальной гипертензии и работает ли местная РАС самостоятельно или представляет собой расширение системной РАС?
Цель исследования: оценить взаимосвязь уровня компонентов ренин-ангиотензиновой системы в ткани опухоли и периферической крови у больных локализованным раком почки (РП) на фоне артериальной гипертензии.
Материалы и методы исследования. Работа выполнена в отделении онкоурологии ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России, МБУЗ КДЦ «Здоровье», г. Ростов-на-Дону, в 2016–2018 гг. Исследование одобрено Локальным независимым этическим комитетом ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России. Все больные подписали информированное добровольное согласие на использование биологического материала в научных целях.
Критериями включения пациентов в исследование служили первично выявленный локализованный рак почки Т1N0M0 без специального лечения, артериальная гипертензия I–II степени без специального лечения, возраст от 35 до 65 лет. Сопутствующая сердечно-сосудистая и эндокринная патология, зрелый возраст пациента были критериями исключения из исследования. Все исследуемые были разделены на группы: больные раком почки без нарушения артериального давления (n=35, РП) и больные раком почки и артериальной гипертензией (n=30; РП+АГ). Нормативные значения исследованных показателей периферической крови выявляли у практически здоровых лиц аналогичного возраста (здоровые доноры, n=30).
При проведении робот-асcистированной резекции почки у пациентов забирали образцы тканей: опухолевой (ОП), перитуморальной (ПТТ, в пределах 10 мм от видимого края опухоли отсечением конусовидных кусочков 0,5х0,3 см) и гистологически не измененной тканей (ГНТ, на расстоянии 10–15 мм от видимого края опухоли). Периферическую венозную кровь собирали у пациентов за сутки до оперативного вмешательства в вакутейнер с активатором свертывания для исследования сыворотки крови. Уровень пептидов ангиотензина 1 (АТ1), ангиотензина 2 (AT2), ангиотензина (1–7) – АТ(1–7), а также ангиотензинпревращающих ферментов (АПФ и АПФ2) определяли методом ИФА.
Статистический анализ результатов исследования проводился с помощью программы STATISTICA 10.0 (StatSoft Inc., США). Достоверность различий средних величин независимых выборок оценивали с помощью непараметрического критерия Манна–Уитни. Корреляционный анализ по Спирмену проведен с оценкой статистической значимости коэффициента корреляции.
Результаты исследования и их обсуждение. В опухолевых тканях группы РП уровень большинства изученных пептидов и ферментов РАС был повышен в сравнении с ГНТ: АТ1 и АТ2 – в 1,5 и 1,6 раз соответственно, АПФ и АПФ2 – в 2,7 раза и в 1,6 раза соответственно (во всех случаях р<0,05) (рис. 1). В перитуморальной ткани содержание пептидов и активность ферментов РАС были идентичны показателям в ГНТ, не было выявлено статистически значимых различий. Содержание АТ(1–7) в опухолевой и перитуморальной тканях больных РП было идентично его уровню в ГНТ.
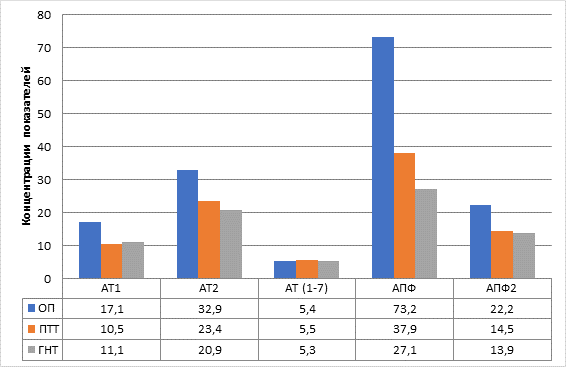
Рис. 1. Компоненты локальной РАС в опухолевых тканях больных раком почки.
Условные обозначения: ОП – ткань опухоли, ПТТ – перитуморальная ткань,
ГНТ – гистологически не измененная ткань. Указаны медианы выборочных показателей:
АТ1 – ангиотензин 1 (пг/г ткани), АТ2 – ангиотензин 2 (пг/г ткани), АТ(1–7) – ангиотензин 1-7 (пг/г ткани), АПФ – ангиотензинпревращающий фермент (нг/г ткани),
АПФ2 – ангиотензинпревращающий фермент 2 (нг/г ткани)
В опухолевых тканях группы пациентов с РП с артериальной гипертензией также уровень изученных компонентов РАС был выше значений в ГНТ (рис. 2). Так, содержание пептидов было увеличено в 1,8 раза, 2,1 раза и 1,6 раза для АТ1, АТ2 и АТ(1–7) соответственно (во всех случаях р<0,05), а активность ангиотензинпревращающих ферментов – в 3,6 и 2,9 раза соответственно для АПФ и АПФ2 (р<0,05 и р<0,01). Интересно отметить, что в перитуморальных тканях РП на фоне АГ показано увеличенное образование изученных компонентов РАС в сравнении с соответствующими тканями пациентов без АГ. Уровень АТ1 был увеличен в 1,6 раза (p<0,01), АТ2 – в 1,9 раза (p<0,05), активность ангиотензинрегулирующих ферментов статистически не отличалась (p>0,05) от показателей в опухоли почки. Только содержание АТ(1–7) в окружающей опухоль ткани было ниже (p<0,05) и соответствовало показателю в ГНТ.
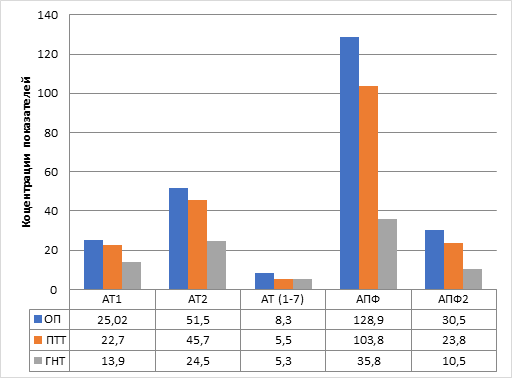
Рис. 2. Компоненты локальной РАС в опухолевых тканях больных раком почки и артериальной гипертензией
Условные обозначения: ОП – ткань опухоли, ПТТ – перитуморальная ткань, ГНТ – гистологически не измененная ткань. Указаны медианы выборочных показателей: АТ1 – ангиотензин 1 (пг/г ткани), АТ2 – ангиотензин 2 (пг/г ткани), АТ(1–7) – ангиотензин (1–7) (пг/г ткани), АПФ – ангиотензинпревращающий фермент (нг/г ткани), АПФ2 – ангиотензинпревращающий фермент 2 (нг/г ткани).
При исследовании сывороточного уровня показателей РАС были выявлены изменения в обеих исследованных группах (табл. 1). Сывороточное содержание изученных пептидов РАС было повышено в сравнении с показателями у здоровых доноров, но имело межгрупповые различия. Уровень АТ1 превышал контрольные показатели в 1,7 раза (группа РП) и 2,8 раза (группа РП+АГ). Образование АТ2 было также выше в группе РП+АГ в сравнении с РП (2,2 раза против 1,7 раза при р<0,05). Содержание АТ(1–7) достоверно превышало показатели в здоровой ткани (в среднем в 1,3 раза, р<0,05) и преобладало в группе РП+АГ. При этом повышенная активность циркулирующих ферментов была выявлена только для больных раком почки на фоне артериальной гипертензии. Их активность была увеличена по сравнению со значениями у здоровых доноров в 1,5 раза (р<0,05 ) и 1,7 (р<0,05) для АПФ и АПФ2 соответственно.
Таблица 1
Содержание компонентов РАС в периферической крови пациентов исследуемых групп (Ме [25-й; 75-й перцентили])
|
Показатели |
Группы |
||
|
РП |
РП+АГ |
Здоровые доноры |
|
|
АТ1, нг/мл |
2,31* [0,93; 5,57] |
3,72* [1,56; 7,23] |
1,35 [0,45; 4,11] |
|
АТ2, пг/мл |
12,48* [9,29; 15,45] |
16,29* [12,31; 22,97] |
7,42 [6,31;8,45] |
|
АТ (1-7), пг/мл |
3,76* [1,13; 6,38] |
3,93* [1,21; 6,54] |
3,12 [0,93; 5,57] |
|
AПФ, нг/мл |
6,76 [2,16; 8,89] |
8,95* [3,13; 11,87] |
5,96 [1,96; 8,57] |
|
AПФ2, нг/мл |
5,11 [0,99; 6,27] |
7,94* [2,59; 9,76] |
4,81 [0,93; 5,57] |
Примечание:* – статистически значимые различия в сравнении с группой здоровых доноров при р<0,05
В таблице 2 отражены результаты оценки парных корреляций между содержанием показателей опухолевой РАС и сыворотки крови пациентов у больных локализованным раком почки. Результаты проведенного корреляционного анализа свидетельствуют о статистической связи показателей активности большинства исследованных компонентов РАС в сыворотке крови и злокачественно трансформированных тканях (табл. 2).
Таблица 2
Коэффициенты парных корреляций между показателями ренин-ангиотензиновой системы в сыворотке крови и исследованных тканях больных раком почки
|
Исследованные ткани |
AT1 |
AT2 |
AT (1–7) |
АПФ |
АПФ2 |
|
ГРУППА РП |
|||||
|
n=35 |
Сыворотка крови |
||||
|
ОП |
0,78* |
0,64* |
0,56* |
0,24 |
0,55* |
|
ПТТ |
0,65* |
0,59* |
0,51* |
0,17 |
0,65* |
|
ГРУППА РП+АГ |
|||||
|
n=30 |
Сыворотка крови |
||||
|
ОП |
0,85* |
0,72* |
0,65* |
0,21 |
0,61* |
|
ПТТ |
0,81* |
0,74* |
0,59* |
0,23 |
0,52* |
Примечание: * – статистически значимые коэффициенты корреляции при р<0,05
У пациентов РП и РП+АГ сывороточное содержание пептидов РАС имеет положительные статистические связи с соответствующими показателями в опухолевой и перитуморальной тканях. Однако в группе РП+АГ обнаруженные корреляции имеют тесноту более высокой силы. Статистически значимой взаимосвязи активности АПФ в сыворотке крови и в опухолевых и окружающих тканях не обнаружено ни в одной из исследованных групп. При этом активность другого ангиотензин-регулирующего фермента (АПФ2) коррелировала в сыворотке крови и исследованных тканях со средней силой.
Анализ активности тканевой РАС показал повышенное локальное образование пептидов и ферментов в опухолевых и перитуморальных тканях рака почки, причем более выраженное в перитуморальных тканях пациентов с сопутствующей артериальной гипертензией. В некоторых исследованиях показано, что местногенерируемая РАС играет роль в почечно-клеточном канцерогенезе [12–14]. АПФ2 в основном расщепляет ангиотензин 2 до ангиотензина (1–7), опосредующего свою протекторную активность через рецептор Mas, чья продукция при определенных видах рака не регулируется [15]. Гиперпродукция составляющих «защитной оси» РАС в опухолевых тканях рака почки, по-видимому, свидетельствует о стимуляции роста и пролиферации почечных клеток ангиотензином (1–7), который может проявлять такие свойства в условиях активации локальной РАС или через другой рецепторный путь [16].
Уровень всех изученных пептидов РАС в сыворотке крови больных локализованным раком почки был увеличен в сравнении со здоровыми донорами вне зависимости от сопутствующей артериальной гипертензии, а активность обоих циркулирующих ангиотензинпревращающих ферментов, напротив, была повышена только у больных с сопутствующей гипертензией. Важно отметить, что как в опухолевой и перитуморальной (особенно) ткани, так и циркулирующая РАС имеет более высокую активность у больных раком почки на фоне артериальной гипертензии. В экспериментальных и клинических исследованиях гипертонии показаны увеличенная экспрессия почечного ангиотензиногена, АПФ и рецептора ангиотензина 1, а также активация почечного РАС, вызванная инфузией ангиотензина II или ингибированием синтеза оксида азота [17]. Предполагают, что активация почечной РАС является «тревожным» ответом на стимул, а не физиологическим процессом [3].
Заключение. Таким образом, проведенное исследование обнаружило повышение активности ренин-ангиотензиновой системы у больных раком почки как на уровне локального синтеза, так и на системном уровне, что позволяет предполагать патогенетическую роль РАС в злокачественной трансформации почечных клеток. Усиление выявленных нарушений местной РАС у гипертензивных больных раком почки может свидетельствовать о ее участии в патогенезе артериальной гипертензии. Обнаруженные положительные корреляции уровня местногенерированных опухолевых показателей РАС с их циркулирующими аналогами указывают на возможность использования показателей РАС для создания диагностических и скрининговых панелей развития рака почки. Дальнейшие исследования патогенетической роли компонентов РАС в развитии и прогрессировании почечно-клеточного рака будут способствовать разработке способов прогноза течения и мониторинга противоопухолевой терапии данной нозологии.
Библиографическая ссылка
Осокин Р.А., Комарова Е.Ф., Абоян И.А., Максимов А.Ю., Ищенко Р.В., Шатова О.П., Комарова Е.Ю. СОПРЯЖЕНИЕ ОПУХОЛЕВОЙ И СИСТЕМНОЙ ЭКСПРЕССИИ КОМПОНЕНТОВ РЕНИН-АНГИОТЕНЗИНОВОЙ СИСТЕМЫ У ГИПЕРТЕНЗИВНЫХ БОЛЬНЫХ РАКОМ ПОЧКИ // Современные проблемы науки и образования. 2019. № 6. ;URL: https://science-education.ru/ru/article/view?id=29447 (дата обращения: 22.02.2026).
DOI: https://doi.org/10.17513/spno.29447



