Зависимость большинства процессов жизнедеятельности организма от температуры окружающей среды делает температурные воздействия важнейшим фактором экологии, который может иметь решающее значение для выживания человека. С воздействием низких и сверхнизких температур человеку часто приходится встречаться при работе на различных производствах, а также в силу проживания – в некоторых климатических зонах. При этом пребывание организма в условиях гипотермического воздействия может приводить к значительным метаболическим и функциональным изменениям.
В условиях гипотермии печень как орган, вносящий значительный вклад в термопродукцию, играет очень важную роль [1–3]. За счет сложных биохимических реакций этот орган способен обеспечивать приспособляемость организма к сложным условиям существования. Печень обеспечивает пластические и энергетические процессы, а также регулирует адаптивные компенсаторно-приспособительные процессы, происходящие при воздействии всех экзогенных и эндогенных неблагоприятных процессов, и эта регуляция осуществляется даже тогда, когда повреждающие факторы не обладают выраженным гепатотропным эффектом [4]. Поэтому морфофункциональное состояние печени является отражением не только функционального состояния самого органа, но и реакции организма в целом.
Морфологические изменения органов человека и животных при воздействии неблагоприятных экзогенных факторов широко изучаются в последние годы [5–7]. Однако гистоструктура печени при воздействии гипотермии исследована лишь в ряде работ [8, 9], полученные данные противоречивы. Это касается, в частности, особенностей реакций гепатоцитов на холодовой фактор, характеристики числа двуядерных гепатоцитов и реакции ядер клеток печени в целом [10, 11].
Таким образом, сведения о влиянии гипотермии на гистоструктуру печени немногочисленны, а вопросы морфологии клеточного ядра гепатоцитов освещены недостаточно, поэтому необходимо проведение более детального изучения динамики морфологических изменений, происходящих в ядрах гепатоцитов при действии холодового фактора.
Цель исследования: проанализировать динамику патоморфологических изменений состояния ядер клеток печени крыс породы Вистар после воздействия однократной глубокой иммерсионной гипотермии.
Материалы и методы исследования
Исследование было проведено на 15 самцах крыс линии Вистар массой 200–250 граммов. Животных (n = 10) подвергали однократной глубокой водной (иммерсионной) гипотермии, которую моделировали помещением экспериментальных животных в индивидуальных клетках в воду температурой 5°С при температуре окружающей среды 7°С. Когда животные достигали глубокой степени гипотермии, воздействие холодового фактора прекращали. Критерием достижения глубокой степени гипотермии являлась ректальная температура 20–25°С. Время воздействия холодового фактора в среднем составляло 40±5 мин. Непосредственно сразу после прекращения охлаждения животные выводились из эксперимента декапитацией. Контрольную группу составляли 5 крыс, которых в индивидуальных клетках помещали в воду температурой 30°С при температуре окружающей среды 22–25°С.
Для гистологического исследования кусочки ткани печени фиксировали в течение 24 часов в 10%-ном растворе нейтрального формалина, после проводили обработку препаратов в автомате TISSUE-TEK VIPTM6 (Sakkura, Nagano Japan) с последующей заливкой в парафин в станции парафиновой заливки TISSUE-TEK TEC 5 (Sakkura, Nagano, Japan). На роторном микротоме Accu-Cut SRM (Sakkura, Китай) изготавливали срезы толщиной 5–7 мкм. В автостейнере TISSUE-TEK Prisma (Sakkura, Nagano, Japan) препараты окрашивали гематоксилин-эозином.
Для определения плоидности ядер гепатоцитов препараты окрашивали методом Фельгена с использованием холодного гидролиза в 1н. HCl в течение 1 часа 30 минут. Среднее содержание ДНК в ядре малого лимфоцита принимали за диплоидное значение (2с). Плодометрические измерения осуществляли в сертифицированной морфометрической программе ВидиоТест-Морфология 5.2. («ВидиоТест», Санкт-Петербург) с помощью специализированных модулей «Стандарт» и «Плоидность». Строили гистограммы распределения гепатоцитов по индексу накопления ДНК (ИНДНК) в ядре.
Для выявления гетерохроматина гистологические срезы окрашивали в 2%-ном растворе орсеина на 45%-ном растворе уксусной кислоты в течение 30 минут. Затем препараты фотографировали при помощи микроскопа Leica DM 750 E200 (Германия) с цифровой видеокамерой Leica EC3 (Германия) при увеличении х1000. Определяли среднее количество гранул гетерохроматина на 1 ядро, их локализацию и высчитывали содержание доли гетерохроматина от общей площади ядра клетки. Исследовали не менее 25–30 ядер клеток.
Окрашивание ядрышковых организаторов (AgNOR) проводили по двухступенчатому методу Daskal Y. et al. в нашей модификации [12]. Под масляной иммерсией микроскопа при увеличении х1000 высчитывали число ядрышек, площадь одного ядрышкового организатора и ядерно-ядрышковое соотношение в относительных единицах (отн. ед.).
Статистическую обработку полученных данных проводили с помощью пакета статистических программ Statistica 10.0. и пакета статистического анализа программы MS EXСEL 2010. Для каждой из полученных величин высчитывали среднее (M) и ошибку среднего (m). Гипотеза о нормальности распределения вероятности данных проверялась с помощью критерия Шапиро–Уилка. Достоверность данных оценивалась с помощью параметрического критерия t-теста Стьюдента. Критическое значение уровня статистической значимости было равно 0,05.
Результаты исследования и их обсуждение
Контрольная группа. Морфологический анализ структуры ядер клеток печени животных контрольной группы позволил выявить следующее. Большинство гепатоцитов было одноядерными (79±1,5%), процент содержания двуядерных клеток составил 21±1,5%. При плоидометрическом исследовании ядер ИНДНК в среднем составил 3,9с±0,2. Ядра были представлены шестью уровнями плоидности: клонов клеток с ИНДНК 2с было 3,2%, 3с – 30%; 4c – 50%; 5c – 6,7%; 6c – 6,7% и 8с – 3,4% (табл.) (рис. 1).
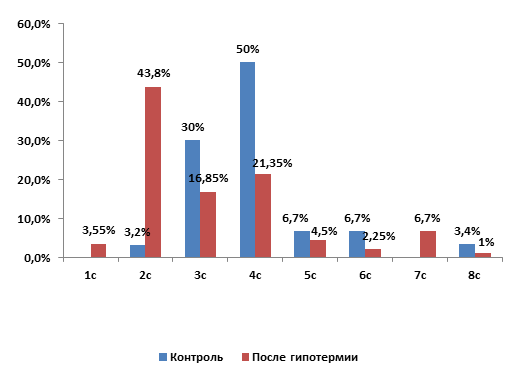
Рис. 1. Гистограмма, характеризующая ИНДНК в группе контроля и при гипотермии.
По оси абсцисс – ИНДНК; по оси ординат – процентное содержание клеток
Морфометрические и морфофункциональные параметры ядер гепатоцитов при гипотермии в сравнении с группой контроля (М±m)
|
Параметры |
Контроль |
Гипотермия |
Достоверность (p) |
|
ИНДНК (с) |
3,9±0,2 |
3,2±0,2 |
р = 0,8 |
|
Площадь ядра (мкм) |
24,2±1,2 |
10,4±0,5 |
p = 0,0000001 |
|
Периметр ядра (мкм) |
17,6±0,4 |
11,5±0,25 |
p = 0,0000001 |
|
Диаметр ядра (мкм) |
5,6±0,4 |
3,6±0,1 |
p = 0,0000001 |
|
Фактор круга (отн. ед.) |
0,969±0,002 |
0,951±0,003 |
p = 0,003 |
|
Фактор эллипса (отн. ед.) |
0,999±0,0002 |
0,997±0,0002 |
p = 0,0001 |
|
Фактор удлиненности ядра (отн. ед.) |
1,18±0,02 |
1,26±0,02 |
p = 0,03 |
|
Число AgNORs на 1 ядро |
3,4±0,2 |
1,2±0,1 |
p = 0,0000001 |
|
Суммарная площадь AgNORs на 1 ядро (мкм2) |
7,9±0,3 |
2,7±0,2 |
p= 0,0000001 |
|
Площадь 1 AgNORs (мкм2) |
2,3±0,1 |
2,1±0,1 |
p = 0,2 |
|
Ядрышко-ядерное соотношение (отн. ед.) |
0,11±0,004 |
0,11±0,01 |
p = 0,9 |
|
Число одноядерных гепатоцитов (%) |
79±1,5 |
91,8±0,8 |
p = 0,00007 |
|
Число двуядерных гепатоцитов (%) |
21±1,5 |
8,2±0,8 |
p = 0,00007 |
|
Число гранул гетерохроматина |
4,7±0,4 |
10,1±1,1 |
p = 0,0003 |
|
Доля гетерохроматина от общей площади ядра (%) |
12,7±0,5 |
37,2±2,0 |
p = 0,0000001 |
Примечание: полужирным шрифтом обозначены достоверные данные.
Гетерохроматин в ядрах клеток содержался в малом количестве, наиболее крупные его блоки приходились на околоядрышковую зону. Вдоль кариолеммы локализовалось небольшое количество гетерохроматина (рис. 2). Среднее количество гранул гетерохроматина составило 4,7±0,4 на 1 ядро, содержание гетерохроматина от общей площади ядра составило 12,7±0,5% (табл.).
При морфометрическом исследовании средняя площадь ядра составила 24,2±1,2 мкм2, периметр – 17,6±0,4 мкм, диаметр – 5,6±0,4 мкм, фактор круга – 0,969±0,002 отн. ед., фактор эллипса – 0,999±0,0002 отн. ед. и фактор удлиненности ядра – 1,18±0,02 отн. ед. (рис. 3).
При гистохимическом выявлении ядрышковых организаторов (AgNOR) ядрышки выявлялись на фоне желтой нуклеоплазмы в виде четко видимых черных гранул. Большинство AgNORs локализовались в центре ядра. Среднее число AgNORs составило 3,4±0,2 на 1 ядро. Средняя суммарная площадь AgNORs на 1 ядро составила 7,9±0,3 мкм2. Средняя площадь 1 AgNORs составила 2,3±0,1 мкм2. Ядерно-ядрышковое соотношение составило 0,11±0,005 отн. ед.
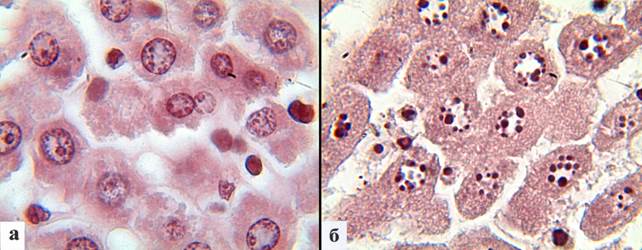
Рис. 2. Окраска печени крыс на гетерохроматин: а – небольшое число гранул гетерохроматина в ядрах гепатоцитов в норме; б – большое количество гранул гетерохроматина в гепатоцитах после воздействия гипотермии. Окраска ацетоорсеином. Увеличение х1000
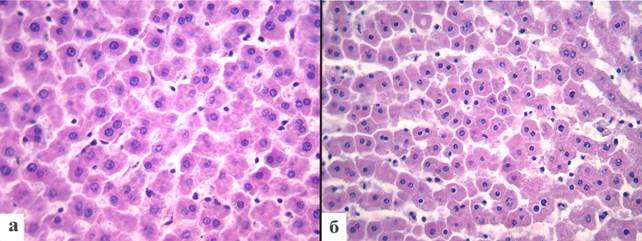
Рис. 3. Морфология ядер клеток гепатоцитов: а – ядра гепатоцитов в группе контроля; б – уменьшение размеров ядер клеток печени после воздействия гипотермии. Окраска гематоксилином и эозином. Увеличение х400
Гипотермия. После воздействия гипотермии число одноядерных клеток в печени экспериментальных животных возрастало на 14% (91,8±0,8%), а процент двуядерных печеночных клеток уменьшался в 2,6 раза (8,2±0,8%). Гипотермия вызывала снижение ИНДНК в ядрах гепатоцитов до 3,2с±0,2. При этом гистограмма распределения клонов клеток по ИНДНК принимала совершенно иной вид: появлялись гепатоциты с плоидностью ядра 1с (3,55%); число клеток с ИНДНК 2c увеличивалось до 43,8%; количество гепатоцитов с ИНДНК 3с уменьшалось до 16,85%, число клеток с ИНДНК 4c снижалось до 21,35%, с 5с до 4,5%, с 6с до 2,25% и с 8с до 1% (табл.) (рис. 1).
Число гранул транскрептивно неактивного гетерохроматина в кариоплазме по сравнению с контрольной группой возрастало в 2,15 раза и составило 10,1±1,1 на 1 ядро, а доля гетерохроматина от общей площади ядра по сравнению с контролем увеличивалась в 2,9 раза и составляла 37,2±2,0% (табл.). При этом гетерохроматин формировал крупные агрегаты и локализовался исключительно вдоль кариолеммы (рис. 2).
Ядра гепатоцитов крыс опытной группы варьировали по размеру. Кариометрические измерения позволили выявить, что средняя площадь ядер уменьшалась в 2,3 раза и составила 10,4±0,5 мкм2, периметр ядер уменьшался в 1,5 раза и составил 11,5±0,25 мкм, диаметр ядер снижался в 1,5 раза и был равен 3,6±0,1 мкм (рис. 3). Также изменялась форма ядра: уменьшались показатели фактора круга и фактора эллипса, которые составили 0,951±0,003 отн. ед. и 0,997±0,0002 отн. ед. соответственно, а фактор удлиненности ядра при этом возрастал на 6,4% до 1,26±0,02 отн. ед (табл.).
При оценке активности ядрышковых организаторов в ядрах гепатоцитов экспериментальных животных в большинстве случаев отмечали маргинальное расположение ядрышек. При этом среднее количество AgNORs уменьшалось в 2,8 раза и составило 1,2±0,1 на 1 ядро. Средняя суммарная площадь AgNORs на 1 ядро была меньше в 2,9 раза и составила 2,7±0,2 мкм2. Средняя площадь 1 AgNORs составила и ядерно-ядрышковое соотношение достоверно не отличались от группы контроля и составили 2,1±0,1 мкм2 и 0,11±0,01 отн. ед. соответственно (табл.).
Заключение
Таким образом, результаты проведенного исследования показали, что воздействие холодового фактора оказывало выраженное повреждающее воздействие на ядра клеток печени экспериментальных животных. При этом отмечали выраженные морфологические изменения, которые заключались в уменьшении числа двуядерных гепатоцитов, снижении морфометрических параметров ядер, увеличении доли гетерохроматина в ядре, снижении ИНДНК и уменьшении числа нуклеол, с возникновением явлений сегрегации ядрышек. Выявленные изменения, по нашему мнению, являются следствием метаболической депрессии гепатоцитов. Снижение числа двуядерных гепатоцитов было связано с угнетением регенераторной способности печени. Ответная реакция генома, направленная на поддержание числа полиплоидных клеток, проявляемая на уровне бинуклеолярности, отличалась недостаточной интенсивностью: процент двуядерных гепатоцитов не достигал контрольных значений. Как известно, дезорганизация ядерного хроматина с увеличением доли содержания гетерохроматина отражает ингибирование матричных и синтетических процессов в ядрах клеток. Также изменение структуры ядерного матрикса и хроматина является следствием повреждения ДНК и может быть отражением программированной гибели гепатоцитов, что в нашем исследовании подтверждалось наличием явлений кариопикноза, снижением ИНДНК, увеличением количества эуплоидных гепатоцитов с ИНДНК 2с и появлением гипоплоидных клонов с ИНДНК 1с. В ряде работ показано, что размер и число ядрышек в гепатоцитах объективно отражают напряженность рибосомального синтеза и пролиферативной активности ткани печени при различных патологиях [13–15]. В данном исследовании воздействие гипотермии вызывало уменьшение числа и сегрегацию ядрышек, что приводило к угнетению сборки прерибосомальных субъединиц и инактивации белоксинтетической функции рибосом. Понижение температуры окружающей среды вызывало изменение формы ядра, что могло происходить вследствие активизации перекисного окисления липидов, повреждения клеточной мембраны и нарушения ионного гомеостаза. Поэтому возрастание такого кариометрического параметра, как фактор удлиненности, при воздействии холодового фактора может служить критерием повреждения клеточного ядра.
Библиографическая ссылка
Бобров И.П., Лепилов А.В., Крючкова Н.Г., Долгатов А.Ю., Гулдаева З.Н., Орлова О.В., Шепелева Н.В., Лушникова Е.Л., Бакарев М.А., Молодых О.П. МОРФОФУНКЦИОНАЛЬНАЯ ХАРАКТЕРИСТИКА ЯДЕР ГЕПАТОЦИТОВ ПЕЧЕНИ КРЫС ПОСЛЕ ВОЗДЕЙСТВИЯ ГИПОТЕРМИИ // Современные проблемы науки и образования. 2019. № 6. ;URL: https://science-education.ru/ru/article/view?id=29375 (дата обращения: 22.12.2025).



