Пересадка эмбриональной нервной ткани используется в качестве одного из методов исследования функциональной активности и биоуправления в центральной нервной системе, поиска экспериментальных свидетельств ее развития и самоорганизации, а также процесса протезирования сенсорных систем [1, 2]. В настоящее время получены убедительные свидетельства интеграции эмбриональных аллогенных трансплантатов нервной ткани с корой полушарий головного мозга животного-реципиента [3]. Важную роль при этом приобретают восстановление микроциркуляции, реконструкция сосудистых анастомозов, возобновление двусторонних связей между нейронами пересаженной ткани и дифференцированными клетками взрослого животного-реципиента на самых начальных стадиях интеграции эмбрионального нейротрансплантата (ЭНТ), измеряемых буквально первыми сутками после пересадки. Итог этот процесса – активация компенсаторных возможностей нервных клеток мозга реципиента, активирование механизмов управления гемоциркуляцией, установление метаболического взаимодействия донорских и реципиентных нейронных сетей [4]. Эффекты ЭНТ связаны с воздействием разнообразных ростовых факторов, специфичных для эмбриона и активирующих регенерацию. Трансплантат восстанавливает молекулярный и клеточный гомеостаз, обеспечивает выживание реципиентных клеток, улучшает пространственную память, положительно влияя на восстановление навыков поведения, нарушенного при хирургическом удалении клеточных элементов коры головного мозга [3, 5]. Целью данной работы стало изучение природы изменения поведения крыс после гомотопической аллотрансплантации эмбриональной ткани соматической коры головного мозга, а также характера циркуляторного и метаболического состояния трансплантата.
Материал и методы иследования
В качестве экспериментальных животных были использованы крысы-самцы линии Вистар (22 особи) с массой тела 150 г, которых содержали в виварии в стандартных условиях. Работа с лабораторными животными проводилась в соответствии с Заключением Комиссии по биомедицинской этике РАН с учетом этических принципов, предлагаемых Европейским фондом (European Science Fundation), «Правилами проведения работ с использованием экспериментальных животных» и в соответствии с международным регламентом экспериментов на животных.
Животных наркотизировали кетамином внутрибрюшинно из расчета 12,0 мг/кг. Над зоной локализации соматической коры (СК) с координатами АР=+2,0 мм, L=5,5 мм у крысы-реципиента осуществляли трепанацию теменной кости. Производили надрез твердой мозговой оболочки, через который экстрагировали 1 мм3 серого вещества коры, создавая в ней ямку округлой формы, после чего производили полноценный гемостаз. Источником пересаживаемой донорской ткани служили семнадцатидневные эмбрионы, полученные от крысы-самки одного помета. Животное подвергалось операции кесарева сечения. Извлеченные из матки зародыши сохраняли при температуре 37оС в стерильном физиологическом растворе. Следующим этапом было получение эмбриональной аллогенной ткани крысиного зародыша из четко определенного участка мозга, который в процессе индивидуального онтогенеза дифференцируется в соматическую зону неокортекса. 1 мм3 извлеченной донорской нервной ткани немедленно погружали в предварительно сформированную зону дефекта в соматической коре мозга животного, служившего реципиентом [3, 6]. Далее выполняли костно-мышечную аутопластику с последующим ушиванием тканей головы. Через 4 месяца после этой процедуры трансплантации осуществляли несколько серий экспериментов, направленных на анализ поведения экспериментальных животных (крыс с ЭНТ), подвергшихся имплантации.
В первой из них изучали типологические особенности поведенческих реакций крыс в тесте «открытого поля», представлявшего собой квадрат со стороной 70 см, в свою очередь состоявший из расчерченных ячеек – квадратов размером 10х10 см. Освещенность «открытого поля» была эквивалентна 100 люкс, что достигалось излучением расположенной над ним на высоте 2 м лампы накаливания. Вокруг экспериментальной площадки располагался 50-сантиметровый барьер из оргстекла. Время тестирования составляло 10 минут, на протяжении которых животные производили пересечения квадратных ячеек, количество которых регистрировали и интерпретировали как двигательную активность по горизонтали. Фиксировали количество так называемых стоек, формировавших активность по вертикали. Оценивали также численность входа в центр «открытого поля» и частоту эпизодов грумингового поведения.
Вторая экспериментальная серия была проведена с целью выявления степени выраженности адаптивной коррекции поведенческих реакций животных с ЭНТ в лабиринте Y-образной формы, конструкция которого предполагала наличие одного затемненного и второго освещенного отсеков, угол между которыми составлял 120о. Размеры каждого из них равнялись 50х10х40 см. Фиксировали временной промежуток пребывания крысы в пределах освещенного отсека, период двигательной активности, количество посещений каждого из отсеков лабиринта, число заходов в отсеки лабиринта, а также вертикальную двигательную активность и частоту эпизодов грумингового поведения.
Третья экспериментальная серия была представлена тестированием в процессе «принудительного плавания». Крысы с ЭНТ находились в бассейне-аквариуме размером 60х60х40 см, температура воды 28–30оС. Фиксировали промежутки времени, охватывавшие время покоя (иммобилизации), активного формированного плавания, регистрируемого как производство сильных и быстрых гребковых движений четырьмя лапками, пассивного плавания в форме удерживания тела на поверхности воды, а также количество эпизодов активного избегания в виде прыжковых движений.
В вышеприведенных сериях экспериментов присутствовали две контрольные группы крыс, первая из которых была представлена интактными четырехмесячными особями мужского пола линии Вистар. Вторая контрольная группа, условно определенная нами как крысы с «ложной» операцией, была введена в эксперимент для исключения воздействия на поведенческие реакции травматизации, неизбежной при операции по трансплантации ЭНТ, сопряженной с трепанацией черепа. Животным второй контрольной группы после трепанации черепа надрезали твердую мозговую оболочку, далее осуществляли костно-мышечную аутопластику с последующим ушиванием раневого дефекта мягких тканей головы путем наложения отдельных узловых швов.
В дальнейшем приступали к электрофизиологической части исследования. Экспериментальное животное было подвергнуто кетаминовому (12,0 мг/кг) внутрибрюшинному наркозу. Вслед за тем у животного, помещенного в стереотаксический аппарат, фиксировали голову, производили трепанацию черепа над областью проекции СК с вышеуказанными координатами. Обнажали вещество мозга, на которое наносили агар-агар и впоследствии слой вазелинового масла, нагретого до 37оС. На следующем этапе с целью идентификации локуса представительства вибрисс в ЭНТ и соматической коре контрольных крыс находили и фиксировали координаты фокуса максимальной активности вызванного потенциала при адекватной по силе и длительности дозированной стимуляции контралатерально расположенной вибриссы С 1. Величина стимула составила 10 миллисекунд, частота предъявления – 1 в секунду, продолжительность эпизода каждой из серий – 10 секунд. Фокальные ответы регистрировали эпидурально, отведения были монополярными, их осуществляли хлорсеребряными электродами, имевшими диаметр 180–200 микрометров, при полосе пропускания усилительного сигнала от 10 до 2000 Гц. Проекция вибриссы С 1 в коре большого мозга крысы была детерминирована в точке, где вызванный потенциал формировался с минимальным скрытым (латентным) периодом и наибольшей амплитудой.
Электроды, одновременно регистрировавшие парциальное напряжение кислорода, а также локальный кровоток в идентифицированном участке вещества мозговой ткани, ступенчато опускали, устанавливали и фиксировали на различной глубине нервной ткани с интервалом 8–10 микрометров. Исследование параметров циркуляторно-метаболического обеспечения производили синхронно, полярографическим методом с использованием платиновых измерительных электродов диаметром 5–10 мкм. Подкожно в области шеи для измерительных цепей парциального напряжения водорода и кислорода были размещены серебряные сравнительные электроды, а также Pt – электрод для генераторной цепи водорода.
Парциальное напряжение кислорода и локальный кровоток в веществе мозговой ткани регистрировали с применением прибора «физиоблок-01», скоммутированного через аналогово-цифровой преобразователь с компьютером.
Характер развития реакций прироста парциального напряжения кислорода, а также регистрацию процесса реакций сосудов в ответ на внешний стимул анализировали в условиях механической стимуляции детерминированной вибриссы (С 1) с левой стороны морды животного в течение 10 секунд с частотой предъявления стимула – 1 в секунду. Регистрировали латентные периоды и амплитуду развития реакций микрососудов, выражая величину прироста показателей в процентах по сравнению с базовым уровнем [3, 6].
Статистический анализ результатов исследования осуществляли с использованием программы Statistica 9.0. Нормальность распределения значений была проверена путем вычисления коэффициента асимметрии, являющегося математической характеристикой степени отклонения опционной кривой. Значимость выявленных различий между данными двух независимых выборок при распределении признаков в соответствии с нормальным законом устанавливали с помощью t-критерия Стьюдента. При наличии достоверных отличий распределения по отношению к нормальному, детерминированных с применением c2, использовали критерий Уилкоксона–Манна–Уитни. Различия между выборками при значении р<0,05 считали статистически достоверными.
Результаты исследования и их обсуждение
В таблице 1 приведены результаты, характеризующие различные аспекты типологических особенностей поведенческих реакций. Нами показано, что животные с нейротрансплантатом проявляли повышенную моторную горизонтальную активность: число перемещений по квадратам, зафиксированных стоек и груминговая активность достоверно превышали соответствующие показатели у контрольных групп крыс. Данные, зарегистрированные в группах интактных крыс и у животных с «ложной» операцией, статистически не различались.
Таблица 1
Параметры поведенческих реакций (M±m) у интактных (I), «ложнооперированных» (II) животных и экспериментальных крыс с эмбриональным нейротрансплантатом (III)
|
Результаты тестирования |
I (n = 8) |
II (n = 6) |
III (n = 8) |
|
1) открытое поле» – перемещения по квадратам – стойки – груминг – входы в центр |
62,82±11,413 12,53±6,414 14,2±2,541 0,81±0,045 |
68,78±8,015 11,74±3,192 16,68±3,229 1,3±0,703 |
80,32±9,338* 25,29±3,873* 27,68±5,341* 1,29±0,590 |
|
2) проба в лабиринте: – стойки – время в движении, с – число заходов в отсеки – нахождение в освещенном отсеке, с – груминг |
10,45±3,323 5,67±3,025 16,69±2,314 6,78±1,367 25,79±2,781 |
14,52±4,124 4,48±2,483 17,89±5,675 8,82±3,018 26,67±2,228 |
20,29±4,318* 12,7±4,142* 14,38±5,780 3,27±0,352* 23,09±4,142 |
|
3) проба с плаванием: – активное плавание, с – пассивное плавание, с – частота избегания – время иммобилизации, с |
34,78±0,455 12,99±0,435 2,48±0,023 54,3±4,390 |
33,3±0,891 14,69±8,134 7,68±1,124 32,78±4,055 |
11,29±0,564* 3,39±0,365* 25,29±3,233* 26,76±4,374* |
Примечание: * – различия достоверны при р<0,05.
Проба в лабиринте также характеризовала поведенческую активность животных с ЭНТ как избыточную. Число вертикальных стоек, продолжительность консолидированной двигательной активности, включая пребывание в состоянии груминга, число посещений отсеков Y-образного лабиринта оказались увеличенными. При этом период нахождения в светлом пространстве лабиринта оказался достоверно сниженным.
Таким образом, в процессе тестирования как в «открытом поле», так и в пространстве лабиринта животные с пересаженной нервной тканью могут быть охарактеризованы как гиперактивные с возросшей ориентировочной и исследовательской активностью.
Пробы с активным форсированным и пассивным плаванием показали достоверное укорочение времени пребывания в процессе движения животных основной экспериментальной группы по сравнению с группой контроля. Кроме того, у крыс с нейротрансплантатом выявлено достоверное возрастание количества эпизодов избегания прыжков, сопровождавшееся уменьшением общего времени покоя. «Ложнооперированные» и интактные животные предпочитали процесс активного форсированного плавания, чередовавшегося с возросшей продолжительностью периодов иммобилизации. Следовательно, в поведенческом профиле плавательного теста у животных с пересаженным нейропилем и контрольных интактных животных установлены существенные отличия, связанные в основном с гипокинезией крыс экспериментальной группы.
После 4 месяцев интеграции с мозгом животного-реципиента аллогенные эмбриональные трансплантаты нервной ткани имели величину от 1,3 до 1,8 мм3; они заполняли тканевой дефект, сформированный оперативным путем, и одновременно с этим образовывали очаги непрерывного структурного взаимодействия между пересаженной и основной тканью in situ. Глубина прорастания пересаженной ткани в нейропиль коры взрослого животного составляла от 0,8 до 1,05 мм, ввиду чего регистрация электрофизиологических параметров осуществлялась в указанном диапазоне. Необходимо отметить, что максимальные по величине значения мозгового кровотока соответствовали глубине 0,48–0,72 мм, что соответствует расположению IV–V корковых слоев мозга крысы.
Объемная скорость локального кровотока была ниже, чем в аналогично топографически локализованной соматической области коры у «ложнооперированных» и интактных животных: 27–68 мл/100г/мин и 37–83 мл/100г/мин соответственно (рис.). При этом симметричную форму имели гистограммы, характеризовавшие распределение совокупности значений мозгового кровотока; коэффициенты асимметрии равнялись 0,24 и 0,29, что в совокупности указывало на нормальное распределение признаков вариационного ряда. Усредненные значения величины кровотока составили 48,2±1,58 мл/100 г/мин. Модальный класс значений колебался в диапазоне 44–51 мл/100 г/мин.
Парциальное напряжение кислорода, зарегистрированное после 4 месяцев интеграции аллогенных эмбриональных нейротрансплантатов с мозгом животного-реципиента, выявило варьирование показателя по глубине приживленной ткани от 12 до 42 мм рт. ст. По-прежнему максимальные значения уровня насыщения ткани кислородом находились на глубине залегания IV–V слоев интактной коры мозга крысы – 0,48–0,72 мм.
Симметричную форму имели также и гистограммы, характеризовавшие распределение по глубине пересаженной ткани совокупности значений парциального напряжения кислорода, усредненные величины которого составили 23,8±2,89 мм рт. ст. Модальный класс значений колебался в диапазоне 21–26 мм рт. ст.
В интактной соматической коре «ложнооперированных» животных значения парциального напряжения кислорода варьировали по глубине коры от 11 до 45 мм рт. ст., а максимальные его значения были зарегистрированы на глубине 0,58–0,78 мм. Гистограммы значений парциального напряжения кислорода были симметричной формы, модальные классы соответствовали значениям в диапазоне 18–24 мм рт. ст. со статистически нормальным распределением, так как их коэффициенты асимметрии равнялись 0,18 и 0,2. Значения парциального напряжения кислорода варьировали в диапазоне 26,1±0,98 мм рт. ст.
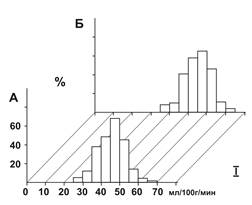
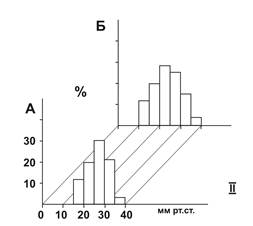
Гистограммы распределения совокупности значений мозгового кровотока (I) и парциального напряжения кислорода (II) в эмбриональном нейротрансплантате (А) и в коре мозга контрольных крыс (Б) после 4 месяцев интеграции аллогенных эмбриональных нейротрансплантатов с мозгом животного-реципиента
Обозначения. I: по оси абсцисс – классы значений кровотока; по оси ординат – количественные значения каждого класса (% к общей выборке).
II: по оси абсцисс – классы значений парциального напряжения кислорода; по оси ординат – количественные значения каждого класса (% к общей выборке).
Из вышеизложенного можно заключить, что скорость локального кровотока пересаженной нервной эмбриональной ткани была достоверно ниже на 15,3% (р≤0,05), чем в соматической коре «ложнооперированных» и интактных крыс. Количественные показатели парциального напряжения кислорода различались в экспериментальной и контрольной группах недостоверно. В соседних микроучастках циркуляторной сети нейротрансплантата отмечался нерегулярный неупорядоченный характер кровотока и величин парциального напряжения кислорода. Кроме того, уменьшилось общее количество микроучастков нервной ткани с максимально высокими значениями содержания кислорода, что, вероятно, объясняется близостью расположения глио-менингиального шва и неоднородностью приживляемой ткани. Несмотря на имеющуюся гипоксию нервной ткани трансплантата, последний замещал тканевой дефект, образованный в участке коры животного-хозяина, о чем свидетельствует факт компенсации и очевидного восстановления функциональной активности нейронов неокортекса, участвующих в формировании сложных поведенческих актов. Причинами имеющейся гипоксии явились как неоднородное распределение кислорода в ткани, нарушение геометрии и регионарной архитектоники микрососудов, пониженная плотность капилляров трансплантата, так и пониженная васкуляризация соседней с ЭНТ, окружающей его ткани области неокортекса хозяина. При этом компенсация снижения кислородного обеспечения и адаптация к гипоксии происходят за счет устойчивой микрогемодинамики по непрерывной гибридной сети капилляров, обеспечивающих прямой и ретроградный коллатеральный кровоток. Степень васкуляризации пересаженной нервной ткани коры мозга была несколько ускорена по сравнению с контролем вследствие активации нейропластических свойств [7, 8].
В процессе механической стимуляции вибриссы (С 1) спустя 4 месяца интеграции тканей трансплантата и «хозяина» в локальном участке ранее пересаженного нейропиля кровоток увеличивался, амплитуда превышения величины его интенсивности была в пределах 60,88±5,234%, а скрытый латентный период составил 4,18±1,125 секунды. Период реакции постстимуляции при нарастании локального кровотока в точке проекции вибрисс (С 1) соматической коры «ложнооперированных» и интактных контрольных крыс соответствовал 5,01±1,333 секунды, а ее амплитуда - 25,2±4,02%.
Скрытый период реакции прироста кислородного напряжения в исследуемой ткани трансплантата составил в среднем 4,14±2,933 секунды, при этом амплитуда превышения по сравнению с исходным состоянием равнялась 41,3±5,94%.
В зоне проекции вибрисс (С 1) соматической коры «ложнооперированных» и интактных контрольных крыс скрытый период нарастания кислородного напряжения был 4,99±3,143 секунды, максимальное значение реакции - 25,12±3,012%.
Следовательно, пространственные и временные характеристики реакций микрососудов эмбрионального нервного трансплантата и соматической области коры мозга «ложнооперированных» и интактных контрольных крыс различались недостоверно в части продолжительности их латентных периодов. Однако возросший в 2,42 раза локальный кровоток составил достоверно большую величину в приживленной ткани (р<0,01), как и показатели парциального напряжения кислорода, которые превысили контрольные значения в 1,72 раза (р<0,01).
Подводя итог, можно считать, что реконструированные участки микрососудистого русла ЭНТ сохраняют и в определенной степени превышают способность к ремоделированию и реализации динамичных интенсивных реакций, направленных на стабилизацию и активную коррекцию кровотока в пересаженной ткани. В то же время местное усиление кровотока в ответ на механостимуляцию соответствующей вибриссы имело отчетливые черты функциональной гиперемии, которая по сравнению с группой контроля приобретала достоверно более высокую степень и значения. Полученные данные являются доказательством увеличенной способности сосудов, кровоснабжающих пересаженный нейропиль, к постактивационному повышению просвета и, как следствие, формированию основы для возрастания объемной скорости кровотока, обеспечения и сохранения адекватного напряжения кислорода в функционально активном модуле нейронов. Необходимо отметить, что проявляющиеся микроваскулярные реакции, имеющие специфическую динамику, пространственную и временную структуру, зачастую служат следствием генерирующейся импульсной активности нейронов, устанавливаются и коррелируют в соответствии с возрастанием ее значений [3, 6, 9].
Осуществленный нами в условиях хронического эксперимента комплексный многофакторный анализ поведенческих реакций крыс, которым в зону представительства вибрисс соматической коры мозга был трансплантирован аллогенный аутентичный фрагмент ткани, извлеченный из эмбриона, выявил следующее. По происшествии 4 месяцев интеграции трансплантатов с нервной тканью мозга животных-реципиентов последние имели отличительную особенность в виде возросшей ориентировочной и исследовательской активности. В ходе проведения опыта в тесте «открытого поля» в процессе реализации задачи в пространстве лабиринта животные с пересаженной нервной тканью характеризовались как гиперактивные.
Пробы с активным форсированным и пассивным плаванием показали достоверное сокращение времени пребывания в движении и перемещениях животных основной экспериментальной группы. Кроме того, у крыс с нейротрансплантатом выявлены достоверное возрастание количества фрагментов уклонения производства динамичных гребковых движений, симуляция прыжков, факты укорочения общего времени покоя. «Ложнооперированные» и интактные крысы предпочитали процесс энергичного форсированного плавания, чередовавшегося с возросшей продолжительностью периодов иммобилизации. Следовательно, у крыс экспериментальной группы с пересаженным нейропилем в процессе реализации плавательного теста в поведенческом профиле вскрыты принципиальные отличия от крыс группы контроля, которые в целом могут быть охарактеризованы как гипокинезия. Несмотря на наличие у экспериментальных животных повышенного уровня тревожности, также является очевидным проявление у них исследовательской мотивации [10], о чем косвенно свидетельствуют формирование отрицательных эмоций, активация ориентировочного рефлекса, побуждение к исследовательской деятельности. Одновременно с этим многократность и интенсивность грумингов, отчасти компенсируя высокую двигательную активность, тормозят возникновение мобилизационного стресса [11, 12].
Таким образом, влияние пересаженной интегрированной эмбриональной ткани, растущей и дифференцирующейся в соматической зоне коры мозга взрослого животного, интерпретируется как форма проявления устойчивого приспособительного поведения, способность решения задач ориентации в пространстве с целью реализации локомоторной активности. В то же время нарастание ситуативной и реактивной тревожности, неполная компенсация локомоторной и когнитивной функций, возникновение эпизодов дезадаптации могут быть связаны с дезактивирующим влиянием ЭНТ в условиях незавершенной морфологической кооперации, интеграции и регенерации исходной цитоархитектоники нейропиля и тканевых микрососудов донора и реципиента [9, 13, 14, 15].
Модель и программа поведения, его особенности у взрослого животного обусловлены влиянием предыдущего опыта, информацией, которая была обработана иерархией нейронных цепей, их устойчивостью и ранее сформированной структурой [13]. В нашем случае у животного-реципиента анализ сложных поведенческих реакций демонстрирует тенденцию, направленную на восстановление иерархически расположенных, параллельно функционирующих нейронных цепей, в структуру которых встраиваются заново дифференцированные нейроны эмбриональной ткани [3, 6]. Животное-реципиент воспроизводит генетически закрепленные двигательные схемы, демонстрируя пластичность пересаженной ткани мозга, за счет дифференцировки которой нивелируются неизбежные травматические повреждения клеток в период, предшествующий интеграции с тканью мозга реципиента. При этом даже в случае необратимого повреждения исходной архитектоники, нарушения биохимических характеристик нервной ткани и прилежащего микрососудистого ложа происходят коррекция двигательных программ и их частичная компенсация. Кроме того, наличие в головном мозге билатеральной организации означает, что сенсорные стимулы могут поступать к ЭНТ из альтернативных путей, что также свидетельствует о прогрессивном воздействии пересаженной незрелой нервной ткани. ЭНТ оказывает позитивное влияние как на сформированные, основанные на ранее приобретенном опыте схемы поведения, так и на их оптимизацию, повышая пластичность нейронов у животного-реципиента.
Наблюдаемое восстановление иннервации и кровоснабжения пересаженной ткани, особенности протеканий активных сосудистых реакций, в частности функциональной гиперемии, сформированность биоэлектрической активности нейронов, паттерны которой, ранее зарегистрированные нами, имели качественное и количественное сходство с интактной корой, указывают на систематизированный организованный порядок распределения дифференцирующихся клеток относительно поверхности коры мозга [3, 16].
Метаболическое обеспечение пересаженной нервной ткани недостоверно отличалось от интактной, что может объясняться как ее увеличенной потребностью в кислородном снабжении, так и существенным проявлением в трансплантате реакций анаэробного гликолиза, что делает возможным обладание имплантированных нервных клеток высокой устойчивостью к снижению парциального напряжения кислорода [5, 7, 14]. Поскольку нервная ткань плода обладает генетически детерминированной устойчивостью к гипоксии, сохранению и удержанию пределов кислородной безопасности за счет замедления потребления метаболических субстратов, утилизации лактата и кетоновых тел, перераспределения кровотока, можно считать, что незрелому мозгу присуща высокая нейропластичность [1, 5, 8, 9], которую обеспечивает ЭНТ, обладающий протекторными свойствами.
В то же время повреждения в нейрональных системах обусловливают дисфункцию капиллярных сетей, вовлекаемых в регуляцию микроциркуляции. Зарегистрированные паттерны локального кровотока указывают на его равномерный характер, способность к возрастанию гемоциркуляции по всему периметру ЭНТ в ответ на сенсорную стимуляцию, а также на обратное развитие функциональной гиперемии, возвращение кровотока к исходному уровню по окончании воздействия. Отсутствие при этом изменений парциального напряжения кислорода после начала стимуляции свидетельствует о том, что функциональная гиперемия не является следствием локальной гипоксии. Поскольку локальное возрастание напряжения кислорода сопровождает увеличение кровотока в микроучастке мозга, можно считать, что ткань, которая потребляет больше кислорода, требует более высоких градиентов рО2 для его транспорта в митохондрии [17, 18, 19].
Полученные материалы подтверждают гипотезу о том, что в начальных периодах интеграции после пересадки продолжают существовать и поддерживаются особенные, исключительные характеристики незрелой, находящейся в процессе дифференциации ткани. В этом случае в головном мозге реципиента запускаются биосинтетические механизмы, необходимые для поддержания в нем гомеостатического баланса.
Библиографическая ссылка
Гафиятуллина Г.Ш., Хананашвили Я.А. ВЗАИМОСВЯЗЬ МЕЖДУ СТАНОВЛЕНИЕМ МИКРОЦИРКУЛЯЦИИ В ГОЛОВНОМ МОЗГЕ КРЫС И ИХ ПОВЕДЕНИЕМ // Современные проблемы науки и образования. 2019. № 6. ;URL: https://science-education.ru/ru/article/view?id=29303 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.29303



