В настоящее время эндометриоз представляет собой одну из самых частых патологий у женщин репродуктивного возраста. В структуре женского бесплодия данная патология в среднем составляет около 50% [1, 2]. Первичное и вторичное бесплодие при наружном генитальном эндометриозе встречаются с одинаковой частотой. Согласно результатам анализа многофакторных моделей J. Prescott al. (2016) продемонстрировано, что относительный риск первичного бесплодия по сравнению с вторичным бесплодием составляет 3,68 против 2,57 соответственно (p=0,09), а при аденомиозе вторичное бесплодие регистрируется в 4 раза чаще, чем первичное [3]. Среди женщин с первичным бесплодием и эндометриозом только у половины наступает беременность, а среди женщин с диагнозом «эндометриоз» лишь 83% сохраняют фертильность к 40 годам [4].
Коэффициент фертильности (отношение числа рождений к численности женщин репродуктивного возраста) при эндометриозе колеблется от 0,02 до 0,10, тогда как у здоровых женщин он равен 0,15–0,20 [5].
Эндометриоз является эстрогензависимым заболеванием, которое развивается на фоне гормонального и иммунного дисбаланса при наличии генетической предрасположенности. Н.И. Волков и др. (1999) среди причин эндометриоза выделяют нарушение соотношения эстрогенных фракций в сторону повышения экскреции эстрона и эстрадиола [6].
Литературные источники указывают на то, что у женщин с эндометриозом даже физиологические концентрации эстрадиола, который обладает провоспалительным и антиапоптотическим эффектом, способны вызывать усиленный воспалительный ответ, опосредованный локальной продукцией хемокинов, и усиливать механизмы выживания клеток, опосредованные внеклеточными регулируемыми сигнальными киназами и Bcl-2. Основным действием прогестагенов является ингибирование IL-8 и других хемокинов в стромальных клетках эндометрия и очагах аденомиоза. Прогестерон же индуцирует апоптоз в клетках эндометрия посредством ингибирования Bcl-2 и ядерного фактора – κB [7]. Активация процессов апоптоза в эндометрии в период окна имплантации выступает в роли биологического маркера адекватно подготовленного к имплантации эмбриона эндометрия, следовательно, антиапоптотические процессы при эндометриозе могут выступать в качестве одной из причин эндометриоз-ассоциированного бесплодия.
Одним из факторов, непосредственно влияющих на рецептивность эндометрия, является хроническое воспаление. Прогестерон проявляет противовоспалительную активность, и в нормальных условиях воспалительный ответ возникает после снижения концентрации прогестерона в поздней секреторной фазе менструального цикла. Уменьшение концентрации прогестерона приводит к снижению метаболизма простагландина и увеличению АФК (активные формы кислорода), которые активируют NFκB-опосредованный воспалительный каскад, индуцирующий процессы, необходимые для менструации [8]. При эндометриозе отмечается резистентность к прогестерону, что имитирует позднюю секреторную фазу, приводя к преждевременной инициации воспаления [9].
Лейкемия-ингибирующий фактор (LIF) представляет собой плейотропно-секретируемый цитокин семейства IL-6, который может действовать на различные ткани и типы клеток [10]. Действия LIF в основном индуцируются после связывания с рецептором на поверхности клеток LIF (LIF-R), который представляет собой гетеродимер, состоящий из двух субъединиц. Участие LIF и, следовательно, LIF-R в процессе имплантации требует соответствующих уровней экспрессии во время окна имплантации. Уровни экспрессии LIF и LIFR постепенно увеличиваются после овуляции, которая продолжается до конца менструального цикла. Сообщалось, что концентрация LIF максимальна между 7-м и 12-м днем после овуляции, тогда как уровни LIFR достигают пика между 19-м и 25-м днем цикла [11]. Также было отмечено, что более сильная иммунореактивность LIF во время окна имплантации коррелирует с более высокой вероятностью беременности, в то время как снижение экспрессии LIF в течение этого интервала связано с меньшей вероятностью зачатия в последующих циклах. Таким образом, максимизация LIF и, следовательно, уровней LIFR имеет большое значение, так как эти цитокины могут способствовать имплантации.
В настоящее время активно обсуждается роль различных патологических процессов, способных повлиять на рецептивность эндометрия и нарушение рецептивности, однако недостаточное внимание уделяется роли нарушений апоптоза и пролиферации.
Целью данного исследования явилось выявление особенностей апоптотической и пролиферативной активности в железах и строме эндометрия, а также его рецептивности в период окна имплантации у женщин с эндометриоз-ассоциированным бесплодием.
Материал и методы исследования. Проведен анализ морфологического состояния эндометрия у 33 пациенток с эндометриоз-ассоциированным бесплодием (основная группа) и 31 гинекологически здоровой женщины (группа сравнения), обратившихся по вопросам планирования семьи в связи с мужским фактором бесплодия.
Критерии исключения: прием гормональных препаратов в течение последних двух месяцев перед исследованием, наличие тяжелой соматической патологии. Все женщины дали информированное согласие на участие в исследовании и открытую публикацию его результатов.
Обследование пациенток проводили по единой схеме, включающей анализ жалоб, анамнеза, общепринятые клинические и лабораторные исследования, морфологическое и иммуногистохимическое исследование эндометрия, полученного путем Пайпель-биопсии на 20–22-й день менструального цикла. Все пациентки находились в репродуктивном возрасте, имели овуляторный менструальный цикл, уровень гормонов гипоталамо-гипофизарной системы, стероидных гормонов яичников, гормонов надпочечников, щитовидной железы в сыворотке крови соответствовал нормативным значениям согласно предоставленным для истории болезни данным.
Эндометрий подвергали комплексному морфологическому и морфометрическому исследованию. Гистологическое изучение парафиновых срезов эндометрия проводили при окраске материала гематоксилином и эозином, пикрофуксином по Ван Гизону.
Тканевые образцы для иммуногистохимического исследования готовили по общепринятой методике. Используемые моноклональные антитела были предназначены для работы с парафиновыми срезами по общепринятым протоколам, окрашивание производили с использованием иммуногистостейнера закрытого типа Bond max (производитель Leica, Германия). Результаты реакции рецепторов к эстрогенам и прогестеронам идентифицировались по ядерному или мембранному окрашиванию клеток для соответствующих маркеров с оценкой процента окрашенных клеток и интенсивностью окраски клеток. Экспрессию рецепторов к эстрогенам и прогестеронам оценивали по 3-балльной шкале (слабая, средняя и выраженная степени).
Экспрессия Ki-67, bcl-2, p53 в строме и железах оценена путем подсчета количества окрашенных ядер в поле зрения при увеличении 400, при этом изучали не менее 10 полей зрения. Экспрессию LIF и LIFR определяли на мембранах клеток поверхностного эпителия, эпителия желез и клеток стромы эндометрия путем подсчета процента окрашенных клеток в поле зрения при увеличении 400, при этом изучали не менее 10 полей зрения.
Морфометрические измерения площади желез, процент покровных эпителиоцитов, имеющих пиноподии, а также высоты пиноподий проводили при помощи программы ImageJ (Java based). В зависимости от площади, занимаемой эпителиальным покровом, пиноподии характеризовались как изобилующие (более 50%), умеренные (от 20 до 50%) и невыраженные (менее 20%) [12].
Просмотр и фотографирование микропрепаратов осуществляли при оптимальном увеличении на микроскопе AxioScope A1 («CarlZeissJena», Germany) с использованием цифровой фотокамеры («CarlZeiss», Germany)
Сравнение между группами проводили непараметрическими статистическими методами с использованием критерия Манна–Уитни. Применялись методы вариационного, регрессионного анализа. Величина вероятности ошибки (р) была принята на уровне 0,05. Статистическую значимость различий величин в группах по изучаемым факторам оценивали по критериям Стьюдента (различие средних) и Фишера (различие дисперсий), критерию согласия Пирсона с использованием точного метода Фишера и линейного дискриминантного анализа. Расчеты выполнены с помощью персонального компьютера с использованием программы «Statistica for Windows 7.0» и статистического пакета Microsoft Excel-2010 для операционной системы Windows.
Результаты исследования и обсуждение
Средний возраст женщин в группах был сопоставим и составил в основной группе 33,69 ± 2,07 года, в группе сравнения 34,5±2,62 года (р=0,92). Диагноз бесплодия по данным историй болезни у женщин основной группы был выставлен в течение 7,193 ± 0,55 года, количество попыток ЭКО составляло от 0 до 4 (95 CI% 0,25–1,32). При анализе вредных привычек в первой группе значительно преобладало количество курящих женщин – 0,9%, в то время как в группе сравнения на их долю приходилось всего 19,35% (p<0,0001), употребление алкоголя в умеренном количестве отметили все женщины обеих групп.
Гинекологические заболевания в анамнезе, преимущественно кисты яичников, хронический цервицит, сальпингоофорит, имели 51,5% пациенток основной группы и 12,9% женщин группы сравнения. При этом в основной группе доминировали эндометриоидные кисты яичников – 41,17% наблюдений.
Морфологическое исследование биоптатов эндометрия показало, что соответствие фазе цикла наблюдалось у 54,54 % женщин в основной группе и у 54,83% женщин в группе сравнения. Поздней стадии секреции соответствовал эндометрий у 9,09% и 22,58% женщин в основной группе и группе сравнения соответственно (p=1,0), более ранним стадиям соответствовал эндометрий у 39,39% бесплодных женщин и 22,58% фертильных женщин (p=0,182). Предецидуальная реакция стромы была более выражена у женщин группы сравнения: так, ее отсутствие регистрировалось в 72,72% образцов первой группы по сравнению с 35,48% образцами второй группы (p=0,005). Фибробластическая трансформация клеток стромы встречалась с одинаковой частотой у женщин обеих групп – 33,33% и 38,70% соответственно. Метаплазия желез встречалась в единичных случаях не более чем в 3,0% и 3,22% образцов соответственно. Мононуклеарная инфильтрация стромы почти в полтора раза чаще отмечалась у женщин первой группы (57,57% по сравнению с 35,48% у фертильных женщин), однако статистически значимой разницы между ними не было (р=0,086).
При морфометрическом анализе средняя площадь желез у женщин с эндометриозом составила 46688,0±2525,06 мкм (95 CI% 39565,14–53811,7), в группе сравнения – 43314,65±9720,35 мкм (95 CI% 39378,3–46880,3) (р=0,494), средний периметр желез у женщин с эндометриоз-ассоциированным бесплодием составил 1650,95±56,01 мкм (95 CI% 1536,3–1765,8), в группе сравнения – 1601,65±218,8 мкм (95 CI% 1512,6–1669,9) (р=0,526).
При оценке площади эпителиоцитов, имеющих пиноподии, невыраженные пиноподии регистрировались в 51,51% образцов основной группы относительно 9,67% в группе сравнения (р<0,001). Умеренно выраженные пиноподии отмечались в 18,18% образцов основной группы по сравнению с 32,25% у фертильных женщин (p=0,06), изобилующие пиноподии соответственно реже встречались у женщин основной группы 18,18% по сравнению с 58,06% женщин без нарушения репродуктивной функции (p=0,002). Также у женщин с бесплодием наблюдались более низкие пиноподии – 5,63±1,09 мкм (95 CI% 5,2–6,06) по сравнению с фертильными женщинами, у которых их высота достигала 8,38± 1,4 мкм (95 CI% 7,58–9,26) (р<0,001) (рис. 1).
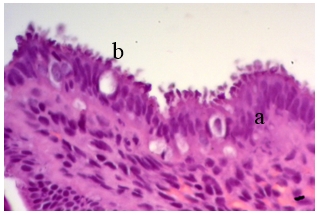
Рис. 1. Поверхностный эпителий женщин без репродуктивных нарушений, окраска гематоксилин-эозином. Поверхностные эпителиоциты (а) имеют на апикальной поверхности пальцеобразные выпячивания «пиноподии» (b). Ув. х400
Среднее значение уровня экспрессии рецепторов к прогестерону (PR) в поверхностном и железистом эпителии основной группы составило 272,11±11,59 (95 CI% 248,32–295-9) по сравнению с 184,29±13,12 (95 CI% 157,49–211,09) баллами в группе сравнения, в клетках стромы – 257,18±7,05 балла (95 CI% 242,72–271,61) по сравнению с 216,77±3,09 (95 CI% 210,45–223,1) (p<0,0001). Уровень экспрессии рецепторов к эстрогену (ER) в железистом эпителии статистически значимо не отличался и составлял 213,75±19,09 (95 CI% 172,91–254-59) и 208,39±7,03 балла (95 CI% 192,48–223,3) (p=0,955). Сопоставимые показатели экспрессии регистрировались и в строме – 111,96±10,03 (95 CI% 91,38–132,55) и 123,74±6,8 (95 CI% 109,67–137,82 балла (p=0 ,720)).
Маркер рецептивности эндометрия (LIF) зафиксирован в цитоплазме покровных эпителиоцитов и в меньшей степени – в гландулоцитах маточных желез. Наибольшая экспрессия этого маркера отмечалась в апикальных зонах эпителиальных клеток, особенно в проекции пиноподий, на что указывают и другие авторы [10]. При оценке экспрессии LIF в железах и строме у женщин основной группы средний балл составил соответственно 108,75±12,85 (95 CI% 82,37–135,13) и 49,15±9,38 (95 CI% 29,86–68,44) балла по сравнению с 228,13±15,52 (95 CI% 193,44–258,17) и 176±24,9 (95 CI% 120,29–224,17) (p<0,01 в обоих случаях) соответственно (рис. 2, 3).
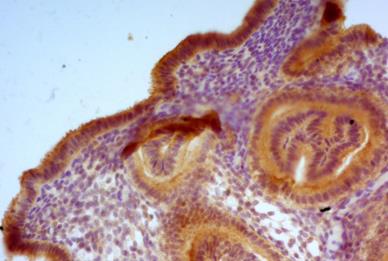
Рис. 2. Эндометрий женщин без репродуктивных нарушений, реакция со стандартными моноклональными мышиными антителами к LIF. Ув. х200

Рис. 3. Эндометрий женщин с эндометриоз-ассоциированным бесплодием, реакция со стандартными моноклональными мышиными антителами к LIF. Ув. х200
Наиболее высокий уровень экспрессии LIFR (рецептор LIF) регистрировался в железистом эпителии женщин с эндометриозом – 115,36±36 (95 CI% 71,51–159,21) балла по сравнению с 95,35±9,38 (95 CI% 76,18–114,53) (р=0,605), однако в строме значение данного параметра было практически в 2 раза ниже – 33,46±5,55 (95 CI% 22,06–44,87) балла по сравнению с 74,19±10,35 балла (95 CI% 53,04–95,34) (p=0,002). Это согласуется с данными C. Margioula-Siarkou et al. (2017) и многих других авторов о том, что экспрессия LIF снижается в общей популяции бесплодных женщин во время окна имплантации, они также отмечали почти двукратное уменьшение экспрессии LIFR в клетках стромы [13].
Экспрессия bcl-2 в основной группе была выше как в железах 122,1±17,06 (95 CI% 86,14–158,05) по сравнению с группой сравнения 51,04±8,3 (95 CI% 33,91–68,16) (р=0,001), так и в клетках стромы, с 45,97±7,2 (95 CI% 31,13–53,92) балла по сравнению с 31,57±4,49 балла (95 CI% 22,35–40,79) (р=0,258). Аналогичные результаты были получены Patel et al. (2017) при оценке экспрессии генов в эутотопическом эндометрии при эндометриозе. Авторы доказали, что экспрессия антиапоптотических белков, таких как bcl-2, аберрантно увеличивается во время секреторной фазы у пациенток с эндометриозом, что свидетельствует о неспособности прогестерона быстро остановить пролиферацию эндометрия и запустить дифференцировку клеток [14].
Отличалась и экспрессия факторов апоптоза в железах. Так, при эндометриозе экспрессия p53 наблюдалась у 19,14±5,14 (95 CI% 8,59–29,69) клеток желез и 19,18±3,97 (95 CI% 11,03–27,32) клеток стромы эндометрия по сравнению с 33,55±5,3 (95 CI% 22,58–44,51) клеток в железах и 32,1±4,14 (95 CI% 23,62–40,57) клеток в строме у фертильных женщин (для стромы р=0,05). Поскольку одной из транскрипционных мишеней р53 является ген, кодирующий LIF, снижение закономерно [15].
При оценке экспрессии Ki67 статистически значимых различий не выявлено. В железах образцов основной группы 13,35±0,23 (95 CI% 6,7–20,02) клеток по сравнению с 8,4±2,4 (95 CI% 3,61–13,74) клетками в нормальном эндометрии имели положительную ИГХ реакцию, в строме 10,75±1,4 (95 CI% 7,86–13,64) клеток по сравнению с 10,71±1,4 (95 CI% 7,14–14,28) для железистого эпителия р=0,660, для клеток стромы р=1,000). Тем не менее Bansari G. Patel et al. (2017) отмечали дисрегуляцию генов, участвующих в регуляции клеточного цикла, в частности Ki67 [14].
Заключение
Таким образом, эндометрий при эндометриозе характеризуется уменьшением площади и высоты пиноподий, повышением экспрессии рецепторов к прогестерону клетками желез и стромы, снижением экспрессии регуляторов и индукторов апоптоза, а также более чем двукратным снижением уровня экспрессии LIF клетками желез и стромы. Выявленные изменения в показателях морфологии клеток и их иммуногистохимическом профиле указывают на значительное угнетение рецептивности эндометрия и могут рассматриваться как прогностический маркер неудачной имплантации.
Библиографическая ссылка
Гришкина А.А., Чистякова Г.Н., Ремизова И.И., Данькова И.В., Мелкозерова О.А. МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ И ОСОБЕННОСТИ ЭКСПРЕССИИ ФАКТОРОВ АПОПТОЗА В ЭНДОМЕТРИИ ЖЕНЩИН С БЕСПЛОДИЕМ, ОБУСЛОВЛЕННЫМ ЭНДОМЕТРИОЗОМ // Современные проблемы науки и образования. 2019. № 5. ;URL: https://science-education.ru/ru/article/view?id=29270 (дата обращения: 15.02.2026).



