Ведущим звеном патогенеза системной склеродермии (ССД) является аутоиммунное воспаление соединительной ткани. Для него характерно вовлечение в патологический процесс различных органов и систем, которое приводит к патологическому состоянию соединительной ткани и стенок сосудов. Ключевая роль в развитии ССД отводится дисбалансу доминирующего малорастворимого элемента межклеточного вещества соединительной ткани – эластина (рис. 1, 3) [1, 2].
Известно, что в его деградации принимают участие эластазы, которые в большом количестве выделяются из гранулоцитарных лизосом в очагах воспаления (рис. 2) [1]. Именно от равновесия в этой системе зависит нормальное функционирование органов и тканей, состоящих из эластических и других белковых компонентов. Повреждающие факторы различного происхождения вызывают выработку аутоантител к ее компонентам, приводя к воспалению, а в дальнейшем – и к деструкции ткани [1].
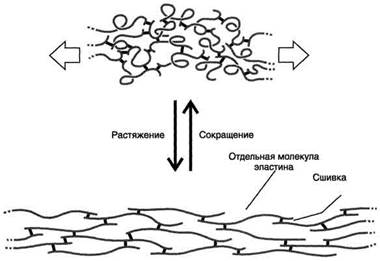
Рис. 1. Молекулы эластина связаны ковалентными сшивками
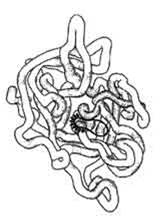
Рис. 2. Пространственные структуры эластазы
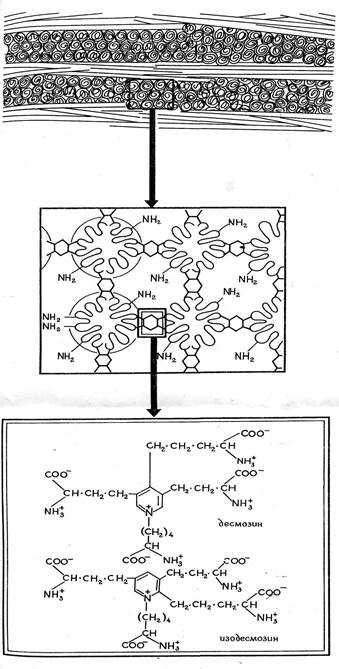
Рис. 3. Уровни строения эластина
Возможно, одним из ключевых белков соединительной ткани, участвующим в пусковом развитии воспалительного процесса при ССД, является ламинин [3].
Ламинин – структурный неколлагеновый гликопротеид базальной мембраны, состоящий из трех глобулярных ветвей (a,b,g) и одной стержневой ветви (рис. 4) [4].
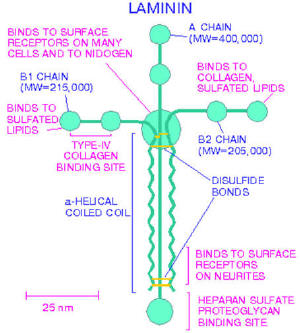
Рис. 4. Структура ламинина
Пояснения:
binds to surface receptors of many cells and nidogen – связывается с поверхностью рецепторов различных клеток и нидогена
A chain (molecular weight = 400000) – цепь А (молекулярная масса = 400000)
B1 chain (molecular weight = 215000) – цепь B1 (молекулярная масса = 215000)
Binds to collagen, sulfated lipids – связывается с коллагеном, сульфатированными липидами
B2 chain (molecular weight = 205000) – цепь B2 (молекулярная масса = 205000)
type IV collagen binding site – тип IV коллагенсвязывающий участок
a-helical coiled coil – «винтовая» намотанная катушка
disulfide bonds – дисульфидные мостики
binds to surface receptors on neuritis – связывается с рецепторами на невритах
heparan sulfate, proteoglican binding site – гепарансульфат, протеогликансвязывающий участок
Каждая цепь ламинина состоит из нескольких доменов, на которых имеются активные центры взаимодействия с различными биологически активными веществами, такими как коллаген IV типа, нидоген, фибронектин, глобулин, половые гормоны, имеющий молекулярную массу от 400 до 900 кДа. Нидоген состоит из одной сульфатизированной полипептидной цепи, которая содержит три глобулярных домена и образует с ламинином малорастворимый, нековалентно связанный комплекс, причем его связь с ламинином намного сильнее, чем с коллагеном IV типа. Нидоген занимает центральное место в структуре клеточного матрикса, обуславливающего ковалентное связывание коллагена IV типа и ламинина. Последний фиксируется с клетками, что определяет главную функцию ламинина как адгезивного белка различных эпителиальных и мезенхимальных клеток, обеспечивающих устойчивость тканей к растяжению, и влияет на рост, морфологию, дифференцировку и их подвижность (рис. 5) [5].
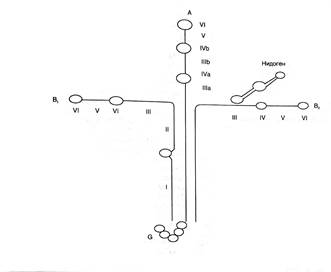
Рис. 5. Строение комплекса ламинин – нидоген
Важным механизмом при иммунном воспалении при ревматических заболеваниях, в том числе и при ССД, является образование аутоантител и циркулирующих иммунных комплексов. Поэтому изучение антителообразования к ламинину, с которого может начинаться дезорганизация соединительной ткани под действием механизмов иммунного воспаления, является интересным и значимым [6, 7]. Одним из инструментов поиска биологически активных участков молекулы стал ограниченный протеолиз ламинина различными ферментами (протеазой, эластазой). Было установлено, что ламинин имеет 2 основных места для взаимодействия с клетками – во фрагментах Р1 и Е8. Взаимодействие фрагмента Р1 является неактивным, скрытым в интактной молекуле, но оно, по-видимому, активируется путем протеолиза в процессе ремоделирования ткани. Скрининг синтетических пептидов выявил последовательность аминокислот YIGSR, присутствующую в III домене β-1 цепи, которая обладает способностью связываться с клетками. Но основным местом прикрепления клеток является фрагмент длинного плеча Е8. Возникает вопрос: не являются ли антитела к ламинину, а именно к фрагментам Р1, Е8 и пептидной последовательности YIGSR в III домене β-1 цепи, одним из пусковых механизмов развития патологической реэпителизации в тканях организма при ССД? Концентрация ламинина в плазме крови у мужчин в пределах 180–720 мкг/мл и несколько меньше у женщин. Отсутствие подробных работ по изучению начальных моментов патологического изменения структуры соединительной ткани, включая ламинин и антителогенеза к нему, может явиться началом склеродермического процесса и основой для ранних диагностических и прогностических тестов при ССД.
Цель: изучение антителогенеза к малорастворимому белку эластину, ферменту эластазе, участвующему в его обмене, и широко распространенному в коже гликопротеиду – ламинину при склеродермическом процессе.
Материалы и методы исследования
Исследовалась сыворотка 30 доноров (12 женщин и 18 мужчин в возрасте от 22 до 64 лет) и 19 больных (17 женщин и 2 мужчин, чей средний возраст был 40,1±4,8 года) с достоверным диагнозом ССД, поставленным на основании критериев ACR (2013 ELUAR). Кожный синдром в различных формах наблюдался во всех случаях ССД (у 52,6% больных выявлялась стадия плотного отека, у 42,1% – индурации, у 5,2% – стадия атрофии, васкулопатии – у 15% больных, артралгии – у 89,5% больных ССД).
Антитела к эластину и ламинину, а также к эластазе определяли в ELISA-тесте с использованием магнитоуправляемого сорбента с иммобилизованной формой соответствующего антигена (модификация Гонтарь И.П. и соавт., 2002) [8]. Методом эмульсионной полимеризации проводили фиксацию изучаемых биополимеров в потоке газообразного азота. В качестве субстрата для определения специфических иммуноглобулинов к ферменту использовали коммерческий препарат эластазы из поджелудочной железы свиньи с активностью 4 ЕД/мл (компании SIGMA-ALDRICH, США), при определении специфических иммуноглобулинов к малорастворимому белку эластину был применен коммерческий препарат эластина из легких человека (компании SIGMA-ALDRICH, США). В качестве антигена при определении антител к ламинину был применен коммерческий препарат из плаценты человека L 6274-5MG. Результаты учитывали на ридере Multiskan EX (Thermo Electron Corporation, Шанхай, КНР) при 490 нм, они считались положительными при превышении показателей оптической плотности средних значений сывороток контрольной группы не менее чем на 2 стандартных отклонения. Программные пакеты STATISTICA 6,0 «Биостатистика», SPSS 12.0 позволили достоверно обработать полученные результаты.
Результаты исследования и их обсуждение
Количество специфических иммуноглобулинов к эластину и эластазе определяли у 30 практически здоровых лиц и 19 больных ССД. Распределение оптической плотности соответствовало нормальному типу: для эластина коэффициент Колмогорова–Смирнова – 0,704 при р=0,604, для эластазы – 0,990 при р=0,281. Определив среднюю концентрацию антител к эластину и эластазе в донорских сыворотках, вычислили уровень нормальных показателей в интервале М±2s. Исходя из этого при использовании иммобилизированных антигенных систем в иммуноферментном методе значения экстинции 0,104 и 0,113 при определении антител к эластину и эластазе были приняты за верхнюю границу нормы, а значения, превышающие эти цифры, считались положительными.
Достоверных различий в содержании антител в зависимости от пола и возраста в данной группе выявлено не было.
Средняя концентрация специфических антител к ламинину класса IgG в донорских сыворотках составила 0,031±0,0029 единиц оптической плотности. За верхнюю границу нормы [среднего + среднеквадратичного отклонения (Х + 2s)] была принята экстинция 0,062 единиц оптической плотности в используемом варианте иммуноферментного анализа в нашей модификации с применением специфических иммуносорбентов.
Повышенные уровни антител к эластину были выявлены у 64,8% больных ССД, к эластазе – у 7,1% пациентов, к ламинину – у 78,9%.
Выводы. Более высокие уровни антител у больных ССД к эластину, эластазе и ламинину по сравнению со здоровыми лицами еще раз подтверждают включение в аутоиммунный процесс при системном склерозе эластина и ламинина, являющихся соединительнотканными структурными компонентами, и эластазы, участвующей в их обмене. Статистически значимый процент встречаемости антител к ламинину у больных ССД можно объяснить первоначальным этапом патогенеза ССД, который начинается с поражения базальной мембраны кожи. Появление значительного количества антител в системе «эластин – эластаза» свидетельствует о глубоком деструктивном склеродермическом процессе, вовлекающем внутренние органы и системы, содержащие малорастворимый эластин. В диагностике ССД надо найти начальные и последующие предикторы заболевания, по которым можно судить о динамике патогенеза и контроле эффективности проводимой терапии. Исследование уровня антител к эластину, эластазе и ламинину позволит углубить знания о патогенезе ССД.
Библиографическая ссылка
Гонтарь И.П., Емельянова О.И., Русанова О.А., Емельянов Н.И., Красильников А.Н., Зборовская И.А. ПОСЛЕДОВАТЕЛЬНОСТЬ ВОВЛЕЧЕНИЯ БЕЛКОВЫХ КОМПОНЕНТОВ СОЕДИНИТЕЛЬНОЙ ТКАНИ В АУТОИММУННОЕ ВОСПАЛЕНИЕ ПРИ СКЛЕРОДЕРМИЧЕСКОМ ПРОЦЕССЕ // Современные проблемы науки и образования. 2019. № 5. ;URL: https://science-education.ru/ru/article/view?id=29267 (дата обращения: 06.03.2026).



