В большинстве случаев операции по поводу эндопротезирования крупных суставов нижних конечностей проводят пациентам, страдающим остеоартрозом, ревматоидным артритом или остеонекрозом (асептическим некрозом головки бедренной кости). Остеоартроз – это дегенеративное заболевание, поражающее суставные поверхности одного или нескольких суставов (чаще всего тазобедренного и коленного) [1]. Остеоартроз – это самая распространенная форма поражения крупных суставов нижних конечностей, главная причина снижения качества жизни, инвалидизации, особенно у пожилых людей. Только в 2010 г. в мире 250 миллионов человек (3,6% населения) страдали остеоартрозом коленного сустава. Причем женщины болеют чаще мужчин [2]. Тотальное эндопротезирование коленного сустава (ТЭКС) показано пациентам с прогрессирующим остеоартрозом коленного сустава, это одна из наиболее часто выполняемых в мире операций. Цели ТЭКС – снижение болевого синдрома, восстановление мобильности и функций коленного сустава, повышение качества жизни больных. ТЭКС – высокотравматичное вмешательство, которое характеризуется выраженным болевым синдромом в послеоперационном периоде [3]. Согласно данным национальных регистров ежегодно увеличивается количество операций ТЭКС. В США к 2030 г. прогнозируется трехкратное увеличение, в Российской Федерации по данным регистра «РНИИТО им. Р.Р. Вредена» за 2011–2013 гг. выполнено 5987 операций эндопротезирования коленного сустава, рост количества операций за 3 года составил 23% [4, 5]. Для защиты пациента от хирургической агрессии традиционно используется общая и спинномозговая анестезия; при общей анестезии обезболивание достигается системным применением опиоидных анальгетиков, при спинномозговой анестезии блокируют передачу нервного импульса на уровне корешков спинномозговых нервов путем введения в субарахноидальное пространство раствора местного анестетика. Для купирования послеоперационного болевого синдрома применяется мультимодальная аналгезия, которая включает в себя введение нестероидных противовоспалительных препаратов и опиоидных анальгетиков в сочетании с регионарными методами обезболивания, такими как:
1) продленная блокада бедренного нерва;
2) эпидуральная аналгезия;
3) однократная блокада бедренного и седалищного нервов;
4) инфильтрационная аналгезия периартикулярных тканей;
5) блокада геникулярных нервов.
Однако выбор метода анестезии и послеоперационного обезболивания в большинстве случаев обусловлен сложившейся практикой в лечебном учреждении и не является персонифицированным [6]. Неадекватное послеоперационное обезболивание может приводить к развитию осложнений, таких как острый инфаркт миокарда, венозные тромбоэмболические осложнения, пневмония, острое почечное повреждение, острое нарушение мозгового кровообращения, вторичный иммунодефицит, хронический болевой синдром и иные, а также замедлить реабилитацию пациента, увеличивать сроки и стоимость лечения [7].
Цель работы – провести критический анализ литературных источников, индексированных в Pubmed и РИНЦ, посвященных методам оценки эффективности обезболивания после операции ТЭКС у пациентов с гонартрозом.
В клинической практике для оценки эффективности послеоперационного обезболивания применяются «аналоговые шкалы боли», предполагающие ассоциацию оценки боли пациентом с цветом или длиной отрезка, среди них наиболее распространенная – визуально-аналоговая шкала (ВАШ), менее распространенные – цифровая рейтинговая шкала боли (NRS), вербальная рейтинговая шкала (VRS). Все они подходят для пациентов в сознании. К сожалению, ВАШ определяет только интенсивность боли, не предоставляя информации о ее качественных характеристиках. Опросник Мак-Гилла (McGiIl Pain Questionnaire (MPQ)) и краткий опросник боли (Brief Pain Inventory (BPI)) позволяют оценивать болевой синдром независимо от индивидуальных особенностей уровня болевого порога [8, 9].
Любое оперативное вмешательство – это хирургическая агрессия, сопровождающаяся запуском стресс-ответа, повреждением клеточных структур, развитием воспалительного процесса, изменением метаболизма, эндокринного статуса, редокс-статуса, иммунного статуса, поэтому только клинические методы оценки послеоперационного болевого синдрома не могут в полной мере отразить изменения гомеостаза [10]. Стресс-ответ на операционную травму проявляется метаболическими, нейроэндокринными изменениями, одновременно запускается продукция про- и противовоспалительных маркёров [11]. Продолжительность оперативного вмешательства, возраст пациента, метод анестезии могут влиять на степень выраженности стресс-реакции [12]. Маркёрами нейроэндокринного ответа на хирургическую травму являются уровень глюкозы плазмы, кортизола и инсулина в сыворотке крови [13].
В физиологических условиях клетки макрофагального ряда с помощью активных форм кислорода и ферментов разрушают погибшие клетки и элементы клеточного матрикса [14-16]. При повреждении тканей высвобождаются медиаторы воспаления, РНК и ДНК, продукты метаболизма, белки теплового шока (heat shock proteins, HSP), фибриноген и другие факторы, которые обозначаются как фрагменты, ассоциированные с повреждением (Damage-associated molecular pattern, DAMP) [17, 18]. DAMP взаимодействуют с рецепторами на поверхности макрофагов – Toll-подобные (TLR) и внутриклеточные Nod-подобные (NLR), что приводит к их активации, модификации «сигнальных молекул» под действием протеинкиназ и синтезу цитокинов при участии ядерного фактора каппа-В (NF-κB): интерлейкина 1β (ИЛ-1β), фактора некроза опухолей-α (ФНО-α), ИЛ-6, интерферона-γ (ИФН-γ) [19]. М1-макрофаги продуцируют активные формы кислорода (АФК) и оксид азота (NO), синтезируют и активируют протеазы (коллагеназу и агреканазу), вызывающие разрушение клеточных элементов. Простагландин Е2 (PGЕ2), лейкотриен В4 (LТВ4), NO, субстанция Р, глутамат вызывают сенситизацию периферических болевых рецепторов и нейронов ноцицептивной системы, что резко повышает их возбудимость (рис. 1) [19]. М2-макрофаги, активация которых происходит под действием противовоспалительных медиаторов (ИЛ-4, ИЛ-10, и ИЛ-13), обеспечивают выход из воспаления, фагоцитируют и разрушают иммунные комплексы [20]. При активации макрофагов происходит усиление образования АФК. Повышение содержания катехоламинов в крови в послеоперационном периоде усиливает образование АФК.
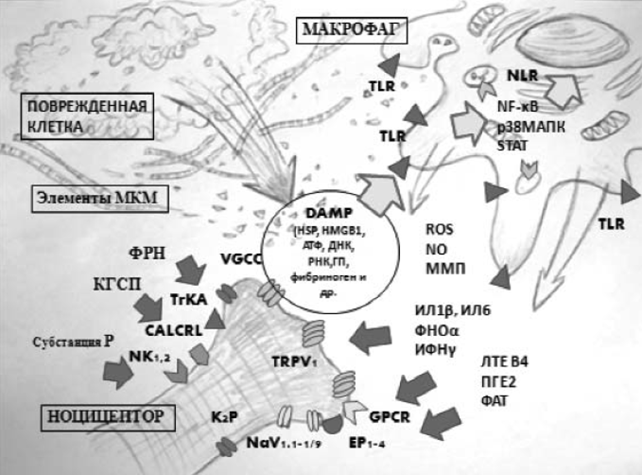
Рис. 1. Молекулярный механизм сенситизации периферического болевого рецептора при воспалении (цит. по [19])
АФК способны взаимодействовать со многими веществами, в том числе с ненасыщенными жирными кислотами, отнимая водород из групп -СН2- и превращая их в пероксидный радикал жирной кислоты, который может отнимать водород от другой молекулы жирной кислоты, и т.д. Запускается цепная реакция – перекисное окисление липидов (ПОЛ). АФК нужны лишь для инициирования реакции. Свободные радикалы, взаимодействуя с другими молекулами, превращаются в другие свободные радикалы либо неактивные продукты вследствие спонтанного разрыва цепи. Для обрыва цепной реакции используются антиоксиданты: cупероксиддисмутаза (СОД), каталаза, глутатион, к эндогенным неферментным антиоксидантам относятся α-токоферол, витамин К. Они защищают биологические структуры клеток от действия свободных радикалов за счет связывания пероксидных радикалов [10, 21]. Мишенями АФК и продуктов ПОЛ являются белки. Окислительная модификация белков (ОМБ) характеризуется образованием карбонильных групп (альдегидов и кетонов) и может быть и обратимой, и необратимой. Необратимое повреждение приводит к утрате их биологических свойств и дальнейшей деградации (рис. 2) [22].
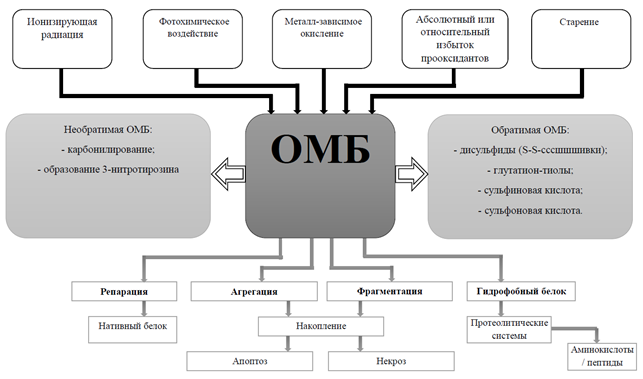
Рис. 2. Окислительная модификация белков: механизмы, варианты и последствия (цит. по [22])
Таким образом, ПОЛ и ОМБ являются универсальными механизмами повреждения в ответ на травму, а степень выраженности процессов свободнорадикального окисления может отражать уровень провоспалительных цитокинов и медиаторов. Вследствие локального воспалительного ответа у больных с гонартрозом после ТЭКС повышается внутрисуставной уровень таких провоспалительных цитокинов, как ИЛ-1β, ИЛ-6 и ФНО-α, и происходит привлечение макрофагов к месту травмы для утилизации поврежденных клеток и продуктов метаболизма [12, 23]. Провоспалительные цитокины вызывают не только локальное воспаление в области операции, но и системный воспалительный ответ, который характеризуется тахикардией, увеличением частоты дыхания, лейкоцитозом и лихорадкой [24].
Чрезмерный воспалительный ответ влияет на частоту послеоперационных осложнений, увеличивает сроки и стоимость лечения [7, 25]. Нормергический воспалительный процесс сдерживает иммуносупрессию в ответ на повреждение тканей и способствует более раннему восстановлению после операции [26]. Повышение внутрисуставного уровня ИЛ-6 коррелирует с более медленным восстановлением в течение первого месяца после операции, в то же время не было обнаружено такой взаимосвязи с уровнем ИЛ-6 и С-реактивным белком (СРБ) в сыворотке, поэтому Ugras A. A. et al. сообщают, что локальный воспалительный ответ важнее системного. Контроль за локальным воспалительным ответом может помочь в достижении лучших результатов лечения (рис. 3) [27].
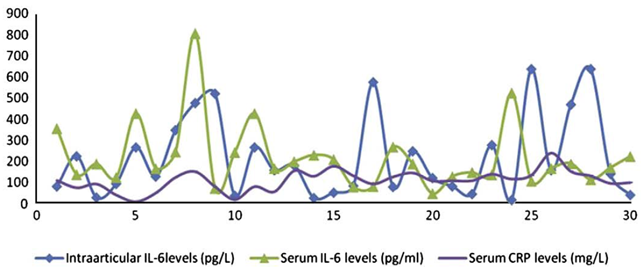
Рис. 3. Динамика уровня ИЛ-6 (внутрисуставного и в сыворотке) и СРБ в течение первого месяца после ТЭКС (цит. по [27])
Martin F. et al. в своей работе также показали, что блокада бедренного нерва способствует более раннему восстановлению после ТЭКС за счет снижения локального воспалительного ответа, в то время как концентрации цитокинов (ИЛ-1, ИЛ-10) в сыворотке достоверно повышались как в группе системного обезболивания, так и в группе блокады бедренного нерва, но статистически значимо не различались. При этом они не обнаружили корреляции между уровнем послеоперационной боли по ВАШ и уровнем цитокинов [28].
Однако Bagry H. et al. сообщают о корреляции между низким уровнем воспалительного ответа и низким уровнем болевого синдрома у пациентов с продленными блокадами седалищного нерва и поясничного сплетения в сравнении с системным введением морфина после ТЭКС. В качестве маркёров нейроэндокринного ответа на хирургическую травму они оценивали уровень глюкозы плазмы, кортизола и инсулина в сыворотке крови. Уровень этих маркёров был одинаковым в группе регионарных блокад (РБ) и в группе системного пациент-контролируемого обезболивания опиоидами. Однако количество лейкоцитов в крови в группе РБ было достоверно ниже (р<0,03). Была выявлена значительная корреляция между уровнем инсулина и ИЛ-6 (р<0,05). Исходный уровень СРБ и ИЛ-6 был сопоставим в обеих группах. Концентрация СРБ и ИЛ-6 через 24 и 48 часов повысилась в обеих группах, однако их уровень был ниже в группе РБ (р<0,05) [24].
Таким образом, различные стратегии ведения периоперационного периода могут ограничивать локальный воспалительный ответ и иметь полезные эффекты для восстановления пациента после операции. Анестезия не только обладает обезболивающим эффектом, но и снижает чрезмерный ответ на хирургическую агрессию и защищает организм от операционной травмы [29]. Механизм ограничения воспалительного ответа, очевидно, связан с действием местных анестетиков – важнейшего компонента регионарных методов обезболивания. Испытания на крысах показали, что введение местных анестетиков в области нервных волокон или поврежденных тканей уменьшает отек и высвобождение провоспалительных маркёров [30]. Местные анестетики реализуют свои противовоспалительные механизмы путем прерывания ноцицептивной передачи (снижения нейрогенного воспаления). Они блокируют натриевые каналы сенсибилизированных провоспалительными медиаторами (PGE2, ИЛ-1 и др.) ноцицепторов. Поскольку местное нейрогенное воспаление участвует в реализации реакций воспалительного процесса, то воздействие на него местными анестетиками будет влиять на периферическую и центральную сенсибилизацию, а сами местные анестетики могут ограничивать гиперергическое воспаление, не нарушая реализацию защитных реакций организма. Кроме этого, ограничение воспаления может быть достигнуто опиодсберегающим эффектом регионарных методов обезболивания, поскольку опиоиды обладают иммуносупрессивным действием [31, 32]. На роль маркёров выраженности воспалительных изменений могут претендовать показатели иммунного статуса, например ИЛ-1β, NF-κB, ИЛ-6, ФНОα, ИФНγ, ПГЕ2, ЛТЕ В4, субстанция Р. Однако у пациентов с остеоартритом наблюдается исходный повышенный уровень воспалительных маркеров [33].
Выводы
1. ТЭКС является высокотравматичной, технически сложной, но широко востребованной ортопедической операцией, которая вызывает выраженный стресс-ответ организма и нарушения гомеостаза, в ходе которого изменяются регуляция и выраженность воспалительного процесса, а также редокс-статус.
2. Для купирования послеоперационного болевого синдрома у больных, перенесших ТЭКС, может применяться широкий спектр методов регионарного обезболивания, поэтому необходим адекватный и персонифицированный выбор метода регионарного обезболивания, который позволит снизить риск развития осложнений и улучшить результаты лечения.
3. Для оценки эффективности анестезии в послеоперационном периоде у больных, перенесших ТЭКС, применяют клинические методы (визуально-аналоговую шкалу, опросники боли), которые не информируют о метаболических, нейроэндокринных и флогогенных изменениях гомеостаза. Представляется перспективным и клинически востребованным дополнительное исследование редокс-статуса организма как универсального механизма повреждения путем оценки уровня в сыворотке продуктов перекисного окисления липидов и окислительной модификации белков, которое позволяет провести комплексную оценку редокс-статуса в динамике послеоперационного периода и обеспечивает индивидуальный подход при выборе способа обезболивания после операции ТЭКС у пациентов с гонартрозом.
Библиографическая ссылка
Осиков М.В., Глазунов И.В., Силаев М.А. ПАТОФИЗИОЛОГИЧЕСКИЕ АСПЕКТЫ ВЫБОРА МЕТОДА ПОСЛЕОПЕРАЦИОННОГО ОБЕЗБОЛИВАНИЯ У ПАЦИЕНТОВ С ГОНАРТРОЗОМ ПОСЛЕ ТОТАЛЬНОГО ЭНДОПРОТЕЗИРОВАНИЯ КОЛЕННОГО СУСТАВА // Современные проблемы науки и образования. 2019. № 6. ;URL: https://science-education.ru/ru/article/view?id=29255 (дата обращения: 17.02.2026).



