Некротический энтероколит – тяжелое заболевание новорожденных [1]. Прижизненная оценка границ некроза кишки имеет большую актуальность, поскольку определяет объем резекции кишки. Субъективные сомнения в жизнеспособности участка кишки решаются в пользу резекции [2]. Неудаление некротического участка кишки в последующем приведет к развитию перитонита. В то же время необоснованная резекция жизнеспособной кишки приводит к энтеральной недостаточности [3].
Методы оценки жизнеспособности кишки, основанные на визуальной диагностике (некротический участок имеет темную окраску, тусклость серозной оболочки, дряблую и истонченную стенку, отсутствуют перистальтика кишки и пульсация сосудов брыжейки) являются субъективными, и ориентация только на них может привести к неправильной оценке витальных свойств органа [4].
Существуют инструментальные способы определения жизнеспособности кишки, такие как пигментная и трансиллюминационная вазоскопия, измерение амплитуды пульсовых осцилляций, определение тканевой оксигенации участка кишки, изменения рН серозного и слизистого слоев кишки, исследование энзиматических маркеров некроза кишечной стенки, локальная термометрия, лапароскопия, флюоресцентный метод, лазерная доплеровская флоуметрия, компьютерная томография. Наряду с преимуществами эти методы имеют недостатки: для одних требуется большая продолжительность определения, другие недостаточно информативны, неспецифичны, третьи высокозатратны или технически сложны и требуют наличия высокоточного медицинского оборудования и высококвалифицированного медицинского персонала [4].
Биофизические способы определения жизнеспособности кишки, основанные на регистрации биоэлектрической активности участков кишки (биоимпедансометрия), не обладают достаточной информативностью [5]. Поэтому актуальной является разработка метода оценки жизнеспособности участков кишки, который был бы объективным, простым, информативным, общедоступным и недорогим. Таким способом может явиться визуализация свечения патологически измененного (некротического, паранекротического) участка кишки в высокочастотном электромагнитном поле (ВЭМП).
Для апробации предлагаемого метода нами была использована модель некроза участка кишки, нарушение кровоснабжения в которой достигается путем перевязки нескольких сосудов брыжейки. В результате развиваются паранекротические изменения в стенке кишки с последующим переходом в некроз вовлеченного в патологический процесс участка, перфорацией и развитием перитонита [6]. Эта модель полностью соответствует современным представлениям о патогенезе развития некротического энтероколита по гемодинамическому варианту, когда при прогрессирующем течении заболевания возникают ишемические некрозы слизистой оболочки кишечника [7].
Целью исследования явился анализ визуализации биоптатов здорового, паранекротического и некротического участков кишки экспериментальных животных в высокочастотном электромагнитном поле.
Материал и методы исследования. Наблюдения были выполнены на 30 экспериментальных животных (беспородных кошках) весом 3,0±0,5 кг, которые были разделены на три группы: контрольная и две основные. Все исследования проведены в соответствии с Приказом № 755 от 12.08.1977 г. «О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных» и «Международными рекомендациями по проведению биомедицинских исследований с использованием животных», разработанными и принятыми Международным советом медицинских научных обществ (CIOMS), и одобрены локальным независимым этическим комитетом ФГБОУ ВО «Кубанский государственный медицинский университет» Минздрава России.
Накануне оперативного вмешательства проводилась подготовка животного: дегельминтизация, отмена кормления и премедикация. Оперативное вмешательство выполнялось на следующий день под наркозом (тиопентал натрия 60 мг/кг) с проведением сопутствующей инфузионной терапии. Срединным разрезом послойно вскрывали брюшную полость, определяли локализацию (терминальный отдел подвздошной кишки) и протяженность сегмента кишки, участвующего в эксперименте. Осуществляли забор материала (участок подвздошной кишки длиной 1 см) для контрольной группы (n=30), после чего кишку герметизировали швами. Выполняли визуализацию биоптатов участков здоровой кишки в газоразрядной камере КЭЛСИ, создающей высокочастотное электромагнитное поле (1024 Гц). Результаты записывали в виде avi фильма с определением яркости свечения, спектра длины волн, площади свечения и сохраняли их на электронном носителе. Полученный материал отправляли на гистологическое исследование.
Далее перевязывали аркадные и краевые сосуды брыжейки выбранного участка шелковыми лигатурами. По изменению цвета кишечной стенки судили об изменении в ней кровотока, после чего кишку погружали в брюшную полость, а операционную рану послойно ушивали.
У первой группы кошек (n=16) через 6 часов осуществляли релапаротомию и визуально оценивали макроскопические изменения участка кишки, лишенного кровоснабжения. Во всех случаях наблюдаемые нами изменения идентифицировали как паранекроз. Далее осуществляли резекцию участка здоровой и участка измененной кишки. Целостность кишки восстанавливали путем наложения прямого анастомоза, послойно ушивали операционную рану. Полученные биоптаты тонкой кишки тотчас помещали на газоразрядную камеру КЭЛСИ и снимали avi фильм, определяя яркость свечения, спектр длин волн и площадь свечения. Проводили гистологическое исследование биоптатов кишки. Изготавливали и окрашивали гистологические препараты тонкой кишки с последующим их исследованием по следующей методике: фиксировали морфологический препарат в забуференном 10%-ном растворе формалина в течение суток. Затем в гистопроцессоре замкнутого типа Tissue-Tek, Sakura (Япония) проводили обезвоживание и заливали материал в парафин с последующим изготовлением срезов толщиной 3–4 мкм. В автоматическом мультистейнере Tissue-TekPrism (Япония) срезы окрашивали гематоксилин-эозином и проводили их морфологическую оценку с использованием светового микроскопа «МББ 1А» при увеличении 400х.
У второй группы кошек (n=14) через 12 часов макроскопические изменения кишки соответствовали некрозу. Алгоритм исследования был таким же.
При помощи компьютерной программы «STATISTIKA 6,0» определяли нормальность распределения и использовали параметрические методы. Определяли М – среднюю арифметическую и SD – среднее квадратичное отклонение. Результаты считали достоверными при р<0,05.
Результаты исследования и их обсуждение. Биоптат здорового участка тонкой кишки кошки (рисунок, фрагмент 2) в высокочастотном электромагнитном поле имел только краевое свечение (эффект Кирлиана) (рисунок, фрагмент 1, таблица). Гистологический анализ биоптата (рис. 1, фрагмент 3) показал, что все слои стенки кишки сохранены и четко видны: слизистая тонкой кишки представлена эпителием (синяя стрелка) и собственной пластинкой слизистой (красная стрелка). Серозная оболочка не изменена, без наложений.
Через 6 часов после перевязки сосудов брыжейки (рисунок, фрагмент 5) развивались паранекротические изменения кровоснабжаемого этими сосудами участка тонкой кишки. Гистологическая картина соответствовала макроскопическим изменениям: эпителий тонкой кишки с лейкоцитарной инфильтрацией (синяя стрелка), отек собственной пластинки слизистой (красная стрелка); полнокровие сосудов серозного слоя со слабо выраженной лейкоцитарной инфильтрацией (зеленая стрелка) и единичными пристеночными лейкоцитами в просвете сосудов (желтая стрелка). Дифференцировка слоев стенки кишки не нарушена (рисунок, фрагмент 6). Биоптат паранекротического участка тонкой кишки кошки в ВЭМП наряду с краевым имел и внутреннее свечение в толще кишки (рисунок, фрагмент 4). Общая яркость свечения превышала таковую при биоптате здорового участка кишки на 7,1%. Гистограмма длины волн свечения биоптата паранекротического участка тонкой кишки кошки имела максимум в диапазоне более длинных волн. Там же находилась медиана длины волн свечения, которая на 19,1% превышала таковую свечения биоптата здорового участка тонкой кишки кошки (таблица).
Параметры свечения биоптатов кишки кошки (М±SD)
|
Параметры |
Здоровый участок n=30 |
Паранекроз n=16 |
Некроз n=14 |
|
1 |
2 |
3 |
|
|
Длина биоптата (мм) |
3,2±1,1 |
3,0±1,2 P1>0,05 |
3,1±0,7 P2>0,05 P3>0,05 |
|
Наружный диаметр биоптата (мм) |
0,6±0,6 |
0,7±0,4 P1>0,05 |
0,6±0,4 P2>0,05 P3>0,05 |
|
Внутренний диаметр биоптата (мм) |
0,3±0,6 |
0,3±0,4 P1>0,05 |
0,3±0,4 P2>0,05 P3>0,05 |
|
Площадь очага свечения (мм2) |
- |
102,0±21,6 |
134,3±14,8 P2<0,001 |
|
Общая яркость свечения (бит) |
126,0±16,5 |
135,0±10,4 P1<0,05 |
190,0±17,4 P2<0,001 P3<0,001 |
|
Наибольшая яркость свечения (бит) |
- |
79,0±4,0 |
81,7±3,3 P2>0,05 |
|
Нижняя граница диапазон длины волн (нм) |
404,2±1,1 |
404,4±0,8 P1>0,05 |
411,6±5,2 P2<0,001 P3<0,001 |
|
Верхняя граница Диапазон длины волн (нм) |
646,2±1,7 |
645,8±1,2 P1>0,05 |
642,3±3,3 P2>0,05 P3>0,05 |
|
Диапазон длины волн (нм) |
242,0±3,3 |
241,4±1,6 P1>0,05 |
230,7±7,8 P2<0,001 P3<0,001 |
|
Медиана (нм) |
470,0±48,9 |
560,0±18,4 P1<0,001 |
585,7±13,0 P2<0,001 P3<0,001 |
Примечание. P1 – показатель достоверности между данными столбцов
1 и 2; P2 – между 2 и 3; P3 – между 1 и 3.
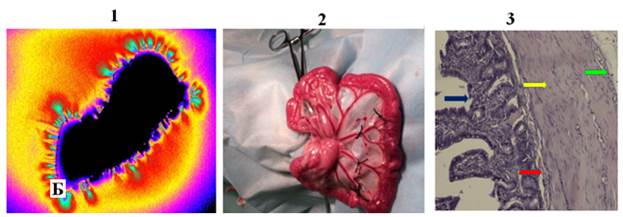
Здоровый участок тонкой кишки
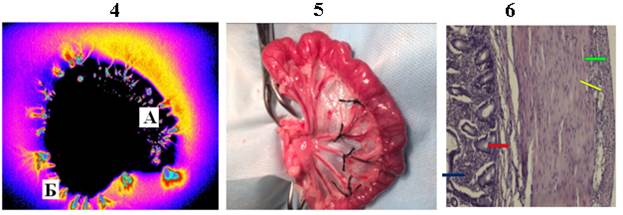
Участок кишки через 6 часов после перевязки артерий (паранекроз)
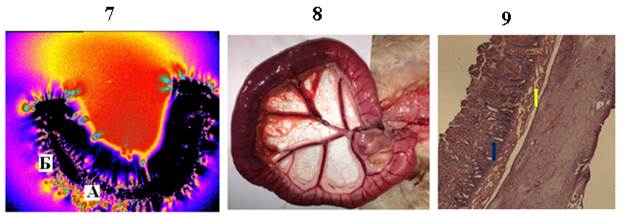
Участок кишки через 12 часов после перевязки артерий (некроз)
Внутреннее (А) и краевое (Б) свечение биоптатов тонкой кишки кошки в исходном состоянии (фрагмент 1), на модели паранекроза (фрагмент 4) и некроза (фрагмент 7). Фрагмент 2 – биоптат здорового участка кишки; фрагмент 3 – микропрепарат здорового участка кишки; фрагмент 5 – биоптат кишки при паранекрозе; фрагмент 6 – микропрепарат кишки при паранекрозе; фрагмент 8 – биоптат кишки при некрозе; фрагмент 9 – микропрепарат кишки при некрозе
Через 12 часов после перевязки сосудов брыжейки развивался некроз участка тонкой кишки (рисунок, фрагмент 7). Гистологический анализ биоптата (рисунок, фрагмент 9) показал наличие некроза: десквамация эпителия и изъязвления слизистой тонкой кишки (синяя стрелка), полнокровие сосудов и кровоизлияния в собственной пластинке слизистой (желтая стрелка), деструктурирование оболочек кишечной стенки. Биоптат некротического участка тонкой кишки экспериментального животного в ВЭМП светился по краям (краевое свечение) и в толще кишки (внутреннее свечение) (рисунок, фрагмент 8, таблица). Гистограмма яркости свечения имела двугорбый характер: один горб отражал краевое, а другой – внутреннее свечение. Общая яркость свечения превышала таковую участка с паранекрозом на 40,7%. Гистограмма длины волн свечения биоптата некротического участка тонкой кишки кошки также имела максимум в диапазоне более длинных волн. Там же находилась медиана длины волн свечения.
Заключение. При помещении биоптатов здоровой кишечной стенки экспериментального животного в ВЭМП выявлено только краевое свечение (эффект Кирлиана). При исследовании биоптатов кишки с паранекрозом в высокочастотном электромагнитном поле через 6 часов после перевязки мезентериальных сосудов, помимо краевого, зафиксировано появление еще и внутреннего свечения. Мезентериальная ишемия в течение 12 часов привела к некрозу кишки, при этом отмечены увеличение зоны внутреннего свечения в ВЭМП, повышение яркости свечения биоптатов и смещение диапазона свечения в сторону большей длины волны. При паранекрозе и некробиозе наблюдаются дистрофические изменения, характеризующиеся преобладанием катаболических реакций над анаболическими, которые протекают с высвобождением энергии. Это высвобождение энергии усиливается высокочастотным электромагнитным полем, что и проявляется очагами свечения в этих участках. При некрозе энергии выделяется больше, и внутреннее свечение, как следствие, будет сильнее.
Таким образом, факт выявляемой разницы свечения в ВЭМП участков паранекроза и некробиоза является диагностически значимым в определении границ резекции нежизнеспособной кишки.
Библиографическая ссылка
Колесников Е.Г., Тараканов В.А., Абушкевич В.Г., Шамик В.Б., Стрюковский А.Е., Старченко В.М. СВЕЧЕНИЕ БИОПТАТОВ УЧАСТКОВ ТОНКОЙ КИШКИ В ВЫСОКОЧАСТОТНОМ ЭЛЕКТРОМАГНИТНОМ ПОЛЕ НА МОДЕЛИ НЕКРОТИЧЕСКОГО ЭНТЕРОКОЛИТА // Современные проблемы науки и образования. 2019. № 4. ;URL: https://science-education.ru/ru/article/view?id=29129 (дата обращения: 16.02.2026).



