В настоящее время считается, что в патогенезе рассеянного склероза (РС) значимая роль отводится генетическим факторам. Установлено значение отдельных генов, а также их полиморфных участков в наследственной предрасположенности РС в различных этнических группах, однако даже в одной группе клинико-генетические данные могут быть противоречивы [1]. В связи с этим изучение генетики РС не теряет своей актуальности, в том числе в Пермском крае, где констатирован средний уровень распространенности заболевания [2].
Основными генетическими факторами предрасположенности к РС считаются гены HLA-системы [1], в то же время участие и других, не связанных с иммунорегуляцией, генов в патогенезе РС показано в ряде исследований. Одним из таких генов является ген CIT (citron rho-interacting serine/threonine kinase), кодирующий цитронкиназу – участника деления и дифференцировки клеток. Цитронкиназа играет роль в развитии центральной нервной системы; совместно с белками члена семейства кинезинов, в частности Kinesin family member 14 (KIF14), локализуется в центральной части веретена и способствует эффективному цитокинезу [3]. Белок KIF14 в эксперименте был определен как фактор развития пороков центральной нервной системы, а также недостаточной миелинизации нервных волокон [4]. Однако достоверных данных о влиянии цитронкиназы на процессы миелинизации не получено. Снижение экспрессии белка CIT приводит к нарушению цитокинеза и достоверно ассоциировано с развитием аутосомно-рецессивной первичной микроцефалии [5]. Ряд полиморфизмов гена CIT связан с риском биполярного расстройства и шизофрении [6].
У пациентов с РС полиморфизм rs7308076 показан как влияющий на эффективность терапии препаратами интерферона-бета [7]. В исследовании S. Bourguiba-Hachemi [8], целью которого было определение влияния данного полиморфизма на риск развития РС у пациентов арабской популяции, не установлено достоверных различий генотипов в группе больных и контроле (p>0,05).
Учитывая вовлеченность гена CIT в развитие структурной патологии центральной нервной системы, интерес представляет его изучение и у больных РС в различных популяциях, даже несмотря на недостаточность имеющихся данных.
Цель исследования – определить ассоциации однонуклеотидного полиморфизма rs7308076 гена CIT с клиническими проявлениями рассеянного склероза у больных в Пермском крае.
Материалы и методы исследования
Исследуемую группу составили 204 неродственных между собой пациента с достоверным диагнозом «рассеянный склероз». Критериями включения в исследование явились: рецидивирующе-ремиттирующий и вторично прогрессирующий тип течения РС; длительность заболевания с момента первых симптомов не менее 6 месяцев; отсутствие курсов кортикостероидной или цитостатической терапии за последние 6 месяцев, добровольное информированное согласие на участие в исследовании. Критериями исключения явились другие дегенеративные заболевания нервной системы, первично-прогрессирующее течение РС, наличие сопутствующих онкозаболеваний, беременности, отказ от участия в исследовании.
Обследование проходило на базе Центра рассеянного склероза и отделения неврологии ГБУЗ ПК «Ордена “Знак почета” Пермская краевая клиническая больница».
Группу контроля составили 80 практически здоровых добровольцев, не имеющих родственников с диагнозом РС.
В ходе клинического осмотра выраженность клинических проявлений оценивалась с помощью шкалы функциональных систем Kurtzke, расширенной шкалы инвалидизации (Expanded Disability Status Scale, EDSS), шкалы неврологического статуса института Scripps, шкалы оценки функции рук Arm-index и шкалы тяжести астении Fatigue Severity Score (FSS) [9]. Скорость прогрессирования заболевания, рассчитанная как отношение балла EDSS к длительности заболевания (в годах), определялась как низкая при значении ≤0,25 балла/год, умеренная >0,25, но ≤0,75 балла/год, или высокая >0,75 балла/год [10].
Мощность исследования рассчитывалась при помощи онлайн-калькулятора GAS Power Calculator (http://csg.sph.umich.edu/abecasis/gas_power_calculator/index.html).
Генетический анализ проводился на образцах ДНК, полученных из цельной венозной крови больных РС методом полимеразной цепной реакции (ПЦР), в реальном времени с использованием реакционной смеси для проведения ПЦР (ЗАО «Синтол», Россия), праймеров и зондов (Thermo Fisher Scientific, США) для полиморфизма rs7308076 гена CIT. Генетический анализ и обработка полученных данных методом аллельной дискриминации проводились с помощью детектирующего амплификатора CFX96 и программного обеспечения CFX Manager 2.1 (Biorad, США).
Статистическая обработка осуществлялась с использованием программного пакета Statistica 10,0 (Statsoft, США) с расчетом коэффициента корреляции Спирмена, критерия Манна–Уитни для независимых групп, а также критерия Краскела–Уоллиса при множественном сравнении. Анализ клинико-генетических ассоциаций проведен с помощью программного обеспечения SNPstats (Institut Català d’Oncologia, Испания). Различия считались достоверными при p<0,05.
Проведение исследования одобрено этическим комитетом ФГБОУ ВО «Пермский государственный медицинский университет им. академика Е.А. Вагнера» Минздрава России.
Результаты исследования и их обсуждение
Рассчитанная мощность данного исследования равнялась 0,9, что является приемлемой и позволяет судить о достоверности полученных данных.
В группе пациентов с РС преобладали женщины (66,01%). Средний возраст выборки составил 40,02±10,82 года. Средний возраст дебюта заболевания обследуемых составил 29,47±9,22 года. Длительность заболевания варьировала в пределах от 6 месяцев до 28 лет, равняясь в среднем 10,55±6,91 года.
У большинства больных заболевание носило ремиттирующий характер (83,9%), в остальных случаях – вторично-прогредиентный.
По виду получаемого лечения пациенты распределились следующим образом: 56,31% (n=116) – препараты интерферона-бета, 16,99% (n=35) – глатирамера ацетат, 13,59% (n=28) – натализумаб, 4,37% (n=9) – другие препараты, 8,74% (n=18) – терапию не получали или прекратили прием лекарственных средств не менее чем за 6 месяцев до момента участия в исследовании.
Исследуемая группа характеризовалась умеренной степенью инвалидизации, среднее значение шкалы EDSS составило 4,16±1,66 балла. Большинство пациентов (57,28%) имели умеренную скорость прогрессирования РС, средняя скорость прогрессирования заболевания составила 0,66±0,79 балла/год.
Выявлена корреляционная связь средней силы между параметром EDSS и возрастом пациента (R=0,44; p=0,00000), EDSS и длительностью заболевания (R=0,46; p=0,00000). Общий балл EDSS коррелирует с выраженностью симптомов по каждой функциональной системе шкалы Kurtzke: функциями ствола головного мозга (R=0,7; p=0,00000), пирамидной системы (R=0,83; p=0,00000), мозжечка (R=0,8; p=0,00000), изменением чувствительности (R=0,59; p=0,00000), контролем тазовых функций (R=0,74; p=0,00000).
Среднее значение по шкале неврологического статуса Scripps составило 63,89±18,08 балла, что обратно пропорционально баллу EDSS (R=–0,87; p=0,000000), а также оценке пирамидной (R=–0,84; p=0,00000), координаторной (R=–0,77; p=0,00000), чувствительной (R=–0,61; p=0,00000) функциональных систем, функциям ствола головного мозга (R=–0,7; p=0,00000), тазовым функциям (R=–0,75; p=0,00000) по шкале Kurtzke.
Средний балл по опроснику тяжести астении FSS составил 4,05±1,73. Балльная оценка шкалы FSS коррелировала с результатом EDSS (R=0,44; p=0,000000), оценкой пирамидной системы (R=0,39; p=0,000000), функций ствола (R=0,39; p=0,000000), тазовых органов (R=0,41; p=0,000000), корковыми функциями (R=0,46; p=0,000000), а также баллом Arm-index (R=0,34; p=0,000001).
Шкала оценки функции рук Arm-index использовалась в качестве дополнения к оценке двигательных нарушений. Балл по Arm-index варьировал от 0 до 5, составляя в среднем 1,25±0,81. Выраженность нарушений функции рук коррелировала со значением балла EDSS (R=0,70, p=0,000000), длительностью заболевания (R=0,30, p=0,000006), а также оценкой пирамидной (R=0,65; p=0,000000) и координаторной (R=0,64; p=0,000000) функциональных систем.
Достоверных различий выраженности клинических проявлений по баллам EDSS (U=4449,0; p=0,44), Scripps (U=4719,0; p=0,92), Arm-index (U=4575,0; p=0,64), FSS (U=3942,5; p=0,05), а также скорости прогрессирования (U=4437,0; p=0,47) в группах, выделенных по полу, не получено.
В группе больных, имеющих вторично-прогредиентный тип течения РС, отмечена более выраженная степень поражения нервной системы по изучаемым шкалам (рис. 1).
а) 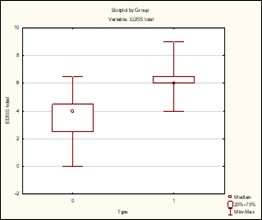 б)
б) 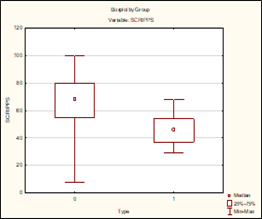
в) 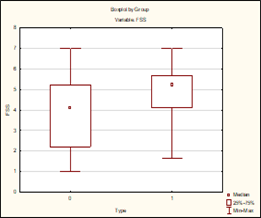 г)
г) 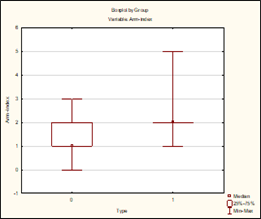
Рис. 1. Степень выраженности поражения нервной системы в зависимости от типа течения РС (0 – рецидивирующе-ремиттирующий тип, 1 – вторично-прогрессирующий тип): а) по шкале EDSS (p=0,00000); б) по шкале Scripps (p=0,00000); в) по шкале FSS (p=0,003); г) по шкале Arm-index (p=0,000002)
В группах в зависимости от типа течения РС не установлено различий в значении скорости прогрессирования РС (p=0,41) (рис. 2).
Рис. 2. Значение скорости прогрессирования РС в зависимости от типа течения (0 – рецидивирующе-ремиттирующий тип, 1 – вторично-прогрессирующий тип)
Генетическое исследование по полиморфному маркеру rs7308076 CIT в группе больных РС показало распределение частоты генотипов C/C, C/T, T/T – 40,68%, 48,04% и 11,28% соответственно, распределение аллелей C – 64,7% и T – 35,3%.
В группе контроля также преобладал гетерозиготный генотип (50%), генотип C/C выявлен у 43,75% лиц, T/T – у 6,25%. Как и в исследуемой группе, у здоровых лиц чаще встречался аллель С (68,75%).
Достоверных различий генотипов между группой больных РС и контрольной группой получено не было, что представлено в таблице.
Не определена достоверная связь между генотипами полиморфизма rs7308076 CIT и баллом EDSS (p=0,65), FSS (p=0,79), Scripps (p=0,95), Arm-index (p=0,47) в общей выборке, а также в группах, выделенных по половому признаку.
Также в исследовании не определено зависимости скорости прогрессирования РС от генотипов rs7308076 CIT (p=0,7).
Не установлено достоверной связи доминирующего аллеля rs7308076 с выраженностью клинической симптоматики по шкалам EDSS (p=0,12), Scripps (p=0,23), FSS (p=0,52), Arm-index (p=0,34).
Несмотря на ранее выявленную связь полиморфизма rs7308076 CIT с эффективностью терапии препаратами интерферона-бета, в настоящем исследовании определена достоверная связь выраженности пирамидной симптоматики с генотипом C/C в группе пациентов, получающих глатирамера ацетат (OR 0,66, 95% CI 0,08 – 1,24), и генотипа C/T у пациентов, получающих препараты интерферона-бета (OR 0,45, 95% CI 0,03 – 0,87), p=0,026. Корреляций генотипа с общим баллом EDSS, FSS, Arm-index, Scripps в зависимости от получаемого препарата не получено.
Ассоциация носительства аллелей полиморфизма rs7308076 гена CIT с наличием рассеянного склероза
|
Модель наследования |
Генотип |
Контрольная группа, n (%) |
Исследуемая группа, n (%) |
OR (95% CI) |
p |
|
Кодоминантная |
C/C |
35 (43,8%) |
83 (40,7%) |
1,00 |
0,41 |
|
C/T |
40 (50%) |
98 (48%) |
1,03 (0,60–1,77) |
||
|
T/T |
5 (6,2%) |
23 (11,3%) |
1,94 (0,68–5,51) |
||
|
Доминантная |
C/C |
35 (43.8%) |
83 (40,7%) |
1,00 |
0,64 |
|
C/T-T/T |
45 (56,2%) |
121 (59,3%) |
1,13 (0,67–1,91) |
||
|
Рецессивная |
C/C-C/T |
75 (93,8%) |
181 (88,7%) |
1,00 |
0,18 |
|
T/T |
5 (6,2%) |
23 (11,3%) |
1,91 (0,70–5,20) |
||
|
Сверх-доминантная |
C/C-T/T |
40 (50%) |
106 (52%) |
1,00 |
0,77 |
|
C/T |
40 (50%) |
98 (48%) |
0,92 (0,55–1,55) |
Таким образом, исследование, направленное на выявление ассоциаций однонуклеотидного полиморфизма rs7308076 гена CIT и выраженности клинических проявлений рассеянного склероза, не показало значимых результатов на примере выборки больных Пермского края. Несмотря на ранее продемонстрированное влияние данного полиморфизма на эффективность терапии препаратами интерферона-бета, достоверной связи с клиническими показателями, в том числе скоростью прогрессирования, не получено. Выявлена ассоциация генотипа С/Т с выраженностью пирамидной симптоматики у пациентов, получающих препараты интерферона-бета, а также генотипа С/С – у получающих глатирамера ацетат.
Выводы
1. В исследуемой выборке не выявлено влияния генотипов полиморфизма rs7308076 CIT на развитие рассеянного склероза, выраженность клинических проявлений и скорость его прогрессирования.
2. Впервые установлена ассоциация степени поражения пирамидной системы с генотипом C/Т rs7308076 CIT у пациентов, получающих препараты интерферона-бета.
3. Установлена корреляция генотипа С/С у больных, принимающих глатирамера ацетат, с выраженностью поражения пирамидной системы.
Библиографическая ссылка
Селянина Н.В., Арбузова Е.Е., Кривцов А.В. ВЛИЯНИЕ ОДНОНУКЛЕОТИДНОГО ПОЛИМОРФИЗМА RS7308076 ГЕНА CIT НА ВЫРАЖЕННОСТЬ КЛИНИЧЕСКИХ ПРОЯВЛЕНИЙ РАССЕЯННОГО СКЛЕРОЗА // Современные проблемы науки и образования. 2019. № 4. ;URL: https://science-education.ru/ru/article/view?id=29115 (дата обращения: 16.02.2026).



