По данным Всемирной организации здравоохранения, сердечно-сосудистые заболевания являются основной причиной смерти в мире. В общей сложности сердечно-сосудистые заболевания привели к 17,9 миллиона смертей (32,1%) в 2015 году, по сравнению с 12,3 миллиона (25,8%) в 1990 году [1; 2]. В 2015 году в мире хроническими облитерирующими заболеваниями артерий нижних конечностей (ХОЗАНК) страдало около 155 миллионов человек [3]. В Российской Федерации распространенность ХОЗАНК составляет от 1,5 до 5%, преимущественно среди лиц пожилого возраста. Особого внимания заслуживает работа Харазова А.Ф., по его данным, из 71 миллиона человек из всех федеральных округов РФ было зарегистрировано 174 125 случаев симптомных заболеваний периферических артерий у людей старше 40 лет, что составило 0,51%. В то время как распространенность перемежающейся хромоты - 0,36%, и распространенность критической ишемии конечности составляет 0,13% [4].
В результате повсеместного увеличения среднего возраста населения вопрос ХОЗАНК как клинической проблемы встает все более остро. Факторы риска ХОЗАНК соответствуют общим факторам риска сердечно-сосудистых заболеваний, таких как курение, гипертония, гиперлипидемия, диабет и метаболический синдром [5; 6]. Течение ХОЗАНК у пациентов с первоначально асимптомным началом или с легкими или умеренными симптомами при физической нагрузке сравнительно легкое, что противоположно быстрой динамике ухудшения состояния у тех, у кого исходно выявлялись ишемические боли в покое или изъязвления конечности [7; 8].
Ведение пациентов с ХОЗАНК нацелено на снижение рисков прогрессирования заболевания и развития сердечно-сосудистых осложнений, а также на снижение проявления симптомов. Для всех пациентов группы заболеваний ХОЗАНК рекомендуется тактика снижения риска сердечно-сосудистых заболеваний и ограничение дальнейшего распространения атеросклероза в будущем. Для пациентов с ХОЗАНК рекомендуется долгосрочная антиагрегантная терапия, отказ от курения, липидоснижающая терапия, а также терапия диабета и артериальной гипертензии [9; 10].
При ХОЗАНК, помимо модификации рисков, прежде чем проводить хирургическое вмешательство, рекомендуется физиотерапия, а также фармакотерапия как первоначальный подход (класс 1B). По возможности пациентам рекомендуется ЛФК под наблюдением врача, а не самостоятельные упражнения (класс 2B). Для тех больных, которые, следуя рекомендациям от полугода до года, не добились целевых показателей, рекомендовано проводить реваскуляризацию [11; 12] .
Все это определило цель нашего исследования - улучшение результатов консервативной терапии у полиморбидных пациентов с хронической артериальной недостаточностью нижних конечностей с язвенно-некротическими изменениями (IVа степени) путем разработки оптимальных схем терапии в амбулаторно-поликлинических условиях.
Материал и методы исследования
В исследование вошло 145 пациентов с хронической ишемией нижних конечностей, которым было проведено лечение и наблюдение с оценкой отдаленных результатов терапий в сроки до 2 лет. Все больные были разделены на 2 группы пациентов.
При распределении пациентов по гендерному признаку, возрасту, уровню поражения нижних конечностей статистически значимых различий в группах не обнаружено.
В первой группе (76 пациентов) больные находились на диспансерном наблюдении у хирурга в поликлинике и проходили курсы консервативной терапии согласно стандартам и рекомендациям по лечению пациентов в амбулаторных условиях. Во второй группе, в которую вошли 69 пациентов, наряду со стандартной терапией применялась стимуляция физиологического ангиогенеза (тренировочная ходьба) и стимуляция иммунитета для купирования воспалительных изменений у пациентов с трофическими нарушениями (введение ронколейкина). Усовершенствованная тактика предполагала применение липидоснижающей диеты, лекарственной терапии с учетом стадии заболевания и наличия сопутствующей патологии, стимуляции иммунитета, воздействия магнитными полями, массажа, лазерной терапии и лечебно-физкультурных упражнений.
Кроме того, всем пациентам обеих исследуемых групп выполнялась хирургическая обработка трофических ран нижних конечностей.
Кроме общеклинического обследования, о нарушениях гемодинамики конечностей судили с помощью ультразвуковой доплерографии, которая проводилась с использованием аппарата «Sonоsoaid», при этом определяли также лодыжечно-плечевой индекс (ЛПИ); дуплексного сканирования с цветным изображением, которое выполнялось с использованием ультразвуковой диагностической системы «ACUSON 128XP10».
Сравнение в группах проводилось с помощью теста Манна-Уитни. Различия признавались статистически значимыми при уровне р < 0,05.
Результаты исследования
При проведении сравнительной оценки биохимических показателей у пациентов обеих исследуемых групп на первом году наблюдения были отмечены статистически значимые различия по 5 показателям: ЛПИ, прирост ЛДФ, уровни тромбоцитов, триглицеридов и глюкозы в крови, а на втором году уже по 8 показателям: ЛПИ, прирост ЛДФ, уровни тромбоцитов, триглицеридов, общего холестерина, ЛПНП, С-реактивного белка и глюкозы в крови.
Анализ значений ЛПИ за первый год наблюдения показал преобладание более высоких показателей во II исследуемой группе (p=0.006). У этих больных медиана значения ЛПИ составила 0.7 (интерквартильный размах от 0.6 до 0.8), а у пациентов, которые проходили курсы стандартной терапии, этот показатель был ниже - 0.6 (интерквартильный размах от 0.5 до 0.7). Во второй год были отмечены более низкие уровни показателей ЛПИ в группе стандартной терапии (p=0.0007). Медиана значения индекса за второй год в I группе снизилась до уровня 0.5 (интерквартильный размах от 0.4 до 0.7), тогда как во второй группе ее показатель остался на уровне 0.7 (интерквартильный размах от 0.6 до 0.8). Таким образом, эти данные демонстрируют нам более заметный эффект на динамику состояния микроциркуляторного русла в группе с модифицированной терапией.
Отмечен больший прирост показателя ЛДФ в группе с применением стандартной терапии в сочетании со стимуляцией физиологического ангиогенеза и иммунитета как в первый год (p<0.0001), так и во второй год (p=0.0003) по сравнению с первой группой, что свидетельствует о более выраженном улучшении перфузии тканей, а значит и регенерации трофических расстройств.
К первому году наблюдения показатели тромбоцитов во второй группе указывали на достоверно(p=0.02) менее выраженный риск тромбообразования при значении медианы 234*109/л (интерквартильный размах от 227*109/л до 345*109/л), в то время как в группе с применением стандартной терапии этот показатель был выше - 288*109/л (интерквартильный размах от 234*109/л до 350*109/л). Еще более явные различия были выявлены в ходе 2-го года наблюдения (p=0.002). Так, медиана значения тромбоцитов за второй год в группе с применением стандартной терапии составила 312*109/л (интерквартильный размах от 240*109/л до 365*109/л). В группе же с применением модифицированной терапии ее значение составило только 232*109/л (интерквартильный размах от 221*109/л до 356*109/л).
Для сравнения исследуемых групп были проанализированы 6 качественных показателей: ампутации в течение первого и второго года, общее количество ампутаций за весь период наблюдения, а также реконструктивные операции за 1-й и 2-й год и общее количество реконструктивных операций за период наблюдения. В ходе сравнения групп по частоте ампутаций и реконструктивных операций статистически значимые различия были выявлены только в показателе ампутаций за 2-й год (рис. 1-3).
У 66 пациентов (87%) первой группы за второй год не проводилось ампутаций, а у 10 (13%) пациентов была произведена высокая ампутация нижней конечности, а малых ампутаций не отмечено. Во второй группе у 63 пациентов (91%) за 2-й год не было проведено ампутаций, у 2 была произведена высокая ампутация нижней конечности (3%), а у 4 - малая ампутация (6%). Таким образом, у пациентов II группы наблюдалось достоверно меньшее количество ампутаций за 2-й год по сравнению с группой с применением стандартной терапии (p=0.008) (рис. 1).
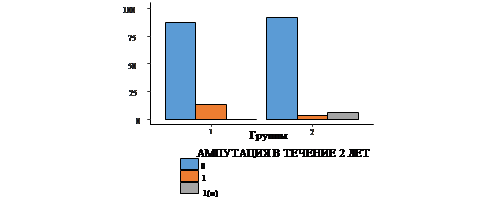
Рис. 1. Частота ампутаций в исследуемых группах за 1-й и 2-й годы
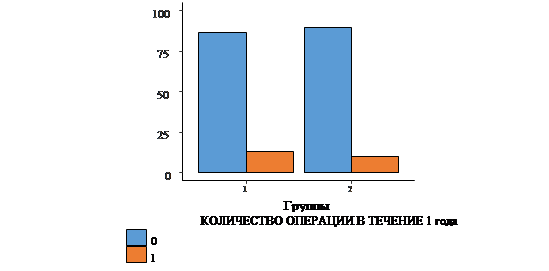
Рис. 2. Сравнение количества повторных операций в обеих исследуемых группах за первый год
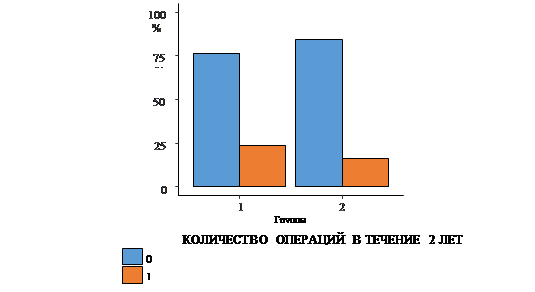
Рис. 3. Сравнение количества реконструктивных операций в группах в течение 2 лет
Далее был проведен экономический анализ. Так, средняя ожидаемая величина затрат на 1 пациента за 2 года, подвергшегося лечению консервативным методом, составляет:
- при малой ампутации (диспансерное наблюдение сосудистого хирурга 2 года 3 795 руб.+ лечение в круглосуточном стационаре (2 года) 119 055,6 руб.+ стоимость малых ампутаций за 2 года 2 970,2 руб.) – 125 820,8 руб.;
- при ампутации с установкой протеза голени (диспансерное наблюдение сосудистого хирурга 2 года 3 795 руб.+ лечение в круглосуточном стационаре (2 года) 119 055,6 руб. + затраты на протез голени за 2 года 35 894 руб. + стоимость ампутаций за 2 года 5 150,7 руб.) = 163 895,5 руб.;
- при ампутации с установкой протеза бедра (диспансерное наблюдение сосудистого хирурга 2 года 3 795 руб.+ лечение в круглосуточном стационаре (2 года) 119 055,6 руб. + затраты на протез бедра за 2 года 49 320 руб. + стоимость ампутаций за 2 года 5 150,7 руб.) = 177 321,3 руб.
В случае стационарзамещающей терапии:
- при малой ампутации (диспансерное наблюдение сосудистого хирурга 2 года 3 795 руб.+ лечение в дневном стационаре 35 744 руб. (2 года) + стоимость малых ампутаций за 2 года 1 300,7 руб.) – 40 839,7 руб.;
- при ампутации с установкой протеза голени (диспансерное наблюдение сосудистого хирурга 2 года 3 795 руб.+ лечение в дневном стационаре 35 744 руб. (2 года) + затраты на протез голени за 2 года 17 030 руб.+ стоимость ампутаций за 2 года 2 255,8 руб.) = 58 824,8 руб.;
- при ампутации с установкой протеза бедра (диспансерное наблюдение сосудистого хирурга 2 года 3 795 руб.+ лечение в дневном стационаре 35 744 руб. (2 года) + затраты на протез бедра за 2 года 23 400 руб. + стоимость ампутаций за 2 года 2 255,8 руб.) = 65 194,8 руб.
Обсуждение результатов исследования
В зависимости от степени ишемии, наличия сопутствующей патологии, динамики ЛПИ и ЛДФ, а также уровней биохимических показателей нами был разработан прогностический алгоритм определения ожидаемого результата, который расценивался как положительный (регенерация трофической язвы), удовлетворительный (отсутствие клинической динамики ишемии конечности, малая ампутация или некрэктомия) и неудовлетворительный (большая ампутация). Такая модель позволяет быстро прогнозировать исход и выбирать соответствующую терапию, а также корректировать терапию в дальнейшем в зависимости от динамики ЛПИ и ЛДФ при проведении диагностики (рис. 4).
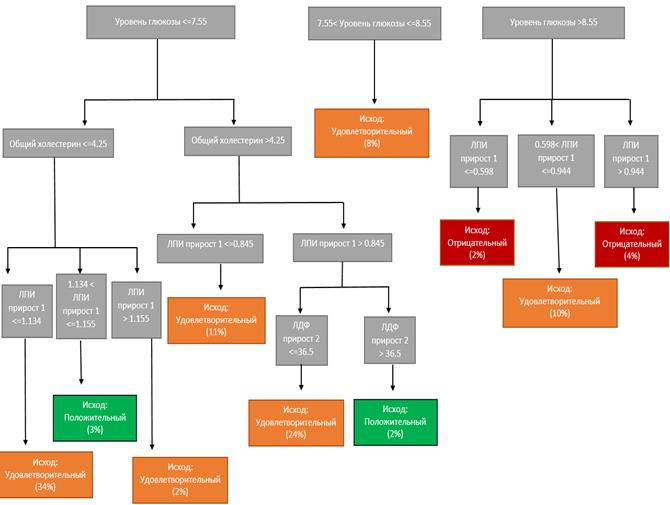
Рис. 4. Алгоритм прогноза и выбора стационарзамещающего лечения пациентов обеих исследуемых групп
Таким образом, нами были получены результаты, свидетельствующие в пользу преимущества стационарзамещающих методов лечения пациентов с ХОЗАНК во влиянии на процессы восстановления перфузии и трофики ишемизированных тканей при заметной динамике показателей микроциркуляторного русла; более низкий риск таких осложнений, как внутрисосудистое тромбообразование, прогрессирование стеноза и окклюзии. Исследованная группа пациентов, у которых применялся индивидуальный подход к выбору тактики лечения, характеризовалась управляемым характером течения атеросклеротических процессов вследствие большего эффекта на состояния дислипидемии, показатели глюкозы в крови, а также воспалительные процессы в целом, проявляющиеся повышенными концентрациями С-реактивного белка и фибриногена, как основных факторов, определяющих скорость и сроки заживления поражений, риска ампутации конечности, а также прогноз и качество жизни больного.
Стационарзамещающая терапия показывает не только хорошие результаты с точки зрения медицины, но и является экономически более выгодным вариантом.
Выводы
1. У больных облитерирующим атеросклерозом с критической ишемией нижних конечностей фармакологическая терапия согласно общепринятым стандартам и рекомендациям приводит к 87% хороших и к 0% удовлетворительных результатов, а у 13% пациентов - к ампутации конечности.
2. Использование иммунотерапии у пациентов с язвенно-некротическими изменениями нижних конечностей приводит к очищению ран и увеличивает скорость заживления ран по сравнению со стандартными методиками.
3. Применение модифицированных комбинированных стационарзамещающих методик лечения пациентов с критической ишемией с тяжелой сопутствующей патологией позволяет у 91% пациентов снизить уровень ампутации и сохранить конечности.
4. Использование медикаментозной терапии в сочетании с нефармакологическими методами позволяет избежать выполнения реконструктивных оперативных вмешательств у пациентов с высокими рисками осложнений в течение 2 лет у 74%, а при использовании стандартных методик - у 63% пациентов.
5. Своевременная индивидуальная комплексная терапии у полиморбидных пациентов с IVа степенью ишемии нижних конечностей экономически обоснована (71 408 рублей) по сравнению с ампутацией и реабилитацией больных (406 912 рублей).
Библиографическая ссылка
Кательницкий Ив.И., Кательницкий Иг.И., Ливадняя Е.С., Божко А.В. СТАЦИОНАРЗАМЕЩАЮЩИЕ ТЕХНОЛОГИИ В ЛЕЧЕНИИ ПАЦИЕНТОВ С ЯЗВЕННО-НЕКРОТИЧЕСКИМИ ИЗМЕНЕНИЯМИ ПРИ КРИТИЧЕСКОЙ ИШЕМИИ НИЖНИХ КОНЕЧНОСТЕЙ // Современные проблемы науки и образования. 2019. № 4. ;URL: https://science-education.ru/ru/article/view?id=29103 (дата обращения: 10.03.2026).



