Современная классификация нейроэпителиальных опухолей Всемирной организации здравоохранения (ВОЗ) определяет три основные группы глиом, а именно астроцитомы, олигодендроглиомы и эпендимомы, и, кроме того, предполагает их четырехуровневую гистопатологическую оценку (grade I – IV). В обновленной классификации ВОЗ опухолей ЦНС (2016) учитывается не только фенотип, но и некоторые генетические характеристики глиом. По литературным данным, несколько основных молекулярных изменений являются типичными для различных типов новообразований головного мозга. К ним относятся мутации в генах IDH1 и IDH2, ассоциированных с диффузно инфильтрирующими глиомами, мутации в генах TP53 и ATRX, характерные для астроцитом, ко-делеция 1p/19q и мутации промотора гена TERT в олигодендроглиомах, а также мутации или слияния BRAF в ограниченных астроцитомах, особенно у детей [1]. Выявление этих и некоторых других генетических аномалий в опухоли является клинически важным и может помочь врачам определить правильную стратегию лечения и предсказать прогноз.
Десятилетия молекулярных исследований глиом позволили выявить ключевые нарушения в экспрессии элементов молекулярных механизмов контроля внутриклеточных процессов, включая следующие: нарушение регуляции сигнальных путей факторов роста посредством активации генов, кодирующих рецепторные тирозинкиназы (receptor tyrosine kinases - RTKs); активация пути фосфатидилинозитол-3-ОН-киназы (phosphoinositide 3-kinases - PI3Ks); и инактивация путей подавления опухолей р53 и ретинобластомы [2]. Обнаружение новых изменений в экспрессии генов и их сопоставление с клиническим исходом формирует новые представления о геномном и эпигеномном ландшафте, биологических подгруппах глиом, что вселяет надежду на разработку эффективных стратегий лечения.
Целью настоящей работы было исследование экспрессии генов EGFR, TGF-B, SMO и HIF1A сигнальных путей, ассоциированных с онкотрансформацией глиальных клеток, в опухолях, генотипированных на наличие мутаций в генах IDH1/2 и ATRX.
Материал и методы исследования. Методом сплошной текущей выборки было отобрано 54 пациента, проходивших лечение в ФГБУ «РНИОИ» Минздрава России в 2017-2019 гг. по поводу глиальной опухоли головного мозга (табл. 1). Исследование было одобрено этическим комитетом ФГБУ «РНИОИ» Минздрава России; в каждом случае было получено добровольное информированное согласие больного на включение его в исследование. Возраст пациентов варьировал от 18 до 79 лет, медиана составила 58 лет. Согласно гистологической верификации в выборку глиальных опухолей вошли глиобластома (GIV), анапластическая астроцитома (GIII), диффузная астроцитома (GII).
В работе использованы операционные биоптаты опухоли (основная точка) и условно здоровой ткани головного мозга (контрольная точка), изъятые в процессе операционного вмешательства. Точки забора материала рассчитывали до операции с использованием навигационной станции Medtronic S7 (Medtronic, Ирландия). Контрольная точка локализовалась на расстоянии 15 мм от границы опухоли вне функционально значимой зоны головного мозга. Для визуализации опухоли пациенты за 2 часа до операции принимали 5-аминолевулиновую кислоту в стандартной дозе. Контрольный биоптат при оценке модулем Blue 400 микроскопа Carl Zeiss OPMI PENTERO (Zeiss AG, Германия) был без активного свечения. Операционный материал замораживали и хранили при -80 °С.
Таблица 1
Клинико-морфологическая характеристика пациентов
|
Характеристика |
Переменные |
Количество (%) |
|
Клиническая классификация (WHO grade) |
глиобластома (GIV) |
29 (54%) |
|
анапластическая астроцитома (GIII) |
6 (11%) |
|
|
диффузная астроцитома (GII) |
19 (35%) |
|
|
Пол |
женщины |
24 (44%) |
|
мужчины |
30 (56%) |
|
|
Возраст, лет |
18-35 |
6 (11%) |
|
36-60 |
29 (54%) |
|
|
>61 |
19 (35%) |
Фрагменты ткани гомогенизировали в TRIzol (Thermo Fisher, США) с помощью MagNA Lyser (Roshe, Швейцария). Нуклеиновые кислоты выделяли согласно инструкции производителя. Дополнительно проводили очистку препаратов ДНК и РНК соответственно с помощью набора ДНК-сорб-B («ИнтерЛабСервис», Россия) и набора miRNAsy mini Kit (Qiagen, Германия).
Полученные образцы суммарной РНК обрабатывали препаратами ДНК-азы 1 (Thermo Fisher, США) для удаления геномной ДНК. Синтез кДНК на РНК-матрице проводили с использованием набора MMLV Reverta («Синтол», Россия). Методом RT-qPCR определяли величины относительной экспрессии 15 генетических локусов: EGFR, SMAD4, SMAD7, SMO, NOTCH1, NOTCH2, HBP1, HIF1A, EGLN1, EGLIN3, KDM1B, KDM1A, MSI1, MSI2, TET1. В качестве референсных локусов использовали гены PSMC, TBP и RPLO. Предварительно для подбора референсных генов оценивали стабильность экспрессии 8 кандидатных локусов с помощью программы geNorm. Дизайн специфичных олигонуклеотидных праймеров осуществляли с использованием референсных последовательностей NCBI GenBank и программы Primer-BLAST [3]. Процедура расчета показателя относительной экспрессии (RCQ) соответствовала описанной ранее [4].
Наличие соматических мутаций в генах IDH1 (R132H, R132C, R132S, R132G, R132L, R132V), IDH2 (R172K, R172M, R172W, R172S, R172G) и ATRX (R1803H, R221K, R221M) определяли с помощью секвенирования по Сенгеру с использованием генетического анализатора AB 3500 (Applied Biosystems, США).
Статистический анализ результатов выполняли с помощью пакета прикладных статистических программ Microsoft Excel 2013 (Microsoft Corporation, США) и Statistica 10 (StatSoft Inc., США). Достоверность отличий определяли, вычисляя непараметрический критерий Манна–Уитни. Нулевую статистическую гипотезу об отсутствии различий отвергали при пороговом уровне p<0,05.
Результаты исследования и их обсуждение. Из 54 пациентов мутантный статус гена IDH1 (R132H) идентифицировали у 10 пациентов (18,5%). Случаев с мутацией в генах IDH2 и ATRX не выявлено.
Сравнительный анализ уровня экспрессии в основной и контрольной точках продемонстрировал увеличение транскрипционной активности в глиальных опухолях головного мозга по десяти из 15 исследованных локусов (EGFR, SMO, NOTCH1, NOTCH2, HIF1A, KDM1B, KDM1A, MSI1, MSI2, TET1). Статистически достоверное увеличение подтверждено для трёх генов SMO, HIF1A и KDM1A соответственно в 1,5 (у 48% пациентов), 1,7 (у 57% пациентов) и 1,3 раза (у 33% пациентов). Для остальных локусов либо не отмечено различий при сравнении экспрессии в опухоли и условной норме (SMAD4), либо идентифицировано смещение транскрипции в сторону снижения уровня транскрипционной активности по сравнению с контрольной точкой. Для локусов SMAD7, EGLN1 и EGLN3 снижение показателя относительной экспрессии было статистически значимо (p<0,05) соответственно в 1,7 раза (у 50% пациентов), 1,25 (у 31% пациентов) и 1,4 (у 45% пациентов).
Для оценки изменения уровня экспрессии в глиальных опухолях между 15 генетическими локусами был проведен корреляционный анализ, результаты которого представлены в таблице 2.
Таблица 2
Значения коэффициента корреляции Спирмена (r), вычисленные для показателей RCQ 15 локусов в исследованной группе глиом
|
|
EGFR |
SMAD4 |
SMO |
HBP1 |
EGLN1 |
EGLN3 |
KDM1B |
KDM1A |
MSI1 |
MSI2 |
|
EGFR |
1,000 |
|
|
|
|
|
|
|
|
|
|
SMAD4 |
0,061 |
1,000 |
|
|
|
|
|
|
|
|
|
SMO |
0,611 |
-0,096 |
1,000 |
|
|
|
|
|
|
|
|
HBP1 |
0,072 |
0,291 |
0,154 |
1,000 |
|
|
|
|
|
|
|
EGLN1 |
-0,078 |
0,507 |
-0,048 |
0,346 |
1,000 |
|
|
|
|
|
|
EGLN3 |
0,095 |
0,221 |
0,052 |
0,521 |
0,593 |
1,000 |
|
|
|
|
|
KDM1B |
0,053 |
0,178 |
-0,019 |
0,281 |
0,322 |
0,443 |
1,000 |
|
|
|
|
KDM1A |
0,416 |
0,420 |
0,414 |
0,227 |
0,158 |
0,230 |
0,144 |
1,000 |
|
|
|
MSI1 |
0,340 |
0,119 |
0,625 |
-0,080 |
0,148 |
-0,046 |
-0,027 |
0,389 |
1,000 |
0,381 |
|
MSI2 |
0,367 |
0,309 |
0,263 |
0,230 |
0,333 |
0,179 |
0,153 |
0,519 |
0,381 |
1,000 |
|
TET1 |
0,038 |
0,451 |
-0,054 |
0,305 |
0,646 |
0,580 |
0,672 |
0,190 |
0,147 |
0,285 |
Примечание: жирным шрифтом выделены значения корреляции (r), статистически значимые для р<0,001.
Продемонстрированы статистически достоверные положительные корреляции изменений относительной экспрессии как для локусов, функционирующих внутри одного сигнального пути - EGLN1, EGLN3, так и для локусов, участвующих в разных сигнальных путях – EGFR, SMO; MSI1, SMO; EGLN1, SMAD4; HBP1, EGLN3; KDM1B, EGLN3; KDM1A, MSI2 (табл. 2). Увеличение относительной экспрессии гена TET1 ассоциировано с возрастанием уровня экспрессии четырёх генетических локусов: SMAD4, EGLN1, EGLN3 и KDM1B.
Значения RCQ были определены в трех группах глиом разного уровня злокачественности (Grade). Уровни транскрипционной активности исследованных генов по группам проиллюстрированы на рисунке 1.
В группе G II в 53% случаев выявлено увеличение в 1,5 раза экспрессии гена KDM1A (p<0,05) (рис. 1). Ранее исследователи отмечали роль сверхэкспрессии KDM1A в активности глиальных стволовых клеток, что позволяет рассматривать в данном случае KDM1A в качестве потенциальной терапевтической мишени [5].
Статистически достоверных отличий относительной экспрессии исследуемых локусов в группе G III не выявлено.
Для группы G IV было характерно снижение относительной экспрессии (p<0,05) трех генов SMAD7, EGLN1 и EGLN3 соответственно в 2,5 раза (62% случаев), 1,4 (31% случаев) и 1,4 (52% случаев) (рис. 1). Кроме того, в глиобластомах было выявлено увеличение в 1,4 раза относительной экспрессии (p<0,05) гена SMO (45% случаев). SMO, как звено в сигнальном пути SHH, активирует транскрипционные Gli-факторы, которые в свою очередь индуцируют экспрессию генов-мишеней. Эктопическая передача сигналов через SHH связана с различными типами опухолей, включая медуллобластому, базальноклеточную карциному, рак молочной железы и рак легких, что делает этот путь и всех его участников привлекательными терапевтическими мишенями [6].
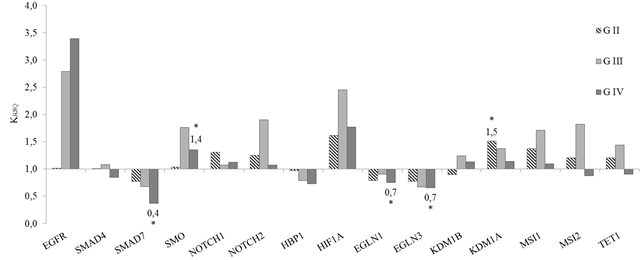
Рис. 1. Изменение относительной экспрессии исследуемых генов в образцах глиом с разной степенью злокачественности
* - p<0,05. KRSQ=RSQопухоль/RSQнорма.
С увеличением степени злокачественности глиом наблюдается увеличение относительной экспрессии гена EGFR, в группе G IV транскрипционная активность EGFR , выявленная для опухоли, превышает в 2,2 раза показатель условной нормы (p=0,093).
Отметим, что аберрантный паттерн экспрессии, очевидно, характерен преимущественно для глиобластом, хотя и не позволяет дискриминировать группу G IV от более дифференцированных глиом.
Изменение экспрессии 15 локусов в опухолях с мутантным статусом гена IDH1 (Mut IDH) и с «диким типом» IDH1 (WT IDH) проиллюстрировано на рисунке 2.
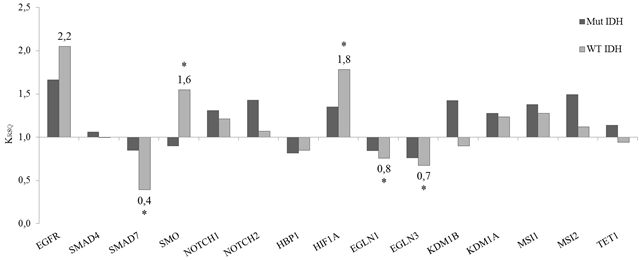
Рис. 2. Уровень относительной генной экспрессии 15 локусов в опухолях с разным статусом гена IDH
* - p<0,05. KRSQ=RSQопухоль/RSQнорма.
Статистически достоверных отличий относительной генной экспрессии в группе опухолей с мутантным статусом гена IDH (Mut IDH) не выявлено. В группе с WT IDH статусом выявлены статистически достоверное (p<0,05) снижение транскрипционной активности трех генов SMAD7, EGLN1 и EGLN3 соответственно в 2,5 раза (52% случаев), в 1,25 (34% случаев) и в 1,4 (42% случаев) (рис. 2). И напротив, повышение уровня RCQ (p<0,05) отмечено для генов HIF1A и SMO соответственно в 1,8 раза (у 64% пациентов) и в 1,6 (у 52% пациентов). В этой же группе у 57% пациентов наблюдается тенденция (p=0,07) к увеличению экспрессии гена EGFR в 2,2 раза. Сравнительный анализ показал достоверную дифференциацию групп с разным статусом гена IDH по относительной экспрессии гена SMAD7 (p=0,012).
Несмотря на высокую степень варьирования показателя относительной экспрессии, продемонстрированная прямая корреляция транскрипционной активности гена EGFR с увеличением степени злокачественности (рис. 1) предполагает успешность таргетной терапии данной молекулярной мишени. Особенно это актуально для группы глиом IDH-WT с более агрессивным течением заболевания и меньшей выживаемостью в отличие от глиом с IDH Mut [7]. Например, в исследовании ClinicalTrials.gov Identifier: NCT02331693, использовали анти-EGFR CAR T-клетки в лечении пациентов с глиомой, сверхэкспрессирующих EGFR, по данным вестерн-блоттинга FISH или ОТ-ПЦР (результаты не опубликованы). Отметим, что в этом исследовании нет критерия включения по поводу наличия мутации в генах IDH.
Снижение экспрессии гена SMAD7 опосредует активацию TGF-b сигнального каскада, что приводит к пролиферации опухолевых клеток, так как нормальная активность SMAD7 заключается в рекрутировании TGFBR1. TGF-b сигнальный каскад в опухолевых клетках оказывает стимулирующие влияние на пролиферацию [8]. Изменение профиля экспрессии SMAD7 требует более пристального изучения сигнального пути TGF-b.
Общей характеристикой для всех групп сравнения было снижение экспрессии генов EGLN1 и EGLN3. Возможный биологический эффект снижения активности пролигидроксилаз, кодируемых этими генами, может реализовываться в конститутивной активации HIF1A. Таким образом, истощение пула альфа-кетоглутарата, который необходим для активности EGLN1 и EGLN3, не является единственной причиной активации HIF1A-сигнального пути [9].
В нашей работе продемонстрирована обратная зависимость степени злокачественности глиомы и экспрессии гена KDM1A (рис. 2), кодирующего лизин-специфичную гистоновую демитилазу. Кроме того, в исследованной группе пациентов выявлена широкая представленность аберрантной экспрессии KDM1A (33%), что особо актуально в связи с разработкой препаратов, регулирующих экспрессию гена KDM1A, уже реализованных в клинические испытания для терапии глиом ранних стадий [10].
Заключение. Выявленное в глиальных опухолях по сравнению с условно нормальной тканью изменение экспрессии генов-участников сразу нескольких сигнальных путей (EGFR, TGF-B, SMO) подчеркивает гетерогенность молекулярных процессов, стимулирующих развитие глиом головного мозга. Достоверные различия экспрессии исследуемых локусов в опухоли были характерны преимущественно для глиобластом G IV. Полученные данные позволили выделить группу молекулярных маркеров (SMAD7, SMO, EGLN1/3, HIF1A, KDM1A), с высокой частотой изменяющих транскрипционную активность в глиальных опухолях и перспективных для использования в таргетной терапии и дифференциальной диагностике.
Библиографическая ссылка
Кит О.И., Пушкин А.А., Росторгуев Э.Е., Тимошкина Н.Н., Кузнецова Н.С., Кавицкий С.Э., Нальгиев А.М. ДИФФЕРЕНЦИАЛЬНАЯ ЭКСПРЕССИЯ 15-ТИ ГЕНОВ В ГЛИАЛЬНЫХ ОПУХОЛЯХ РАЗЛИЧНОЙ СТЕПЕНИ ЗЛОКАЧЕСТВЕННОСТИ // Современные проблемы науки и образования. 2019. № 5. ;URL: https://science-education.ru/ru/article/view?id=29039 (дата обращения: 25.01.2026).
DOI: https://doi.org/10.17513/spno.29039



