В настоящее время сердечно-сосудистые заболевания несут существенную угрозу здоровью современного человека, являясь главным фактором риска в группе «болезней цивилизации». В связи с этим перспективны различные структуры гетерофункциональной γ-гидроксимасляной (4-гидроксибутановой) кислоты (ГОМК), производные которой проявляют коронаротропное, антиангинальное, антинекротическое и кардиопротекторное действие [1]. Такие виды активности характерны и для других соединений, близких по строению [2].
Ранее было установлено, что аддитивные соли 4-гидрокси-3-алкиламино-N-алкилбутанамида, преимущественно 4-гидрокси-3-бензиламино-N-бензилбутанамида, обладают заметной многоплановой фармакологической активностью, в том числе антиаритмическим действием при нарушениях сердечного ритма в условиях ишемии миокарда на животных; кроме того, эти соединения оказались весьма эффективными рострегуляторами растений, обладающими антистрессовым эффектом [3; 4]. Известно, что замещенные амиды проявляют местноанестезирующую активность [5; 6]. Нами осуществлен целенаправленный синтез новых производных замещенной ГОМК, полученных на основе N-алкиламидов 3-(N-алкиламино)-4-гидроксибутановой кислоты ряда I, и последующий скрининг их для установления иных видов биологического действия. В настоящей работе представлены результаты изучения местноанестезирующей активности аддитивных солей (II) и четвертичных аммониевых солей (III) - производных ГОМК. В группе современных фармацевтических веществ-анестетиков известны медицинские препараты с местноанестезирующим действием (новокаин, тримекаин, лидокаин, дикаин), которые являются солями амидов [6].
В структуре модельного 4-гидрокси-3-бензиламино-N-бензилбутанамида Iа, который мы использовали в качестве исходного реагента для синтеза изученных солей, можно отметить фрагмент, близкий по строению анестезиоморфной (фармакофорной) группе:
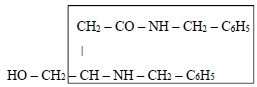
Выделенный структурный элемент присутствует во всех представленных в этой статье соединениях. Нам показалось перспективным сохранить его в молекулах новых соединений, продолжая поиск производных ГОМК, которые могут оказаться приемлемыми для создания новых местных анестетиков.
Целью нашей работы является синтез новых производных замещенной ГОМК, полученных на основе N-алкиламидов 3-(N-алкиламино)-4-гидроксибутановой кислоты (I), и установление у них новых видов биологической активности, востребованных в медицине. Любопытно также сравнение зависимости биологической активности от состава и структуры соединений одного ряда. В данной публикации приведены результаты исследований наиболее активных веществ, проявивших местноанестезирующую активность.
Экспериментальная химическая часть
Все изученные соединения получены, как правило, в солеобразной водорастворимой форме, что облегчает работу с ними в эксперименте и весьма желательно при создании лекарственного препарата. Изучение физиологического действия проводилось в научно-исследовательских лабораториях кафедры фармакологии Кубанского государственного медицинского университета. Основные направления синтеза целевых продуктов представлены на схеме:
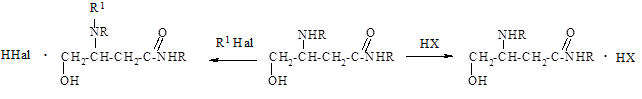
III I II
R=C6H5CH2; С4Н9; С2Н5; С6Н11 R1=C6H5COCH2; HOOCCHCH2CH3
X= кислотные остатки; Hal= Cl, Br
Замещенные бутирамиды ряда I синтезированы по методам, описанным в работах [1; 4]. Действием на группу амидов I минеральными и органическими кислотами получены соли аддитивного (аммонийного) типа II. Проведена оптимизация метода синтеза широкого ряда индивидуальных соединений, установлены их физико-химические константы. Из дикарбоновых кислот в ряде случаев для сравнения активности синтезированы кислые и средние соли. Ниже приведены методики получения соединений, показавших наилучшие результаты при изучении их активности.
Гемисукцинат 3-бензиламино-4-гидрокси-N-бензилбутанамида (IIa) и гемиглутарат 3-бензиламино-4-гидрокси-N-бензилбутанамида (IIб) получены по методу, описанному в работе [1].
Гидрохлорид 3-бензиламино-4-гидрокси-N-бензилбутанамида (IIв). К раствору 2,98 г 3-бензиламино-4-гидрокси-N-бензилбутанамида в 40 см3 этанола прибавляют 0,92 см3 34%-ной соляной кислоты. После упаривания в вакууме и промывания на фильтре серным эфиром выделено 3,1 г (90%) соединения IIв с Tпл=189-190 °С.
Найдено, % С 62,8; Н 7,4; N 8,2; Сl 10,5. С18Н23N2O2Cl • 0,5 Н2О.
Вычислено, % % С 62,9; Н 7,3; N 8,2; Сl 10,3.
ИК-спектр, см-1: 3270, 3240, 3180, 1640,1605, 1570.
Бензоат 3-бензиламино-4-гидрокси-N-бензилбутанамида (IIг) получен также с выходом 92%, Т пл = 119-120 °С.
Соли алкиламидов 3-диалкиламино-4-гидроксибутановой кислоты III синтезированы алкилированием амидов I.
Гидробромид 4-окси-3-[N-(фенацил)бензиламино]-N-бензилбутанамида (IIIа). В 50 см3 смеси этилацетат – хлороформ (2:1) нагревают до кипения 2,37 г бромистого фенацила с 3,54 г 3-бензиламино-4-гидрокси-N-бензилбутанамида. Выпавший через сутки осадок соединения IIIа (3.37 г, 57%) промывают на фильтре серным эфиром. Т. пл. 82-84 °С.
Найдено, %: С 63,5; Н 5,0; N 5,5; Br 16,0. C26 H24 BrN2O3.
Вычислено, %: С 63,4; Н 4,9; N 5,7; Br 16,3.
ИК-спектр, см-1: 3240, 3100, 1635, 1620, 1590, 1530.
Экспериментальная биологическая часть
Испытание соединений проводили по общепринятым стандартным методикам [6; 7].
Результаты наблюдений за действием наиболее выделившихся по активности веществ показаны в таблицах 1-3. Данные, представленные в сравнении с веществами – эталонами по действию, подтверждают, что исследуемые соединения в ряде случаев оказались более эффективными, чем образцы сравнения. Анализ расхождений найденных величин показал, что имеется экспериментальный разброс данных, который нами представлен как (х ± S1). Эталоны по действию и их МНН: дикаин (тетракаин) - гидрохлорид β-диметиламиноэтилового эфира п-бутиламинобензойной кислоты; лидокаин - (2-диэтиламино)-N-(2,6-диметилфенил)-ацетамид; новокаин - гидрохлорид диэтиламиноэтилового эфира п-аминобензойной кислоты; тримекаин - гидрохлорид α-диэтиламино-2,4,6-триметилацетанилида.
Поверхностную (терминальную) анестезию изучали в опытах на роговице глаза кролика с использованием метода Ренье. Инфильтрационную анестезию соединений IIа, IIб исследовали в опытах на крысах и морских свинках с использованием интрадермального метода. Растворы анестезирующих веществ готовили на 0,7%-ном растворе хлорида натрия.
Результаты исследований подвергали статистической обработке. Определяли средние эффективные концентрации (ЕК50), применяя метод наименьших квадратов, коэффициенты относительной активности и терапевтические индексы (ЛД50/ЕК50).
Результаты исследований и их обсуждение
Исследованиями солей группы (II) показано что часть веществ этой группы обладает заметным местноанестезирующим действием, которое в значительной степени определяется составом противоиона (кислотного остатка). Установлено также, что средние соли двухосновных кислот (гемисукцинаты, гемималаты, гемиглутараты) оказались физиологически значительно активнее, чем кислые.
Полученные данные изучения поверхностной (терминальной) анестезии представлены в таблице 1. Соединение IIг при концентрации раствора свыше 1% дает неустойчивые растворы, образующие осадки, поэтому изучено ограниченно. Для раствора соединения IIг с концентрацией 1% индекс Ренье установлен 268,2 ± 27,7. Следует отметить, что соли IIв, IIг, взятые в 1-5% растворах, как и дикаин, начиная с 2%-ной концентрации, вызывают гиперемию конъюнктивы и десквамацию эпителия роговицы. Установлено, что соединения гемисукцинат 3-бензиламино-4-гидрокси-N-бензилбутанамида IIа и гемиглутарат 3-бензиламино-4-гидрокси-N-бензилбутанамида IIб оказывают заметное местноанестезирующее действие. Позитивным фактом является то, что изученные растворы соединений IIа, IIб не оказывают раздражающего действия на конъюнктиву глаза.
Таблица 1
Активность соединений IIа-IIв и IIIа в сравнении с тримекаином, лидокаином и дикаином, использованных в 5%-ной концентрации, при поверхностной анестезии в опытах на роговице глаза кролика (капли, внесенные в конъюнктивальный мешок) (x ± S1, n = 6)
|
Соединение |
Количество капель |
Индекс Ренье |
|
IIа |
1 2 |
562,5±53,0 337,0±25,4 |
|
IIб |
1 2 |
160±11,8 552,7±31,8 |
|
IIв |
1 2 |
406±61,9 787,5±28,3 |
|
1 2 |
225,7±25,4 762,8±24,4 |
|
|
Тримекаин |
1 2 |
255,0±61,9 1300,0±0,0 |
|
Лидокаин |
1 |
443,5±40,1
|
|
Дикаин |
1 |
300,0±0,0
|
Инфильтрационную анестезию соединений IIа, IIб, как более активных, исследовали в опытах на крысах и морских свинках с использованием интрадермального метода. Результаты опытов приведены в таблице 2. Оба исследованных вещества по местноанестезирующей активности и широте терапевтического эффекта превосходят тримекаин.
Спинномозговую анестезию изучали в опытах на крысах. В качестве препаратов сравнения были взяты новокаин и тримекаин (таблица 3). Результаты исследования показали, что эти соединения вызывают у крыс четкую спинномозговую анестезию. Наиболее активным оказался гемиглутарат IIб, который в 4,36 раза по действию превосходит тримекаин и в 5,89 раза – новокаин (2%-ный раствор). Увеличение дозы соединения IIб до 15 мг/кг при введении его в спинномозговой канал приводит к еще более длительной анестезии, однако при этом у животных отмечалось угнетение дыхания.
Токсичность соединений IIа-IIг для белых мышей при однократном введении внутрибрюшинно составляла соответственно 154, 129, 112 и 120 мг/кг, токсичность бромида IIIа – 290 мг/кг (для новокаина и тримекаина соответственно 206 и 182 мг/кг).
Из группы четвертичных аммониевых солей ряда III наибольшую активность в эксперименте показал гидробромид 4-окси-3-[N-(фенацил)бензиламино]-N-бензилбутан-амида IIIа. Более эффективным было его действие в условиях инфильтрационной и спинномозговой анестезии. Изученное соединение по местноанестезирующей активности и широте терапевтического эффекта соответственно в 2,59 и 2,21 раза превосходит тримекаин (таблица 2). При спинномозговом методе обезболивания в опытах на крысах установлено, что гидробромид IIIа (10 мг/кг) в 2%- и 5%-ных растворах по длительности анестезии превосходит тримекаин и новокаин (таблица 3).
Выводы
Нами предложены простые методы получения групп соединений замещенной γ-оксимасляной кислоты – функционализированных производных N-алкиламидов 3-(N-алкиламино)-4-гидроксибутановой кислоты, выделенных в виде аддитивных и четвертичных аммониевых солей, среди которых найдены активные вещества с местноанестезирующей активностью.
Из изученных аддитивных солей N-алкиламидов 3-(N-алкиламино)-4-гидрокси-бутановой кислоты наиболее эффективны гемисукцинат и гемиглутарат бензиламида 3-бензиламино-4-гидроксибутановой кислоты, которые проявили действие, превосходящее известные анестетики. Результаты исследования свидетельствуют о целесообразности их более глубокого изучения с целью возможного создания на их основе новых местноанестезирующих препаратов, в том числе проявляющих комплексное действие.
У солей алкиламидов 3-диалкиламино-4-гидроксибутановой кислоты ряда III, в частности гидробромида 4-окси-3-[N-(фенацил)бензиламино]-N-бензилбутанамида, более выражена местноанестезирующая активность, что объясняется, по-видимому, меньшей проницаемостью этих соединений через гематоэнцефалический барьер и более высокой липофильностью за счет фармакофорного заместителя. Преимуществом всех изученных соединений является отсутствие раздражающего действия на конъюнктиву глаза при терминальном методе обезболивания. Существенно то, что синтез изученных веществ достаточно прост, полученные соединения устойчивы при хранении, обладают относительно низкой токсичностью и хорошей растворимостью в воде. Проведенные исследования показали, что объекты исследования являются перспективными для создания новых местных анестетиков на основе 4-гидроксибутанамидов. Целесообразно также расширить круг соединений.
Таблица 2
Сравнительная местноанестезирующая активность соединений IIа, IIб, IIIа и тримекаина при инфильтрационной анестезии в опытах на морских свинках и крысах (x ± S1, n = 6)
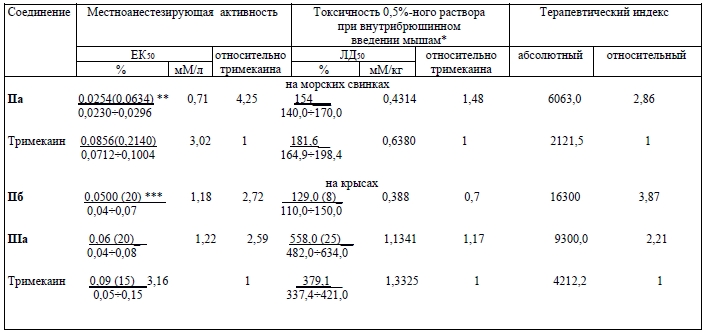
*Для крыс определена токсичность 0,5%-ного раствора при подкожном введении.
**Над чертой (в скобках) - ЕК50, мг; под чертой – доверительные границы при р=0,05.
***Над чертой (в скобках) – количество животных, под чертой – доверительные границы при р=0,05.
Таблица 3
Сравнительная активность соединений IIа, IIб, IIIа, новокаина и тримекаина при спинномозговой анестезии в опытах на крысах (х ± s1)
|
Соединение |
Концент- рация раствора, % |
Доза, мг/кг |
Количество животных* |
Продолжи- тельность анестезии, мин. |
Количество животных, у которых анестезия не наступила, % |
Количество погибших животных, %** |
|
IIа |
2 |
10 |
10 (7) |
42,60±6,05 |
20,0 |
10,0 |
|
IIб |
2 |
10 |
10 (8) |
71,90 ±6,63 |
10,0 |
10,0 |
|
IIIа |
2 |
10 |
10(9) |
46,9±2,98 |
- |
10,0 |
|
Новокаин |
2 |
10 |
8 (4) |
12,20±2,80 |
12,5 |
37,5 |
|
Тримекаин |
2 |
10 |
10 (8) |
16,50±1,33 |
10,0 |
10,0 |
|
IIа |
5 |
10 |
11 (8) |
51,70±5,70 |
- |
27,3 |
|
IIб |
5 |
10 |
10 (8) |
102,50±7,29 |
- |
20,0 |
|
IIIа |
5 |
10 |
10(8) |
79,1±7,56 |
- |
20,0 |
|
Новокаин |
5 |
10 |
10 (6) |
23,60±2,12 |
20,0 |
20,0 |
|
Тримекаин |
5 |
10 |
7 (5) |
33,80±3,00 |
- |
28,6 |
*В скобках – количество животных, которое принималось в расчет.
**Причина гибели животных не установлена.
Библиографическая ссылка
Тюхтенева З.И., Бурлака С.Д. СИНТЕЗ ЗАМЕЩЕННЫХ БУТИРАМИДОВ И ИССЛЕДОВАНИЕ ИХ МЕСТНОАНЕСТЕЗИРУЩЕЙ АКТИВНОСТИ // Современные проблемы науки и образования. 2019. № 4. ;URL: https://science-education.ru/ru/article/view?id=28996 (дата обращения: 10.03.2026).



