Рак шейки матки является четвертой ведущей причиной смертности от рака среди женщин во всем мире. Каждый год в мире выявляют 530 000 новых случаев рака шейки матки, что составляет около 9% новых случаев злокачественных заболеваний, диагностируемых у женщин ежегодно. Общая пятилетняя выживаемость составляет 68%. Тем не менее пятилетняя выживаемость у пациентов с отдаленными метастазами составляет лишь 16% [1]. Около 90% рака шейки матки - плоскоклеточный рак, 5-10% - аденокарцинома, а остальные – редкие гистологические типы. Отмечены разные тенденции роста опухоли, характерные для различных возрастных групп: у более молодых женщин чаще встречаются опухоли с экзофитной схемой роста (наружу), у пожилых пациенток рак шейки матки чаще распространяется внутри шейного канала (эндофитная схема роста) [2].
Вариация числа копий (copy number variation - CNV) является основной категорией генетической изменчивости человека. Для множества генов в нашем геноме изменение дозировки генов путем дупликации или делеции вызывает фенотипический эффект. Большинство CNV представляют собой нормальные изменения и являются функционально доброкачественными, в то время как другие, чувствительные к дозировке гены, могут давать преимущество, как правило, связанное с заболеванием, включая рак. Точное обнаружение CNVs важно как для биомедицины, так и для клинической диагностики [3; 4].
Целью нашей работы стало изучение изменения относительной копийности генов, ответственных за рецепцию и метаболизм эстрогенов в тканях шейки матки при эндофитной и экзофитной формах роста опухоли для поиска предиктивных маркеров малигнизации.
Материал и методы исследования
В исследование вошли 40 пациенток в возрасте 28-65 лет с диагнозом рак шейки матки с эндофитной (n=20) и экзофитной (n=20) формами роста, проходивших плановое лечение в ФГБУ «РНИОИ» Минздрава России. Критерием отбора больных являлся морфологически подтвержденный диагноз плоскоклеточного рака шейки матки T1б-2аN0M0, стадия I-II. Все пациентки подписали информированное согласие на обработку персональных данных и передачу биологического материала и сведений, составляющих врачебную тайну.
Экстракцию ДНК из FFPE-блоков опухолевой и условно здоровой ткани проводили набором Thermo Scientific Gene JET Ffpe DNA Purification Kit согласно инструкции изготовителя. Концентрацию полученных препаратов ДНК измеряли на флюориметре Qubit 2.0® (Invitrogen, США) с использованием набора Quant-iT™ dsDNA High-Sensitivity (HS) AssayKit (Invitrogen, США).
Методом RT-qPCR проводили оценку относительной копийности 8 генетических локусов: ESR1, ESR2, GPER1, STS, SULT1A1, SULT1E1, CYP1A1, CYP1A2. Каждые 25 мкл ПЦР-смеси содержали 10 нг геномной ДНК, 0,2mM dNTP’s, по 600 нМ прямого и обратного праймеров, 2,5 mM MgCl2, ПЦР-буфер, 0,05 u/µl ДНК-полимеразы Thermus aquaticus («Синтол», Россия). В качестве красителя использовали EvaGreen (Biotium, США). Амплификацию каждой из проб осуществляли в трех повторностях с использованием термоциклера CFX96 (Bio-Rad, США) по следующей программе: 95 °C 3 мин., и 40 циклов при 95 °C 10 с, 58 °C 30 с (чтение оптического сигнала FAM для красителя EvaGreen) и 72 °C 15 с. Первичные данные RT-qPCR анализировали с помощью программного обеспечения Bio-Rad CFX Manager (ver. 2.1) [5-7].
В качестве референсных использовали генетические локусы GAPDH, B2M. Прямые и обратные праймеры для всех генетических локусов были разработаны нами с использованием базы NCBI GenBank, их последовательности представлены в таблице 1 [8].
Таблица 1
Панель праймеров для определения копийности генов
|
№ |
Ген |
Последовательность прямого праймера |
Последовательность обратного праймера |
|
1 |
GAPDH |
GCTGAACGGGAAGCTCACT |
GCAGGTTTTTCTAGACGGCAG |
|
2 |
B2M |
TGCTGTCTCCATGTTTGAATCT |
TCTCTGCTCCCCACCAAGT |
|
3 |
ESR1 |
CTGGAGACATGAGAGCTGCC |
GCATCCAACAAGGCACTGAC |
|
4 |
ESR2 |
GGCAAGGCCAAGAGAAGTGG |
CTCCAGGAGGGTGAGCACTA |
|
5 |
GPER1 |
CTCTTCCCCATCGGCTTTGT |
CGGGGATGGTCATCTTCTCG |
|
6 |
STS |
CCACCCTTTACATCACGGCT |
GTGAAGACACTGCCCTCTCC |
|
7 |
SULT1A1 |
GGACTTCGTGGTTCAGCACA |
CCTCATGAAGGGGGAGATGC |
|
8 |
SULT1E1 |
GAGGAGCTTGTGGACAGGATT |
CCTTTCTCATGAAGGGCGACA |
|
9 |
CYP1A1 |
CAACTGCTATCTCCTGGAGCC |
GCTCCTCTTGGATCTTTCTCTGTA |
|
10 |
CYP1A2 |
CACTGTGATTGGCAGGGAGC |
GGTGAAGGGCAAGAAGGAGG |
Относительную копийность генетического локуса (RСQ) рассчитывали по формуле 2-ΔCt. Дозу исследованного локуса считали равной диплоидному набору (2n), если отношение RCQопухоль/норма ~1. Если отношение RCQопухоль/норма было> 1,5 или < 0,5, дозу локуса считали увеличенной (>3n) или уменьшенной (<1n) соответственно [5]. Оценку достоверности различий проводили с использованием критерия Манна-Уитни в программе Statistica v.10.
Результаты исследования и их обсуждение
Для всех проанализированных генетических локусов было отмечено изменение дозы генов в опухолевых клетках шейки матки относительно нормальных: ESR1, ESR2, GPER1, STS, SULT1A1, SULT1E1, CYP1A1, CYP1A2 соответственно в 17,5, 20, 32,5, 27,5, 35, 20, 42,5 и 27,5% случаев. Преобладала тенденция увеличения копийности (рисунок 1). Статистически достоверное изменение копийности (р<0,05) выявлено для трех генетических локусов - GPER1, SULT1A1, CYP1A1.
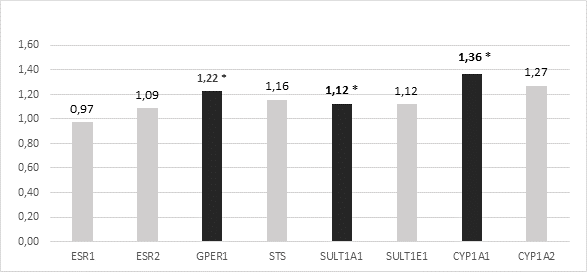
Рис. 1. Копийность генов в опухолевых тканях у пациентов с раком шейки матки относительно условно здоровых тканей. * - отмечены статистически достоверные различия от условно нормальной ткани (р<0,05)
Значения отношения относительной копийности генов (RCQопухоль/норма) в группах с экзофитной и эндофитной формами роста опухоли представлены на рисунке 2.
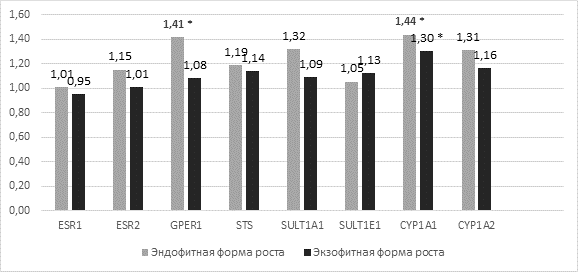
Рис. 2. Уровень RCQопухоль/норма в группах с экзофитной и эндофитной формами роста опухоли у пациентов с раком шейки матки. * - отмечены статистически достоверные различия от условно нормальной ткани (р<0,05)
После разделения общей выборки пациенток на две группы не изменилась общая тенденция увеличения копийности в ряду исследованных локусов (рисунок 2). Однако в отличие от общей выборки увеличение дозы гена SULT1A1 не достигает статистически достоверного уровня ни в одной группе (p=0,242 и p=0,157), а копийность локуса GPER1 значимо повышается только в группе эндофитной формы роста (р=0,040). Кроме того, для группы с эндофитной формой роста было выявлено увеличение дозы гена CYP1A2 (р=0,253). В целом при сравнении двух групп по уровню копийности исследованных локусов различий не выявлено.
Тем не менее анализ групп пациенток разных возрастов позволил идентифицировать различия. Отметим, что распределение пациенток по возрастам соответствовало нормальному (таблица 2) с преобладанием женщин в возрасте 36-55 лет.
Таблица 2
Возрастной состав пациенток с различными формами роста рака шейки матки
|
Возрастные интервалы |
20-35 лет (%) |
36-55 лет (%) |
56-75 лет (%) |
|
Экзофитная форма (n=20) |
6 (30%) |
11 (55%) |
3 (15%) |
|
Эндофитная форма (n=20) |
4 (20%) |
12 (60%) |
4 (20%) |
Данные по относительной копийности генов в разных возрастных группах при различных формах роста опухоли представлены в таблице 3.
Таблица 3
Изменение дозы генов в возрастных группах пациенток с раком шейки матки
|
Эндофитная форма роста |
Экзофитная форма роста |
|||||
|
Ген |
20-35 лет |
36-55 лет |
56-75 лет |
20-35 лет |
36-55 лет |
56-75 лет |
|
ESR1 |
0,94 |
1,05 |
1,08 |
0,91 |
1,01 |
0,91 |
|
ESR2 |
1,11 |
1,07 |
2,20 |
0,97 |
1,07 |
0,81 |
|
GPER1 |
1,13 |
1,35* |
3,10 |
1,35 |
1,08 |
0,78 |
|
STS |
1,09 |
1,30 |
1,29 |
1,14 |
1,21 |
0,79 |
|
SULT1A1 |
0,98 |
1,18 |
2,82 |
1,03 |
1,32 |
0,95 |
|
SULT1E1 |
1,09 |
1,14 |
0,86 |
1,30 |
1,13 |
1,12 |
|
CYP1A1 |
1,18* |
1,52* |
1,00 |
1,26* |
1,41* |
0,91 |
|
CYP1A2 |
1,22 |
1,41 |
1,22 |
1,18 |
1,28 |
1,06 |
Примечание: * - статистически значимое отличие от условно нормальной ткани (р<0,05).
В группе пациенток 36-55 лет с эндофитной формой роста опухоли отмечено достоверное увеличение (р<0,05) копийности генов GPER1 и CYP1A1 с частотой 41,7% и 66,7% соответственно. Также в этой возрастной группе отмечалось увеличение амплификации гена CYP1A2 у 41,67% пациенток. В возрастной группе 56-75 лет с эндофитной формой роста опухоли наблюдалось увеличение копий генов ESR2, GPER1, SULT1A1 с частотой 50, 100 и 75% соответственно. В группе 20-35 лет с эндофитной формой роста опухоли изменения дозы генов не отмечено.
У пациенток с экзофитной формой роста опухоли в возрастной группе 20-35 и 36-55 лет выявлено достоверное увеличение (р<0,05) копийности гена CYP1A1 в 33,33% и 45,45% случаев соответственно. По остальным генетическим локусам в разных возрастных группах изменения копийности не наблюдалось.
Данные литературы подтверждают вовлеченность исследуемых генов в процессы онкотрансформации, которые связаны с функциями кодируемых белков.
Ген GPER1 кодирует мембранный белок, который локализуется в эндоплазматической сети и является членом семейства рецепторов 1, ассоциированных с G-белком. Этот рецептор связывает эстроген и активирует многие нижестоящие сигнальные пути, что приводит к стимуляции аденилатциклазы и увеличению уровней циклического АМФ, а также способствует внутриклеточной мобилизации кальция и синтезу фосфатидилинозитол 3,4,5-трисфосфата в ядре. Следовательно, посредством этого белка реализуются клеточные и физиологические реакции на действие эстрогенов. Активация GPER1 запускает множественные внутриклеточные каскады, связанные с пролиферацией, инвазией и миграцией. Локус GPER1 в нашем исследовании продемонстрировал значимый уровень амплификации в эндофитной группе, что может обеспечивать механизм увеличения уровня рецептора GPER1, который широко экспрессируется во многих тканях по всему организму и часто высоко экспрессируется в линиях раковых клеток, особенно из агрессивных опухолей, и было показано, что он является важным прогностическим фактором при раке молочной железы, эндометрия, яичников. Высокая экспрессия GPER1 в этих эстроген-ассоциированных опухолях была связана с метастазами и плохой выживаемостью [9].
Для гена SULT1A1, кодирующего одну из двух фенолсульфотрансфераз с активностью термостабильного фермента, нами была установлена тенденция к увеличению копийности в образцах рака шейки матки. Ферменты сульфотрансферазы (SULT1A1) катализируют сульфатную конъюгацию и участвуют в различных патофизиологических процессах, таких как метаболизм лекарств, рак, гормональная регуляция и биология нейротрансмиттеров. Цитозольная сульфотрансфераза 1A1 (SULT1A1) человека считается одной из наиболее важных изоформ SULT для метаболизма и детоксикации канцерогенов, стероидных гормонов (например, эстрогенов) и других распространенных лекарственных средств (например, тамоксифен). SULT1A1 широко выражено в множественных тканях и действует на широком диапазоне фенольных субстратов [10]. Описана роль генетического полиморфизма гена SULT1A1, связанного с повышенным риском рака легких, рака молочной железы, эндометрия и яичников, предстательной железы, мочевого пузыря и колоректального рака [11].
Наиболее часто в исследованной выборке изменялась степень амплификации гена CYP1A1, кодирующего фермент из суперсемейства цитохромов P450. Цитохромы P450 - это ферменты, которые отвечают за детоксикацию широкого спектра ксенобиотиков, включая лекарственные средства, загрязнители окружающей среды и канцерогенов, участвуют в биосинтезе холестерина, стероидов и других липидов. Подсемейство CYP1A (CYP1A1 и CYP1A2) играет важную роль в метаболизме двух важных классов канцерогенов окружающей среды: полициклических ароматических углеводородов и акриламинов. Известно, что курение сигарет индуцирует CYP1A1 и CYP1A2; высокий уровень этих ферментов CYP связан с повышенным риском рака легких и толстой кишки [12]. CYP1A1 также участвует в метаболизме эстрогена. Следовательно, активность CYP1A1 может влиять на канцерогенез шейки матки по крайней мере двумя различными путями: посредством метаболизма ксенобиотиков, в том числе табачного дыма, и эстрогенов эндогенного происхождения [13]. CYP1A1 экспрессируется в опухолях молочной железы и играет роль в пролиферации, выживании и сигнальной трансдукции клеток рака молочной железы. Пути PI3K / AKT и MEK / ERK являются критическими для прогрессирования рака молочной железы. Сайленсинг CYP1A1 нарушает пролиферацию и выживание, в частности посредством активации фосфорилирования AMPK и снижения передачи сигналов AKT, ERK и P70S6K [14]. Это означает, что CYP1A1 не только участвует в метаболизме ксенобиотиков, но и играет важную роль в прогрессировании рака. В нашем исследовании амплификация гена CYP1A1 с предполагаемым увеличением уровня фермента была показана у более молодых пациенток до 56 лет безотносительно принадлежности к группе по характеру роста опухоли.
Выводы
Получены статистически достоверные (р<0,05) результаты по изменению копийности генов GPER1, SULT1A1, CYP1A1 в опухолевой ткани по сравнению с условно нормальной тканью в обеих группах пациенток с раком шейки матки. У пациенток в группе 20-55 лет с экзофитной формой роста опухоли и в группе 36-55 лет с эндофитной формой роста опухоли отмечено достоверное увеличение (р<0,05) копийности гена CYP1A1.
Таким образом, на основании полученных нами результатов можно предложить использование генов GPER1, SULT1A1, CYP1A1 в качестве биомаркеров малигнизации тканей шейки матки.
Библиографическая ссылка
Петрусенко Н.А., Никитина В.П., Спиридонова Д.А., Кечерюкова М.М. ИЗМЕНЕНИЕ КОПИЙНОСТИ ГЕНОВ В ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЯХ ШЕЙКИ МАТКИ С ЭНДОФИТНОЙ И ЭКЗОФИТНОЙ ФОРМАМИ РОСТА // Современные проблемы науки и образования. 2019. № 3. ;URL: https://science-education.ru/ru/article/view?id=28981 (дата обращения: 04.02.2026).
DOI: https://doi.org/10.17513/spno.28981



