Тревога является врожденной способностью живого организма связывать новые раздражители с возникновением вероятной угрозы [1]. Благодаря чему реализуется естественный адаптационный механизм, направленный на предупреждение столкновения организма с факторами, являющимися источниками потенциальной опасности и способными нарушить гомеостаз. Субъективно состояние тревоги обычно характеризуется как ощущение чрезмерного дискомфортного беспокойства [2], которое сигнализирует о возможных угрожающих изменениях как во внешнем мире, так и в самом организме [3]. Физиологическая тревога является необходимым механизмом для адаптации, а патологическая тревожность снижает адаптационные возможности организма, в том числе приводя к развитию психосоматической патологии [4]. Поведенческим индикатором, говорящим об увеличении уровня тревожности в рамках экспериментов на моделях тревоги у животных, в частности с использованием грызунов – крыс и мышей, является сокращение времени пребывания в светлом отсеке установки в тесте «темно-светлая камера». Это время увеличивается под действием веществ, обладающих анксиолитической активностью [5].
Патологическая тревога в комплексе с другими аффективными расстройствами является одним из немоторных симптомов, сопутствующих болезни Паркинсона [6]. Болезнь Паркинсона – широко распространенное нейродегенеративное заболевание, в основе которого лежит прогрессирующая гибель дофаминергических нейронов компактной части черной субстанции, приводящая к истощению продукции дофамина [7; 8] и нарушению дофаминергической иннервации базальных ядер головного мозга [9]. Тревога и паркинсонизм в своей основе имеют ряд общих патогенетических звеньев: нарушение работы митохондрий вследствие подавления работы митохондриального комплекса I, образование свободных радикалов и возникновение окислительного стресса. Это играет роль не только в гибели дофаминергических нейронов черной субстанции [10], усиливая их апоптоз, но также вносит существенный вклад в развитие патологической тревоги [11].
Поскольку развитие сопутствующей тревоги способно ухудшить качество жизни пациентов, то поиск новых методов её коррекции, особенно немедикаментозных, является актуальной задачей. Возможным методом немедикаментозной коррекции патологической тревожности может стать транскраниальная электростимуляция (ТЭС) головного мозга, разработанная В.П. Лебедевым [12]. Данный метод используется для лечения широкого круга различных заболеваний, так как вызывает ряд эффектов – нейропротекторный, нейротрофический, противовоспалительный, антиоксидантный и другие, благодаря активации опиоидэргической системы [13].
Цель работы – изучить влияние ТЭС-терапии на динамику времени, проведенного крысами с моделью патологической тревожности в светлом отсеке установки «темно-светлая камера».
Материалы и методы исследования
Исследование было выполнено на 145 белых беспородных крысах-самцах в массой 170±25 г. Период адаптации животных перед проведением эксперимента составлял 7 дней, после чего была образована контрольная группа, состоящая из 40 интактных крыс. У остальных животных моделировали ротеноновый паркинсонизм. В процессе формирования ротеноновой модели паркинсонизма погибало 25% животных, что предусматривается данной методикой.
Выжившие крысы были разделены случайным образом на две группы по 40 животных: крысы с экспериментальной моделью паркинсонизма без лечения (группа сравнения) и крысы с экспериментальной моделью паркинсонизма, которым проводили 7 сеансов ТЭС-терапии (основная группа). Все эксперименты выполняли в соответствии с требованиями приказа МЗ РФ от 01.04.2016 года № 199 и международными правилами «Guide for the Care and Use of Laboratory Animals».
Выбор токсической модели паркинсонизма с использованием ротенона обусловлен тем, что она отличается рядом преимуществ, прежде всего возможностью системного введения и точного воспроизведения патогенетических механизмов болезни Паркинсона, включая аффективные нарушения [14]. Приготовление субстанции для инъекции осуществляли путем растворения порошка ротенона в диметилсульфоксиде в пропорции 1:1, и добавлением к нему 4 частей растительного (персикового) масла. Инъекции выполняли один раз в день по схеме 2,5 мг/кг/сут в течение 28 дней подкожно всем крысам [15], кроме интактных.
Крысам из основной группы в течение 7 дней после завершения курса введения ротенона (с 4-й по 5-ю неделю эксперимента) проводили ТЭС-терапию с помощью модифицированного двухпрограммного электростимулятора «ТРАНСАИР-03» в анальгетическом режиме со следующими параметрами электрического тока: частотой 70±2 Гц, длительностью импульса – 3,75±0,25 мс, силой тока – 2,0-2,6 мА. Использовали одноразовые подкожные электроды из нержавеющей стали, которые располагали фронто-мастоидально: катод – в области лба, над глазницами, и анод – позади ушных раковин, согласно схеме, представленной на рисунке 1.
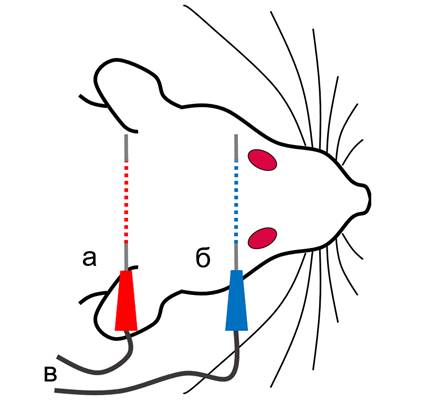
Рис. 1. Схема расположения стимулирующих элетродов при проведении сеансов ТЭС-терапии: а – анод, б – катод, в – провода, соединяющие электроды с электростимулятором «ТРАНСАИР-03» (пунктиром обозначены участки электродов, расположенные под кожей)
Сеансы стимуляции проводили 1 раз в сутки, продолжительность первого сеанса составляла 15 минут – для мягкой адаптации животных к данной процедуре. Продолжительность всех последующих сеансов ТЭС-терапии составляла 30 минут.
Для оценки поведения крыс в условиях конфликта между мотивацией исследовать новое окружение и врожденной склонностью избегать анксиогенную среду (ярко освещенное пространство) использовали тест «темно-светлая камера» [5]. Установка для проведения теста «Темно-светлая камера» (рисунок 2) представляла собой емкость 60x30x30 см, разделенную поперечной перегородкой на 2 равных по площади отсека 30x30x30 см. В перегородке у дна установки имелось отверстие шириной 7 см, через которое животные могли свободно переходить между отсеками.

Рис. 2. Конструкция использованной в эксперименте установки «темно-светлая камера»:
а – светлый отсек, б – темный отсек, в – крышка темного отсека, г – перегородка с отверстием для перехода между отсеками
Стенки одного отсека были белого цвета – «светлый отсек», стенки другого имели черный цвет – «темный отсек». Темный отсек установки закрывался сверху крышкой, в то время как светлый отсек оставался открытым и был ярко освещен для создания анксиогенной среды. Время тестирования каждого животного составляло 5 минут (300 секунд). Каждую крысу помещали в светлую половину установки и выполняли видеофиксацию её поведения в течение обозначенного диапазона времени. В момент нахождения животного в темно-светлой камере в помещении, в котором проводился эксперимент, исключалось присутствие других животных или людей. После каждого животного выполнялась очистка стенок отсеков для ликвидации запаха, чтобы исключить его влияние на поведение животных в установке.
Оценивали такой параметр, как процент времени, проведенного в светлом отсеке установки «темно-светлая камера». Сокращение времени, проведенного в светлом отсеке, оценивалось, как увеличение уровня тревожности; увеличение времени, проведенного в светлом отсеке, наоборот, – как признак возможного анксиолитического эффекта [5]. Поскольку в данной работе выполняется анализ поведенческих стратегий у животных, более точным понятием для описания и интерпретации наблюдаемых результатов является выраженность тревогоподобного (anxiety-like) поведения [3].
Статистическую обработку результатов проводили с помощью программного обеспечения MS Excel 2013 (Microsoft Inc., США) и программного пакета для выполнения статистического анализа и визуализации данных Statistica 12 (StatSoft Inc., США). Гипотезу о типе распределения проверяли посредством критерия Шапиро-Уилка. Поскольку распределение полученных значений отличалось от нормального, для их дальнейшей обработки использовали методы непараметрической статистики. Данные представляли в виде медианы, нижнего (25%) и верхнего (75%) квартилей (Me(Q1-Q3)). Для парного сравнения показателей двух независимых групп использовали непараметрический U-критерий Манна-Уитни (MW-test). Различия между группами считали статистически значимыми при p<0,05.
Результаты исследования и их обсуждение
После формирования ротенон-индуцированного паркинсонизма крысы демонстрировали характерные для использованной модели данного заболевания нарушения двигательного характера (брадикинезию, постуральную нестабильность, мышечную ригидность и др.), вызванные повреждением и гибелью дофаминэргических нейронов черной субстанции. В нижеприведенной таблице представлено время, проведенное крысами всех групп в светлой половине установки «темно-светлая камера» на 4-й и 5-й неделях эксперимента.
Время, проведенное в светлом отсеке установки «темно-светлая камера» на 4-й и 5-й неделях эксперимента крысами различных групп
|
Неделя эксперимента |
Время, проведенное в светлом отсеке установки «темно-светлая камера» крысами контрольной группы, Me (Q1-Q3), с |
Время, проведенное в светлом отсеке установки «темно-светлая камера» крысами группы сравнения, Me (Q1-Q3), с |
Время, проведенное в светлом отсеке установки «темно-светлая камера» крысами основной группы, Me (Q1-Q3), с |
|
4-я неделя эксперимента |
252 (185-284) |
111,5 (41-182) |
98 (54-279) |
|
5-я неделя эксперимента |
242 (180-267) |
67 (6,5-96,5) |
143,5 (12-297) |
Как видно из данных, приведенных в таблице, на 4-й неделе между группой сравнения и основной группой отсутствовали статистически значимые различия во времени, проведенном в светлом отсеке установки (MW-test, p=0,554). При этом время, проведенное крысами группы сравнения и сновной группы, было статистически значимо ниже (MW-test, p=0,003 и p=0,046 соответственно), чем у крыс из группы контроля. На 5-й неделе, после прохождения крысами из основной группы недельного курса ТЭС-терапии, время, проведенное в светлом отсеке крысами из данной группы, было статистически значимо (MW-test, p=0,002) выше, чем у крыс из группы сравнения, – в 2,14 раза, что можно трактовать как меньшую выраженность тревогоподобного поведения у крыс из основной группы по сравнению с крысами из группы сравнения. При этом у крыс из группы сравнения величина времени, проведенного в светлом отсеке, была статистически значимо (MW-test, p=0,000023) ниже, чем у крыс из группы контроля, в то время как у крыс из основной группы, несмотря на меньшее значение медианы времени, проведенного в светлом отсеке, чем у крыс из контрольной группы, между ними не имеется статистически значимых различий (MW-test, p=0,044). Также из данных вышеприведенной таблицы следует, что у крыс из группы сравнения, которые не получали ТЭС-терапию с 4-й по 5-ю недели эксперимента, на 5-й неделе эксперимента произошло снижение времени нахождения в светлом отсеке 1,66 раза, что говорит об увеличении выраженности тревогоподобного поведения; в то время как у крыс из основной группы, прошедших 7-дневный курс ТЭС-терапии, относительно 4-й недели эксперимента наблюдался рост времени, проведенного в светлой камере в 1,46 раза на 5-й неделе эксперимента. Подобная динамика времени пребывания в «светлом» отсеке говорит о снижении выраженности тревогоподобного поведения у крыс после прохождения недельного курса транскраниальной электростимуляции.
Таким образом, селективная активация опиоидергической системы посредством ТЭС-терапии у крыс с моделью ротенонового паркинсонизма обеспечивает антиоксидантный эффект, механизм которого можно объяснить активацией синтеза и секреции β-эндорфина, [13]. Антиоксидантный [13] эффект ТЭС-терапии, вероятно, снижает повреждающее действие свободных радикалов, образующихся при блокировании ротеноном митохондриального комплекса I [10]. Таким образом, ТЭС-терапия воздействует на одно из патогенетических звеньев формирования тревоги, приводя к снижению выраженности тревогоподобного поведения у крыс. Нейропротекторный эффект ТЭС-терапии [13], вероятно, увеличивает жизнеспособность оставшихся нейронов черной субстанции, обеспечивающей дофаминергическую иннервацию базальных ядер [9], препятствуя нарушению баланса нейромедиаторов и снижая степень тревожности у экспериментальной группы животных.
Заключение
ТЭС-воздействие на головной мозг сопровождается анксиолитической активностью, о чём свидетельствует увеличение времени пребывания экспериментальных животных с моделью ротенонового паркинсонизма в «светлом» отсеке установки «темно-светлая камера». У крыс с моделью ротенонового паркинсонизма, которым проведен недельный курс ТЭС-терапии (основная группа), время, проведенное в светлой камере, в 2,14 раза превышало токовое у крыс, не подвергавшихся ТЭС-воздействию (группа сравнения). У крыс с моделью ротенон-индуцированного паркинсонизма, которые не подвергались курсу ТЭС-терапии (группа сравнения), в течение недели после завершения формирования модели паркинсонизма происходит падение времени нахождения в светлом отсеке, то есть происходит усиление тревожного состояния.
Полученные результаты свидетельствуют о перспективности дальнейшего изучения влияния ТЭС-терапии на тревогоподобное поведение экспериментальных животных в поведенческих тестах, о значительном потенциале этого метода, как перспективного для немедикаментозной коррекции патологических тревожных состояний.
Библиографическая ссылка
Кравченко С.В., Каде А.Х., Вчерашнюк С.П., Поляков П.П., Булатова В.В., Мищенко А.С. ВЛИЯНИЕ ТЭС-ТЕРАПИИ НА ДИНАМИКУ ТРЕВОЖНОГО СОСТОЯНИЯ КРЫС С МОДЕЛЬЮ РОТЕНОНОВОГО ПАРКИНСОНИЗМА // Современные проблемы науки и образования. 2019. № 3. ;URL: https://science-education.ru/ru/article/view?id=28903 (дата обращения: 12.03.2026).
DOI: https://doi.org/10.17513/spno.28903



