В мире ежегодно регистрируется 800 тысяч венозных тромбоэмболических осложнений (ВТЭО), а тромбоэмболия легочной артерии (ТЭЛА) находится на 3-м месте после причин смерти от сердечно-сосудистых заболеваний, инфаркта миокарда и инсульта. Зачастую ТЭЛА формируется и приводит к летальным исходам среди больных хирургического профиля [1; 2].
Главными недостатками формирования групп риска развития ТЭО являются: косвенный характер диагностики, основанной зачастую на анализе клинической картины, данные инструментальной диагностики и мониторирования параметров системы гемостаза. Необходимо отметить, что далеко не все исследования доказывают влияние факторов риска на развитие деформирующих остеоартрозов (ДОА). По мнению многих учёных, развитие ТЭО может быть сопряжено с генетическими факторами, вплоть до 50% всех «неблагоприятных» нарушений.
Хирургические операции ортопедического профиля, такие как тотальное эндопротезирование (ТЭП) крупных суставов нижних конечностей, считаются оперативными вмешательствами высокого риска формирования ВТЭО.
Доказано, что низкомолекулярные гепарины (НМГ) способны эффективно предотвращать возникновение венозных тромбозов [3-6].
В тех случаях, когда необходимо быстрое снижение процессов гемокоагуляции, применяют НМГ. Практически сразу же после введения гепаринов наступает гипокоагуляционное действие, поэтому данная категория препаратов нашла широкое применение для профилактики и лечения ВТЭО. Установлено, что фракции сосудисто-эндотелиального фактора роста, синтезируемые в эндотелиальных клетках на основе альтернативного сплайсинга – VEGF189 и VEGF206, могут связывать НМГ, так как содержат избыточное количество положительно заряженных аминокислот [7]. С другой стороны, молекулы VEGF через активацию роста хондроцитов активно принимают участие в росте костей [8].
Повышенный выброс в кровь молекул VEGF, возможно, может быть обусловлен гипоксией тканей [9; 10].
Известно, что в условиях гипоксии тканей молекулы VEGF способны оказывать на клетки печени гепатопротекторное действие [11], в том числе из-за угнетения процессов апоптоза [12].
У данной категории больных травматолого-ортопедического профиля, планируя меры профилактики ВТЭО НМГ, при выборе адекватного метода профилактики послеоперационных осложнений необходимо исследовать полный спектр биомаркеров систем свёртывания и фибринолиза, учитывая возможность малосимптомного и бессимптомного тромбоза. Необходимо принимать во внимание, что у обследованных пациентов могут быть обнаружены генетические полиморфизмы различных биомаркеров систем свертывания и фибринолиза, что значительно может влиять на оказываемые фармакодинамические эффекты низкомолекулярных гепаринов [13; 14].
В последние десятилетия врачи различных специальностей проводили исследования с целью решения проблемы лечения пациентов с ТЭО. Многие работы связаны с изучением роли воспаления, с оценкой влияния дополнительных факторов риска, наследственной предрасположенностью к тромбообразованию у больных (Giuffrè M. et al., 2016; Guyatt G.H. et al., 2012; Simão A.P. et al., 2014).
Высокая степень инвалидизации и широкая распространённость ВТЭО обуславливают проведение комплексной оценки и выявление диагностически значимых маркеров при данной патологии.
Целью явилось изучение у больных травматолого-ортопедического профиля клинико-диагностических маркеров тромбоэмболических осложнений с учётом патогенетического механизма развития деформирующих остеоартрозов.
Материалы и методы исследования
В соответствии с установленной целью и задачами были проанализированы результаты обследования 171 человека, из которых 151 человек составили группы обследуемых пациентов, находившихся в условиях стационара Научно-исследовательского института травматологии, ортопедии и нейрохирургии ФГБОУ ВО «СГМУ им. В.И. Разумовского» Министерства здравоохранения Российской Федерации на обследовании и лечении с диагнозом деформирующий остеоартроз. Среди них мужчин - 27,2%, женщин - 72,8%. Средний возраст пациентов составил 59,5±4,65 года.
В контрольную группу вошли 20 практически здоровых лиц: 8 мужчин и 12 женщин от 29 до 65 лет (средний возраст составил 53±9 лет). Критерии включения: возраст от 29 до 65 лет, с нормальными значениями артериального давления, не имеющие никаких жалоб на состояние своего здоровья, отсутствие сопутствующей соматической патологии, добровольное согласие людей на участие в исследованиях.
Всем пациентам с целью тромбопрофилактики был назначен низкомолекулярный гепарин (НМГ) эноксапарин («Клексан»). Проводилось динамическое исследование: при поступлении пациента в стационар, на фоне приёма НМГ – на 2-3-и и на 7-10-е сутки после тотального эндопротезирования крупных суставов нижних конечностей.
О воспалительном характере процесса судили по концентрации С-реактивного белка (СРБ) в сыворотке крови, который определяли посредством диагностического набора «CRP FS» DiaSys Diagnostic Systems GmbH, Germany для фотометрического измерения реакции антиген-антитело между антителами к человеческому СРБ и СРБ, находящемуся в образце.
Об активности фибринолитической системы крови судили по наличию гена ингибитора активатора плазминогена 1-го типа (PAI-1), который определяли с помощью «Системы генетического анализа PyroMark Q24» (фирма Qiagen, Германия; реагенты – «ДНК-сорб-В» производства ФБУН ЦНИИ Эпидемиологии Роспотребнадзора), ПЦР и пиросеквенирования на приборе «АмплиСенсПироскрин» с программным обеспечением Форма 6 «ПЛАЗМО-скрин» в лаборатории Медицинского Di-центра г. Энгельса.
Обработка данных осуществлялась при помощи пакетов компьютерных программ Statistica 10.0 (StatSoft Inc.), SPSS 13.0 for Windows (SPSS Inc.), которые использовались для статистического и математического анализа полученных результатов. Для определения вида распределения данных в выборках использовались критерии Колмогорова-Смирнова и Шапиро-Уилка.
Эффективность диагностики по анализу чувствительности и специфичности оценивалась с помощью построения характеристической кривой (ROC-анализ) при разных точках разделения значений лабораторных показателей. Информативность показателя оценивалась по величине площади под кривой (AUC). Чем ближе кривая к диагонали (AUC=0,5), тем ниже диагностическая ценность показателя, чем ближе площадь под кривой к 1, тем эффективнее диагностический тест. На характеристической кривой можно выбрать диагностический порог (точку отсечения), который соответствует максимально возможной чувствительности и специфичности исследованному показателю.
Результаты исследования и их обсуждение
На фоне введения НМГ у пациентов наблюдается резкий подъём концентраций СРБ в сыворотке крови от уровня значений СРБ при поступлении. Повышенные концентрации СРБ сохраняются и при выписке (таблица 1).
Таблица 1
Диагностический порог, чувствительность и специфичность СРБ при деформирующих остеоартрозах в исследуемой группе
|
Показатель |
Величина cutoff (диагностический уровень) |
Чувствительность, % |
Специфичность, % |
|
СРБ (поступление) |
3,8 мг/л р1>0,05 |
80 |
91 |
|
СРБ (2-3-й день после введения НМГ) |
11,35 мг/л р2>0,05 |
100 |
98 |
|
СРБ (выписке) |
20,2 мг/л р2>0,05; р3<0,01 |
100 |
97 |
Примечание: p1 – достоверность по отношению к данным контрольной группы; p2 – достоверность внутри группы по отношению к дооперационным данным; p3 – достоверность внутри группы по отношению к данным во 2-3-и сутки после операции.
Нарастание уровня СРБ отражает вялотекущее воспаление в интиме сосуда и проспективно определяет риск развития сосудистых осложнений [14].
С учётом эффективной диагностической значимости СРБ была выделена группа пациентов (n=103) с высокой концентрацией СРБ в сыворотке крови (> 3,8 мг/л), которым было проведено молекулярно-генетическое исследование генов по профилю «Плазмо-скрин. Плазменные факторы системы свёртывания крови» методом пиросеквенирования с обнаружением в этой группе гена PAI-1 c генотипом 5G/4А, 4G/4G (таблица 2).
Высокая концентрация в крови С-реактивного белка (выше 3,8 мг/л) у больных с деформирующими остеоартрозами тазобедренного и коленного суставов ассоциирована с 28 моногенотипами генов PAI-1, гена фактора VII и гена FGB-фибриногена.
Концентрация С-реактивного белка выше 5,9 мг/л была ассоциирована с полиморфизмом 5G/4G гена PAI-1 и G/A гена FGB-фибриногена у 3 пациентов. Концентрация СРБ выше 12,45 мг/л была ассоциирована с полиморфизмом 4G/4G гена PAI-1 и G/A гена фактора VII у 4 пациентов. Продукция С-реактивного белка <3,8 мг/л обнаруживалась у пациентов с «дикими» полиморфными вариантами генов PAI-1, фактора VII и FGB-фибриногена, в то же время у 5 пациентов обнаруживалась низкая продукция С-реактивного белка, которая была ассоциирована с моногенотипами PAI-1, фактора VII и FGB-фибриногена в исследуемой группе. С низкой продукцией СРБ (<3,8 мг/л) ассоциировано 5 моногенотипов, исследуемых в этой группе.
Таблица 2
Распределение и частота встречаемости аллельных вариантов генов факторов системы гемостаза у обследованных пациентов
|
Ген |
Мутация/ Полиморфизм |
Генотипы |
Группа 1 (n=40) |
Группа 2 (n=111) |
Критерий Фишера/ χ2 |
||
|
Распределение генотипа, % |
Частота аллеля |
Распределение генотипа, % |
Частота аллеля |
||||
|
F2 |
G20210 А |
G/G |
97 |
G=0,80 А=0,20 |
98 |
G=0,99 А=0,01 |
F=(–) p=0,564 |
|
G/A |
3 |
2 |
|||||
|
A/A |
0 |
0 |
|||||
|
F5 |
GR534Q А |
G/G |
94 |
G=0,97 А=0,03 |
99 |
G=0,99 А=0,01 |
F=(–) p=0,827 |
|
G/A |
6 |
1 |
|||||
|
A/A |
0 |
0 |
|||||
|
F7 |
GR353Q А |
G/G |
87 |
G=0,94 А=0,06 |
99 |
G=0,99 А=0,01 |
F=(–) p=0,827 |
|
G/A |
13 |
1 |
|||||
|
A/A |
0 |
0 |
|||||
|
FGB |
G455Q А |
G/G |
50 |
G=0,75 А=0,25 |
55 |
G=0,73 А=0,27 |
χ2=7,95 р=0,047 |
|
G/A |
50 |
40 |
|||||
|
A/A |
0 |
5 |
|||||
|
PAI?1 |
5G -675 4G |
5G/5G |
20 |
5G=0,39 4G=0,61 |
27 |
5G=0,55 4G=0,45 |
χ2=7,69 р=0,053 |
|
5G/4G |
39 |
27 |
|||||
|
4G/4G |
41 |
46 |
|||||
Примечание: сравнение контрольных и опытных частот проводилось с помощью критерия χ2 на независимость при условии, что все значения частот сравниваемых признаков больше 5. При частотах меньше 5 сравнение проводилось с использованием точного критерия Фишера.
Заключение. Одним из направлений в лабораторной диагностике, активно развивающейся как за рубежом, так и в нашей стране, является поиск новых диагностически значимых маркеров, которые могут превзойти по своей информативности уже имеющиеся на сегодняшний день, а также способствовать улучшению диагностики и профилактики осложнений, которые могут развиться в ходе проведенного оперативного вмешательства. Такие исследования будут способствовать развитию прогностических маркеров, что повысит диагностику еще на доклиническом этапе.
Представленные данные показывают, что определение СРБ, полиморфизма 5G -675 4G гена PAI-1 в сыворотке крови могут быть использованы для оценки риска возникновения ТЭО, что и легло в основу патогенетической схемы развития деформирующих остеоартрозов (рисунок).
Предложенная стратегия, предотвращающая ВТЭО с применением генетического метода, полностью не решает проблему у исследуемых пациентов, но она предопределяет тенденцию к уменьшению летальности от ТЭЛА, не приводя к росту геморрагических осложнений.
Учитывая полученные данные, с целью дальнейшего уменьшения частоты встречаемости ВТЭО у пациентов ортопедического профиля, нам представляется целесообразным выделение группы пациентов с «наиболее высоким риском», которые нуждаются в тщательном лабораторном мониторинге.
Учитывая полученные данные, с целью дальнейшего уменьшения частоты встречаемости ВТЭО у пациентов ортопедического профиля, нам представляется целесообразным выделение группы пациентов с «наиболее высоким риском», которые нуждаются в тщательном лабораторном мониторинге.
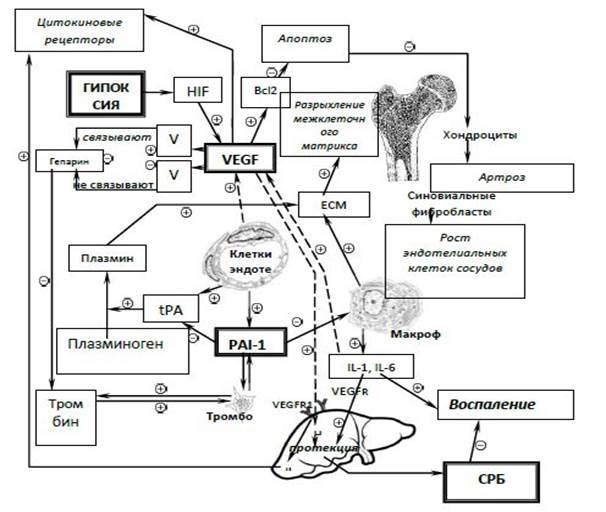
Патогенетическое развитие деформирующих остеоартрозов
К этой группе необходимо относить следующих пациентов:
1. Концентрация СРБ в сыворотке крови >3,8 мг/л.
2. Обнаружен полиморфизм 5G -675 4G гена PAI-1 в сыворотке крови.
Предложенное нами исследование (определение концентрации СРБ в сыворотке крови и генетических полиморфизмов) будет способствовать выделению группы пациентов с возможным высоким риском развития венозных тромбоэмболических осложнений у больных травматолого-ортопедического профиля. Это позволяет подобрать индивидуальную эффективную систему профилактики, достоверно снизить частоту развития послеоперационных венозных тромбоэмболических осложнений, а также послеоперационную летальность, что определяет повышение качества оказания хирургической помощи.
Библиографическая ссылка
Воробьева И.С., Бородулин В.Б., Никитина В.В., Гладилин Г.П., Коваленко А.В. ОСНОВНЫЕ МЕХАНИЗМЫ ПАТОГЕНЕТИЧЕСКОГО РАЗВИТИЯ ДЕФОРМИРУЮЩИХ ОСТЕОАРТРОЗОВ // Современные проблемы науки и образования. 2019. № 3. ;URL: https://science-education.ru/ru/article/view?id=28846 (дата обращения: 12.03.2026).



