В настоящее время для оценки пролиферативной активности клеток используется множество ядерных маркеров, которые нередко являются неспецифичными и свидетельствуют о вступлении клетки в фазу репликации. Наиболее известными являются такие факторы клеточной пролиферации, как PCNA, Ki-67, PHH3, последний из которых, по данным исследователей, дает наименьшее число ложноположительных результатов [1]. Однако оценить направленность пролиферативных процессов в результате физиологической регенерации или репарации в определенных тканях по-прежнему проблематично. Наиболее высокой пролиферативной активностью и способностью к полноценному восстановлению обладают эпителиальные ткани, где исключением не является железистый эпителий, в том числе и щитовидной железы (ЩЖ) [2].
Известно, что фолликулярный эпителий является высокочувствительным к различного рода негативным влияниям и реагирует изменением синтеза гормонов с развитием морфологических изменений в паренхиме ЩЖ, что приводит к нарушению тиреоидного гомеостаза [3]. Определить способность к восстановлению тироцитов при утрате клеток фолликулярного и экстрафолликулярного эпителия возможно, оценив распределение основных маркеров пролиферации тироцитов. Известно, что к таковым относят тиреоидспецифический фактор транскрипции (thyroidtranscriptionfactor-1 (TTF-1)), который находится в тесном взаимодействии с другим фактором транскрипции, относящимся к семейству генов Pax8 (Pairedbox 8), участвующим в перестройке щитовидной железы, путем дифференциации тироцитов по определенному фенотипу [4, 5]. Однако Pax8 может быть выявлен в эмбриональных тканях почек, нервной системы, что свидетельствует о его локализации в различных клетках, включая и зрелые тироциты [6]. Показано участие Pax8 совместно с TTF-1 в регуляции синтеза тироглобулина, тиропероксидазы и транспортера йода.
Таким образом, достоверно оценить пролиферативную активность тироцитов возможно при совместном определении Pax8 и TTF-1, в то время как направленность данного процесса и топография иммунопозитивных клеток к маркерам транскрипции остаются не ясными.
Цель исследования заключается в определении закономерности распределения специфических маркеров пролиферации тироцитов при циррозе.
Материал и методы исследования. В рамках стандартного гистологического исследования был использован аутопсийный материал (ткани ЩЖ и печени) от 32 лиц 40–45 лет мужского пола, где наличие цирроза печени верифицировалось при окраске гематоксилином и эозином, также при окраске по ван Гизону. Нами были отобраны только те случаи, в которых наблюдались ремоделирование печеночной паренхимы с образованием узлов регенерации, массивной пролиферации соединительной ткани, а также наличие участков жировой дистрофии гепатоцитов, так как в большинстве случаев лица среднего возраста имели алкогольную этиологию заболевания, где первичным было развитие жирового гепатоза. Также наиболее распространенной причиной развития цирроза печени у лиц данной возрастной группы было наличие в анамнезе вирусного гепатита В или гепатита С. С целью исключения влияния половых гормонов и выявления гендерных различий нами были выбраны лица одного (мужского) пола. Таким образом, критериями включения в группу исследуемых лиц были: мужчины среднего возраста, наличие цирроза печени и печеночной недостаточности (по клиническим данным), отсутствие в анамнезе эндокринных заболеваний. Причиной смерти во всех случаях согласно медицинскому свидетельству о смерти было кровотечение из варикозно расширенных вен пищевода. Учитывая, что гистологическое исследование входит в стандарт патолого-анатомического исследования органов при аутопсии, нами был произведен скрининговый отбор случаев с наличием перестройки тиреоидной паренхимы различной степени выраженности, что составило 77,3% всех случаев. При окраске ткани ЩЖ гематоксилином и эозином наблюдалось наличие мелкоузловых образований, которые располагались преимущественно в нижней доле щитовидной железы и отграничивались тонкими прослойками соединительной ткани. Однако определить степень пролиферации тироцитов, их распределение в ткани ЩЖ, а также достоверно судить о наличии клеток, вступивших в фазу деления, при стандартном гистологическом исследовании не представляется возможным. В связи с этим нами было выполнено иммуногистохимическое исследование непрямым иммунопероксидазным методом с использованием поликлональных антител к Pax8 и TTF-1 с системой визуализации на основе диаминобензидина (DAB) (фирмы Spring Bioscience, США) согласно рекомендуемому протоколу фирмы-производителя. Затем производили микрофотосъемку с помощью микроскопа Leica DM 1000 и программного базового пакета «Leica Application Suite» (Leica, Германия). Анализ распределения маркеров пролиферации тироцитов проводился с учетом зональности щитовидной железы – центральная и периферическая зоны, а также с учетом верхней, средней и нижней частей каждой доли, где границей между ними служила условная линия, расположение которой связано с особенностями микроциркуляторного русла ЩЖ.
Морфометрическое исследование проводили с использованием инструментов программного обеспечения «Leica Application Suite», определяли площадь ядер иммунопозитивных клеток к TTF-1 (STTF-1,мкм2), площадь ядер иммунопозитивных клеток к Pax8 (SPax8, мкм2), площадь ядер иммунонегативных тироцитов в группе TTF-1 и Pax8 (SnegTTF-1 и SnegPax8, мкм2), площадь тироцитов (S, мкм2), ядерно-цитоплазматическое соотношение (ЯЦО), рассчитанное по формуле: ЯЦО = Sя/Sц (где Sя – площадь ядра, Sц – площадь цитоплазмы), процент иммунопозитивных клеток в поле зрения для каждого случая. Кроме этого, для достоверного включения периферической и центральной зон определяли диаметр фолликулов (D, мкм). Статистическая обработка результатов производилась в программе Statistica версии 13.0.
Результаты исследования и их обсуждение. В проведенных нами ранее исследованиях при окраске гематоксилином и эозином выявлены закономерности перестройки ткани ЩЖ на фоне хронической эндогенной интоксикации, обусловленной гепатофиброзом/циррозом [7].
При проведении иммуногистохимического исследования выявлены особенности распределения иммунопозитивных клеток к тиреоидным факторам транскрипции. Следует отметить, что при определении количества иммунопозитивных тироцитов к Pax8 клетки определялись как в интрафолликулярном, так и в экстрафолликулярном эпителии (рис. 1А, Б).
При этом позитивное окрашивание тироцитов наблюдалось в островках экстрафолликулярного эпителия, где в основном был представлен паренхиматозный компонент, а не за счет дочерних фолликулов согласно классическому пути образования фолликулов. Иммунопозитивные клетки к Pax8 распределялись неравномерно в зависимости от зональности ЩЖ. В периферической зоне, где фолликулы были крупнее и содержали значительное количество коллоида, наибольшее число иммунопозитивных клеток наблюдалось со стороны экстрафолликулярного эпителия, в то время как фолликулярный эпителий имел отдельные иммунопозитивные клетки, часть из которых давала ложнопозитивное окрашивание.

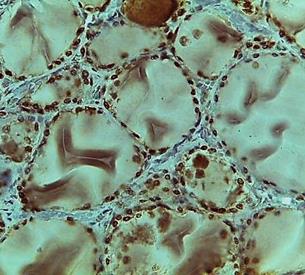

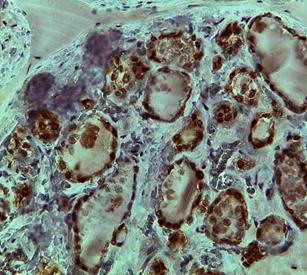
Рис. 1. Распределение иммунопозитивных клеток к Pax8 в периферической (А) и центральной (Б) зонах нижней доли щитовидной железы. Ув. 10, об. 20
Также при сопоставлении структуры интрафолликулярного эпителия и наличия иммунопозитивных клеток к Pax8 было установлено, что эпителий имел уплощенную или кубическую форму, что косвенно свидетельствовало об эутиреотическом состоянии, а единичные клетки вступали в фазу деления. Наличие иммунопозитивных клеток к Pax8 интрафолликулярного эпителия можно объяснить способностью к физиологической и высокой репаративной регенерации всех эпителиальных тканей. При анализе строения центральной зоны ЩЖ было установлено, что диаметр фолликулов был меньше по сравнению с периферической зоной, эпителий имел кубическую форму, количество иммунопозитивных клеток было значительно больше по сравнению с периферической зоной.
В островках экстрафолликулярного эпителия практически все клетки имели иммунопозитивную реакцию к Pax8, что свидетельствовало о высокой пролиферативной активности тироцитов. В сформированных фолликулах интрафолликулярный эпителий также сохранял пролиферативную активность, при этом количество иммунопозитивных клеток к Pax8 напрямую зависело от диаметра фолликула (мелкие фолликулы имели большее количество иммунопозитивных клеток), что может служить источником формирования так называемых радиальных узелков центральной зоны и не противоречит данным литературы. Однако результаты иммуногистохимического исследования при использовании Pax8 нельзя оценить однозначно, так как Pax8 отводится роль в синтетической функции тироцитов, что может свидетельствовать об усилении транспорта йода за счет продукции тиропероксидазы и тироглобулина и, следовательно, давать иммунопозитивную реакцию.
В связи с этим дальнейшее исследование было направлено на изучение распределения иммунопозитивных клеток к TTF-1 в ткани ЩЖ. Так, в периферической зоне отмечалось наличие иммунопозитивных клеток в интрафолликулярном эпителии, которые чередовались с клетками в стадии покоя, при этом их количество не зависело от диаметра фолликулов; в равной степени они были выявлены как в мелких, так и в крупных фолликулах. Со стороны экстрафолликулярного эпителия были выявлены единичные клетки к TTF-1 (рис. 2 А, Б).
При анализе центральной зоны определялось значительное количество иммунопозитивных клеток к TTF-1, которые располагались как диффузно, так и группами, образовывая островки экстрафолликулярного эпителия. Кроме этого, пролиферация клеток наблюдалась со стороны фолликулярного эпителия, где отмечались образование подушечек Сандерсона и формирование дочерних фолликулов, что не противоречит полученным нами ранее данным [7].
При морфометрическом исследовании было установлено, что диаметр фолликулов периферической зоны ЩЖ был в 2,6 раз больше, чем центральной зоны, что связано с депонированием коллоида.
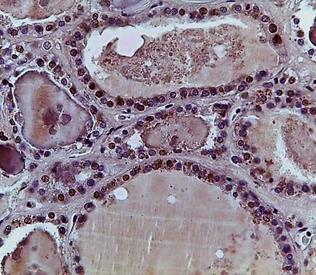

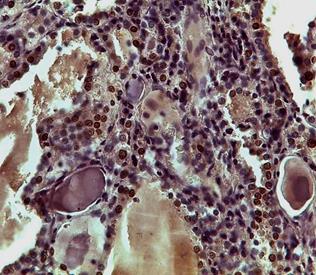
Рис. 2. Распределение иммунопозитивных клеток к TTF-1 в периферической (А) и центральной (Б) зонах нижней доли щитовидной железы. Ув. 10, об. 20
Существенно отличались показатели пролиферации тироцитов в центральной и периферической зонах. Количество иммунопозитивных клеток к TTF-1 в центральной зоне было в 1,4 раза больше, чем в периферической, что объясняется наличием мелких фолликулов и островков экстрафолликулярного эпителия, которые участвуют в фолликулогенезе ЩЖ. Количество иммунопозитивных клеток к Pax8 в периферической зоне не имело статистической значимости по сравнению с количеством иммунопозитивных клеток к TTF-1 (р>0,05), в то время как в центральной зоне процент иммунопозитивных клеток к TTF-1 существенно превышал показатели таковых к Pax8 – в 1,7 раза (p<0,05), таблица 1.
При сравнении морфометрических показателей площади ядер иммунопозитивных клеток к TTF-1 и Pax8 достоверных отличий выявлено не было как в центральной, так и в периферической зонах ЩЖ. Сопоставление площади ядер иммунопозитивных и иммунонегативных клеток показало, что STTF-1и SPax8 существенно отличались, площадь ядер иммунопозитивных клеток к TTF-1 и Pax8 увеличивалась в 1,1 и 1,3 раза соответственно (p<0,05). Площадь тироцитов зависела от функционального состояния и фазы клеточного цикла. Так, клетки в период покоя (G0) имели меньшую площадь, чем клетки, вступившие в фазу деления. Данный факт подтверждался наличием иммунопозитивных клеток к специфическим факторам транскрипции, что, по-видимому, связано с усилением белково-синтетических процессов. При оценке ЯЦО иммунопозитивных клеток к TTF-1 и Pax8 достоверных отличий выявлено не было, что свидетельствует о достоверности полученных данных и эффективности использования данных маркеров для определения направленности пролиферативной активности тироцитов (p<0,05).
Таблица 1
Морфометрические показатели тиреоидной паренхимы при хронической эндогенной интоксикации на фоне цирроза печени (M±m)
|
Морфометрические показатели |
Зоны щитовидной железы |
|
|
Центральная зона |
Периферическая зона |
|
|
Диаметр фолликулов, мкм |
74,51±7,3 |
196,74±42,83* |
|
Количество иммунопозитивных клеток TTF-1, % |
31,1±0,9 |
27,27±0,7* |
|
Количество иммунопозитивных клеток Pax8, % |
18,36±0,3 |
26,09±0,8* |
|
STTF-1, мкм2 |
25,54±1,7 |
27,38±2,1 |
|
SPax8, мкм2 |
27,97±2,27 |
27,79±6,3 |
|
SnegTTF-1 |
22,45±1,3 |
21,84±2,6 |
|
SnegPax8 , мкм2 |
21,48±1,2 |
20,16±2,1 |
|
SтироцитовTTF-1, мкм2 |
71,91±5,1 |
85,78±7,3* |
|
SтироцитовPax8, мкм2 |
75,17±2,1 |
86,49±3,7* |
|
ЯЦОтироцитовPax8 |
0,55±0,1 |
0,50±0,1 |
|
ЯЦОтироцитовTTF-1 |
0,64±0,2 |
0,51±0,1 |
* статистически значимые показатели центральной и периферической зон (достоверность р≤0,05)
Заключение. Соматическая патология, сопровождающаяся синдромом хронической эндогенной интоксикации, приводит к развитию полиорганной недостаточности с вовлечением органов эндокринной системы, что выражается в их морфофункциональной перестройке. Так, компенсаторно-приспособительные процессы ткани ЩЖ к негативным воздействиям происходили за счет наиболее мобильного компонента в отношении репаративных возможностей – эпителиальной ткани (тироцитов). Однако регенерация тироцитов происходила неравномерно: наибольшему влиянию подвергались участки нижних долек ЩЖ, что проявлялось в увеличении числа иммунопозитивных клеток к специфическим тиреоидным факторам транскрипции (TTF-1 и Pax8). Учитывая разнонаправленность значимости данных маркеров, обосновано их сочетанное использование для выявления пролиферативных процессов в ЩЖ. Также с учетом зональности ЩЖ выявлены наиболее «активные» участки, которые располагались в центральной зоне каждой доли и могут служить источником образования новых фолликулов.
Библиографическая ссылка
Полякова Л.В., Калашникова С.А., Газарян К.Э., Ваниев А.Г., Фогель А.В. ОСОБЕННОСТИ РАСПРЕДЕЛЕНИЯ СПЕЦИФИЧЕСКИХ МАРКЕРОВ ПРОЛИФЕРАЦИИ ТИРОЦИТОВ ПРИ ЦИРРОЗЕ ПЕЧЕНИ // Современные проблемы науки и образования. 2019. № 3. ;URL: https://science-education.ru/ru/article/view?id=28831 (дата обращения: 31.12.2025).
DOI: https://doi.org/10.17513/spno.28831



