Не вызывает сомнения, что лизоцим (мурамидаза) осуществляет противомикробную защиту организма. Повышение его выработки и активности – закономерный ответ на инфекционную агрессию. Принимая этот тезис как данность, следует признать, что активация лизоцима возможна стимулами, не имеющими антигенной природы.
Информация о вовлечении лизоцима в ответ на неспецифические раздражители появляется в результатах различных научных исследований [1]. Перечень работ можно продолжать, они публикуются регулярно вплоть до сегодняшнего дня [2; 3].
В исследованиях авторов приводятся сведения об активации лизоцима физическими, химическими факторами, при непосредственном и дистанционном воздействии на организм, in vivo и in vitro [4; 5].
Среди множества работ по-прежнему уделяется внимание стрессу как инициирующему фактору активации врожденного иммунитета, и в частности лизоцима [6; 7].
В ключе этих исследований изучение влияния острой соматической боли на активность лизоцима представляется оправданным и перспективным.
Цель исследования. Изучить в эксперименте влияние острой кратковременной соматической боли на активность лизоцима у половозрелых крыс.
Материал и методы исследования. В исследовании принимали участие 110 белых беспородных половозрелых крыс–самцов. Все животные распределены на две группы: контрольную (50 животных) и экспериментальную (60 животных). В каждой группе выделяли подгруппу, у которой моделировали острую соматическую боль и подгруппу без болевого воздействия.
Острую соматическую боль воспроизводили электрораздражением области корня хвоста крысы, используя электростимулятор ЭСУ–2. Параметры раздражителя: напряжение – 30 вольт, частота – 1000 Гц, продолжительность импульса – 500 мс, интервал между импульсами 1 мс, продолжительность алгогенного раздражения – 2 мин., достигалась 3-4 степень интенсивности боли по классификации А.В. Вальдмана и Ю.Н. Васильева в модификации В.Г. Овсянникова [8].
Забор крови производили через 2, 30, 60, 120, 180 мин. после алгогенного раздражения. Собранный материал использовали для определения активности мурамидазы. Для определения активности лизоцима по методу В.Г. Дорофейчук [9] в нашей модификации использовалась сыворотка крови животных. Готовят микробную взвесь Micrococcus lysodeikticus. Взвесь стандартизирована на ФЭК–56 при использовании зеленого45 светофильтра (540 ммк). В течение часа инкубируется взвесь микробов в сыворотке крови. Через час смесь встряхивается и нефелометрируется. Разность показателей опытного образца и стандартной культуры характеризует активность лизоцима.
В контрольных опытах анестезия корня хвоста крысы осуществлялась раствором лидокаина.
Гистологические препараты тканей корня хвоста крысы после стандартной обработки окрашивались гематоксилин-эозином и микроскопировались.
Статистическое сравнение данных проводилось на основе U-критерия Манна-Уитни. Критическое значение уровня значимости (р) принималось равным 0,05. Результаты расчетов представлены как медиана с квантилями и интервалом значений Ме [Q0,25; Q0,75] (Min-Max). Работа с экспериментальными животными была произведена согласно Приказу Министерства здравоохранения и социального развития Российской Федерации № 708н «Об утверждении правил лабораторной практики» от 23 августа 2010 года.
Результаты исследования и их обсуждение. В контрольных опытах фоновый уровень активности лизоцима у крыс составляет Ме=0,267 ед. [Q0,25=0,239 ед.; Q0,75=0,299 ед.]. Минимальный уровень активности - 0,115 ед., максимальный - 0,307 ед., обращает на себя внимание, что интерквантильный интервал приближен к максимальному уровню.
Сразу после алгогенного воздействия отмечается всплеск активности фермента. Ме=0,473 ед. [Q0,25=0,396 ед.; Q0,75=0,485 ед.]. Min = 0,33 ед., max = 0,502 ед. (p<0,001) (таблица 1).
Через полчаса активность лизоцима начинает падать. Ме=0,389 ед. p<0,001 по отношению к контролю [Q0,25=0,371 ед.; Q0,75=0,412 ед.]. Min – 0,309 ед., max – 0,426 ед. Через час от начала эксперимента активность лизоцима продолжает снижаться и принимает значения ниже исходных. Ме=0,175 ед. [Q0,25=0,134 ед.; Q0,75=0,273 ед.], min=0,101 ед., max=0,322 ед., p<0,001 по отношению к фоновым значениям. Эта тенденция сохраняется и через 2 часа: Me=0,102 ед. [Q0,25=0,085 ед.; Q0,75=0,188 ед.]. Min=0,031 ед., Max=0,375 ед. (p<0,001 по отношению к предыдущим результатам).
Активность лизоцима достигает своего минимума через 3 часа после долорогенного воздействия Ме=0,106 ед. [Q0,25=0,091 ед.; Q0,75=0,131 ед.], Min=0,076 ед., max=0,208 ед. (рис.1)
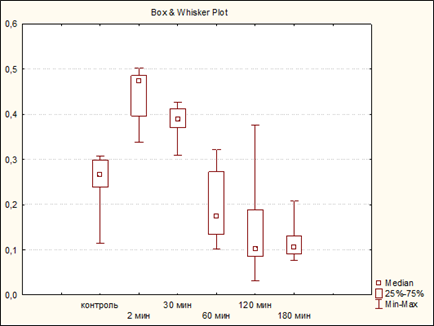
Рис. 1. Динамика изменения активности лизоцима у половозрелых крыс до и после нанесения алгогенного раздражения
Таблица 1
Уровень значимости (р) различия данных при попарном сравнении групп
|
Группы |
Контроль |
2 мин. |
30 мин. |
60 мин. |
120 мин. |
180 мин. |
|
Контроль |
||||||
|
2 мин. |
0,000003 |
|||||
|
30 мин. |
0,000003 |
0,004795 |
||||
|
60 мин. |
0,044254 |
0,000003 |
0,000004 |
|||
|
120 мин. |
0,000308 |
0,000005 |
0,000009 |
0,007941 |
||
|
180 мин. |
0,000013 |
0,000003 |
0,000003 |
0,001050 |
0,851934 |
В исследованиях на интактных половозрелых животных отмечалась четкая статистически подтвержденная реакция лизоцима на острое болевое раздражение. Она заключалась в повышении активности исследуемого субстрата практически сразу после электроболевой стимуляции. Реакция носила краткосрочный характер. В последующей динамике эксперимента активность лизоцима снижалась и через два часа достигала контрольных значений.
В порядке постановки контрольных опытов производилась анестезия раздражаемой зоны. Наносимое электроболевое раздражение не вызвало в этом случае ответную реакцию со стороны изучаемого субстрата, о чем свидетельствуют нижеприведенные результаты.
Базальный уровень активности лизоцима до алгогенного раздражения составлял Me = 0,267 ед. [Q0,25= 0,239 ед.; Q0,75= 0,299 ед.]. Min значения в общей совокупности результатов наблюдения составили 0,115 ед., Max= 0,307 ед. (рисунок 2).
Через 2 мин. после раздражения анестезированной зоны медианные значения активности лизоцима составили 0,280 ед. [Q0,25= 0,239 ед.; Q0,75= 0,301 ед.], Min = 0,115; Max = 0,307 ед. При попарном сравнении результатов величина P во всех случаях превышала значение 0,1.
В интервале 30-60 мин. Me = 0,270 ед. [Q0,25= 0,233 ед.; Q0,75= 0,298 ед.], Min = 0,126 ед., Max = 0,301 ед. При сравнении с контрольными и предыдущими значениями величина P превышала 0,1 (таблица 2).
В последующие 2-3 часа эксперимента картина также не изменилась Me = 0,284 [Q0,25= 0,244 ед.; Q0,75= 0,298 ед.], Min = 0,126 ед., Max = 0,301 ед. Величина P при попарном сравнении во всех случаях свидетельствовала об отсутствии статистически значимых различий.
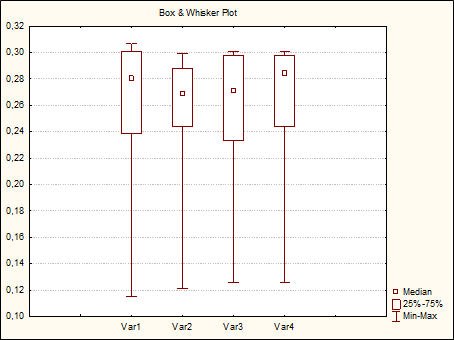
Рис. 2. Активность лизоцима при электрораздражении анестезированной прикорневой зоны половозрелых крыс
Таблица 2
Уровень значимости (P) различия данных при попарном сравнении групп
|
Группы |
Контроль |
2 мин. |
30-60 мин. |
120-180 мин. |
|
Контроль |
||||
|
2 мин. |
0,677585 |
|||
|
30-60 мин. |
0,705457 |
0,909722 |
||
|
120-180 мин. |
0,939743 |
0,545350 |
0,623177 |
Таким образом, наблюдаемые нами изменения активности лизоцима не сопряжены с электрохимическим раздражением рефлексогенной зоны, что дает основание связывать их с болевым компонентом наносимого воздействия.
Нельзя исключать возможность электрохимического повреждения тканей. Сама деструкция тканей может привести в движение факторы врожденного иммунитета, и в первую очередь нейтрофилы, и уже, как следствие, активацию лизоцима.
Иными словами, электростимуляция воспринимается лишь как триггер боли или она приводит к повреждению тканей?
Микроскопическое исследование тканей, подвергнутых контакту с источником электрокожного раздражения, не выявило зон некроза или иных признаков деструктивного поражения. Не обнаружено в исследуемых тканях и кровоизлияний.
Зарегистрированное полнокровие сосудов, частичная утрата поперечно-полосатой исчерченности в миоцитах и их набухание отражают факт раздражения, но отнюдь не повреждения. При этом следует отметить, что выявленные изменения отмечены на поздних этапах эксперимента, тогда как активность лизоцима повышалась сразу после электроболевого раздражения.
На фото 1 отражено обычное строение тканей, где рельефно просматривается роговой слой, сальные железы, волосяные фолликулы, мышцы и их фасции.
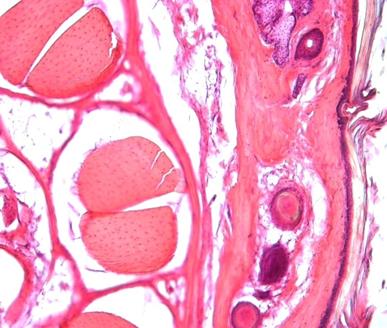
Фото 1. Увеличение: окуляр А-Plan 10х/0,25 объектив Pl 10х/18.
Обычное строение тканей
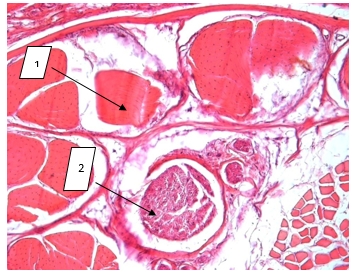
Фото 2. Сразу после электроболевого воздействия
На фото 2 видно, что мышечные волокна сохранены (1), окрашены равномерно, поперечно-полосатая исчерченность сохранена, виден нервный ствол (2).
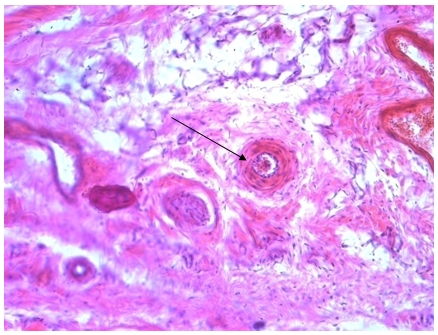
Фото 3. Через 30 минут после электроболевого воздействия
Отмечен спазм мелких артерий, эндотелиоциты расположены в виде частокола (фото 3).
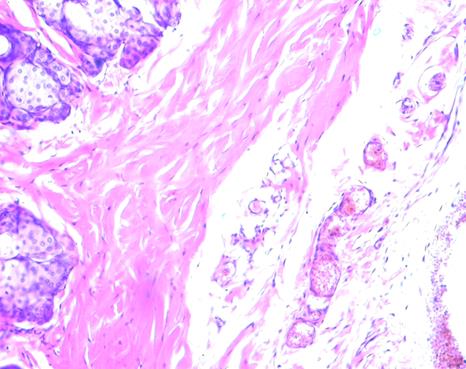
Фото 4. Через час после электроболевого воздействия
На фото 4 отчетливо показано полнокровие сосудов.
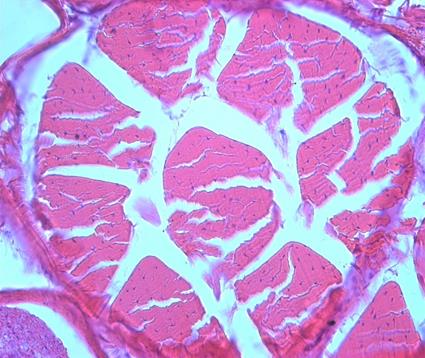
Фото 5. Через час после нанесения электроболевого воздействия
На приведенной фотографии отсутствуют признаки кровоизлияний в ткани (фото 5).
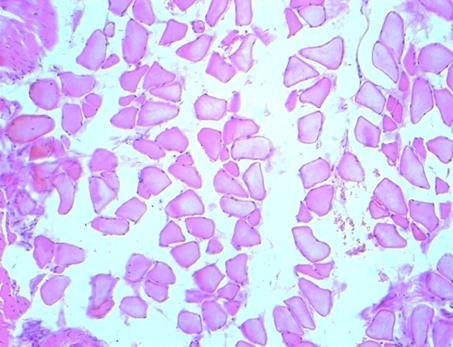
Фото 6. Через 2 часа после электроболевого воздействия
На фотографии отражено исчезновение в мышечном рисунке поперечной исчерченности за счет набухания цитоплазмы, цитоплазма однородна, имеется межмышечный отек (фото 6).
Таким образом, гистологическая картина свидетельствует, что сразу после нанесения электроболевого раздражения, когда отмечается всплеск активности лизоцима, ткани сохранены. Следствие их раздражения прослеживается позже, через один-два часа от начала эксперимента, как раз тогда, когда активность лизоцима поступательно снижается.
Выводы
1. Повышение активности лизоцима связано с субъективным восприятием боли как стрессора.
2. Анестезия зоны электроболевого раздражения профилактирует повышение активности лизоцима.
3. Электроимпульсное раздражение при избранных параметрах электрораздражения не вызывает некроз тканей.
Библиографическая ссылка
Овсянников В.Г., Алексеев В.В., Алексеева Н.С., Алексеева Н.А., Абрамова М.В., Бликян М.В., Лихачева Ю.Е., Бойченко А.Е. МУРАМИДАЗА В ПАТОГЕНЕЗЕ ОСТРОЙ СОМАТИЧЕСКОЙ БОЛИ // Современные проблемы науки и образования. 2019. № 2. ;URL: https://science-education.ru/ru/article/view?id=28775 (дата обращения: 04.03.2026).
DOI: https://doi.org/10.17513/spno.28775



