На сегодняшний день рост употребления психически активных веществ (ПАВ) зарегистрирован во всем мире, что является угрожающим фактором здоровью населения, экономике, национальным ценностям и правопорядку. Как за рубежом, так и в Российской Федерации негативные девиации среди лиц трудоспособного возраста в настоящее время приобрели характер эпидемии. Угрожающий масштаб потребления ПАВ требует от ученых, врачей и других специалистов активного изучения причин зависимости от ПАВ с целью дальнейшей разработки программ профилактики, диагностики, лечения и медико-социальной реабилитации больных. В настоящее время отмечается возрастающий интерес к исследованию патогенеза зависимости от психоактивных веществ с точки зрения конституционального генетического детерминизма, включая склонность к алкогольной зависимости и ее лечение [1, 2].
Патогенез развития склонности к алкоголю, по-видимому, связан с изменением уровня ацетальдегида в тканях головного мозга, которое происходит при потреблении алкоголя и зависит от активности систем метаболизма этанола и ацетальдегида в печени, почках, мышцах, тканях головного мозга. Отмечается, что предпочтение к алкоголю у животных, склонных к употреблению этанола, а также у человека генетически детерминировано и, вероятно, связано с интенсивностью обменных процессов в организме, может зависеть от активности систем ферментативного обмена спиртов и их метаболитов, которые являются мощными регуляторами уровня ацетальдегида в клетке. В связи с этим является актуальным исследование адаптационных механизмов систем, которые окисляют экзогенный этиловый спирт, таких как каталаза и алкогольдегидрогеназа, которые рассматриваются в качестве мощных регуляторов обмена ацетальдегида в тканях животных, отличающихся по склонности к формированию алкогольной зависимости [3, 4]. В иерархии структур головного мозга гипоталамусу принадлежит важная роль, которая обеспечивает взаимодействие симпатической и парасимпатической нервной системы, активирует эндокринные железы, регулирует обменные процессы, постоянство внутренней среды организма и участвует в формировании зависимости к алкоголю [5, 6].
При хроническом алкоголизме развивается дефицит нейротрансмиттеров, что само по себе угрожает жизнедеятельности организма. Механизмом компенсации этого явления является усиление синтеза катехоламинов и подавление активности ферментов их метаболизма, прежде всего моноаминоксидазы и дофамин-β-гидроксилазы, контролирующих процессы биохимической трансформации дофамина в норадреналин (норэпинефрин), снижается количество нейронов, содержащих окситоцин в ядрах переднего гипоталамуса [7].
Нейроны гипоталамуса, в частности area tegmentalis ventralis, могут играть важнейшую роль в механизмах зависимости. Алкоголь и другие вещества оказывают влияние на функционирование дофаминергических гипоталамических нейронов, что может стимулировать появление вегетативных расстройств, нарушение сна и др. [8].
Роль гипоталамуса значима и для развития мотивационного поведения, и для развития эмоциональных реакций, взаимосвязанных с подобным поведением. Большинство исследователей рассматривают гипоталамус как важную систему, в которой центры автономного контроля обеспечивают проявления мотивационного поведения, в том числе эмоционально окрашенного, регулируемого посредством регуляции основных типов врожденного поведения [9].
Цель исследования: сравнить морфологические характеристики нейронов супраоптических ядер гипоталамуса крыс, склонных и не склонных к формированию алкогольной зависимости.
Материал и методы исследования. При отборе крыс с различными уровнями начальной алкогольной мотивации использовали 180 белых крыс-самцов весом 180–220 г. Все экспериментальные животные были выведены в питомнике Волгоградского научно-исследовательского противочумного института. Большое внимание при проведении экспериментальной части исследования было уделено вопросам содержания, отбора, группировки животных, что позволило выполнить запланированные научные задачи. Содержание экспериментальных животных осуществляли в стандартных клетках Т-3 (Чехия). Кормление проводилось по стандартному лабораторному рациону со свободным доступом к воде, при температуре воздуха в виварии 18–22°С, относительной влажности воздуха 50–60%.
При отборе крыс с различными уровнями начальной (генетической) мотивации (склонных и не склонных к потреблению алкоголя) их тестировали с использованием этанолового теста сна и метода оценки интегративных свойств ЦНС, основанного на определении уровня общей неспецифической реактивности организма (УОНРО). В целях подтверждения правильности разделения крыс на группы: животные, склонные к формированию алкогольной зависимости (СА), и животные, не склонные к формированию алкогольной зависимости (НА), в дальнейшем производилось измерение среднесуточного объема потребления алкоголя крысами при условии свободного выбора.
На стадии отбора крыс с разными уровнями начальной алкогольной мотивации мы использовали тест на этаноловую анестезию, который позволяет оценить склонность к употреблению этанола по длительности сна, определяемого по продолжительности бокового положения животного после внутрибрюшинного введения 25%-ного раствора этанола в дозе 4,5 мг на 1 кг массы. Этот тест является приемлемым и адекватным для определения уровня алкогольной мотивации крыс при отсутствии длительного доступа к этиловому спирту, позволяет оценить активность этанол-метаболизирующих систем, а также чувствительность ЦНС к алкоголю.
Результаты теста послужили основанием для отбора 15 крыс с коротким сном, средняя продолжительность анестезии этанолом у которых была 45,6 ± 3,9 минуты, и 17 крыс с длительным сном продолжительностью 184,3 ± 11,4 минуты. «Длительно спящие» животные имеют отрицательную алкогольную мотивацию по сравнению с «коротко спящими» крысами, у которых предрасположенность к алкогольной зависимости высокая [5, 10].
Базовый уровень алкогольной мотивации животных представляет собой вероятность реализации большого числа факторов, в том числе генетических, которые в значительной степени влияют на индивидуальную чувствительность организма, в том числе от нейрохимического паттерна центральной нервной системы. Мы использовали метод определения алкогольной мотивации на основе установления уровня общей неспецифической реактивности организма (УНРО), который рассматривается нами в качестве интегративного генетически обусловленного показателя, отражающего общую чувствительность организма к различным экзогенным воздействиям.
Наиболее подходящим для разделения крыс по методу УОНРО оказался метод, который основан на определении болевого (ноцицептивного) электробаланса чувствительности посредством дозированного воздействия [10]. На основании полученных результатов тестирования установлено, что порог вокализации (среднее значение) в группе «долго спящих» крыс составил 27,3 ± 0,9 В и был значительно выше, чем в группе «коротко спящих» крыс, у которых данный показатель составил 16,9 ± 1,4 В (р<0,05). Таким образом, «коротко спящие» крысы потенциально склонны к употреблению этанола, они характеризовались большей чувствительностью к действию электроболевого воздействия (высокий уровень УОНРО).
Вскрытия животных были произведены после эвтаназии под эфирным наркозом, внутренние органы были исследованы для выявления патологических изменений. После вскрытия черепа извлекали головной мозг, материал быстро помещали в 10%-ный забуференный раствор формалина и фиксировали в течение 48 часов, затем образцы тканей обезвоживали и заливали в парафиновые блоки, из которых были приготовлены срезы толщиной 4 мкм. Срезы окрашивали гематоксилином, эозином, с использованием тионина по методу Ниссля, а также импрегнировали нитратом серебра в соответствии с хорошо разработанными и описанными ранее методами [11, 12].
Для проведения иммуногистохимического исследования изготавливали парафиновые срезы толщиной 4 мкм, которые помещали на адгезивные стекла и инкубировали во влажной камере с первичными моноклональными антителами против тирозингидроксилазы (NCL-L-TH, Novocastra, Великобритания) в разведении 1:40 при комнатной температуре в течение 30 минут, использовали полимерную визуализирующую систему, рекомендованную в соответствии с протоколом фирмы-производителя [13, 14]. По завершении проведения иммуногиcтохимичеcкой реакции для лучшей визуализации ядер в нервных клетках головного мозга производили докраcку гематоксилином [14].
Фотодокументирование производили с использованием цифровой фотокамеры Canon (Japan) с применением светового микроскопа Axiostar plus (Карл Цейc, Германия) c объективами х10, х40, х100.
Результаты исследования. При морфологическом исследовании крыс, склонных к формированию алкогольной зависимости, в супраоптическом ядре (СОЯ) обнаружены крупные мультиполярные нейроны, а также единичные клетки средних размеров. Форма перикариона нейрона, как правило, была полигональной или близка к овальной. Расположение нейронов достаточно плотное. При окраске по Нисслю хорошо визуализировались ядра нейронов, расположенные в центральной области перикариона нейрона, они имели округлую форму, пузырьковидный светлый вид, реже обнаруживались нейроны с ядрами овальной формы. Ядрышко, как правило, выражено, расположено в центральной части ядра, в некоторых случаях имеет эксцентричное расположение. В отдельных нейронах отмечались эктопированные ядрышки, прилежащие к ядерной оболочке. Цитоплазма перикарионов большинства нейронов характеризовалась умеренной базофилией (рис. 1).
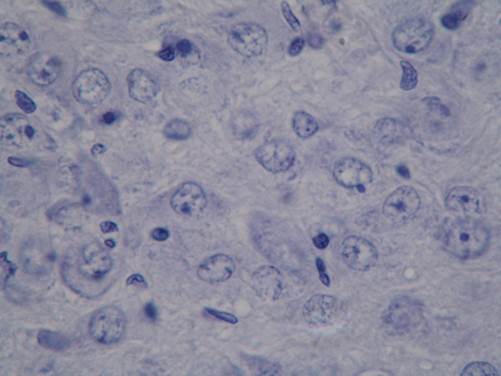
Рис. 1. Супраоптическое ядро гипоталамуса крысы, склонной к формированию алкогольной зависимости, крупные мультиполярные нейроны, а также единичные клетки средних размеров. Компактное расположение нейронов с полигональной формой перикарионов центральным пузырьковидным ядром. Окраска тионином по Нисслю. Ув. Х 1000
Вещество Ниссля образовано очень мелкими базофильными гранулами, которые были равномерно распределены по цитоплазме перикарионов нейронов, как правило, с образованием небольшой светлой перинуклеарной зоны. На импрегнированных нитратом серебра срезах большинство перикарионов нейронов имели умеренную степень аргирофилии. В нейропиле обнаружены хорошо развитые дендриты нейронов супраоптического ядра, образующие плотную сеть. Среди нейроглиальных клеток астроциты являются преобладающим типом. Их количество было несколько более высоким по периферии супраоптического ядра, где также были обнаружены единичные микроглиоциты.
У крыс, не склонных к формированию алкогольной зависимости, СОЯ представлено плотно расположенными крупными мультиполярными нейронами. В пространственном отношении СОЯ сохраняет овоидную форму. При детальном исследовании расположения нейронов внутри СОЯ отмечена некоторая их кластеризация, которая выражается в наличии более плотных скоплений нейронов в центральной части ядра. При окраске по Нисслю в СОЯ достаточно хорошо визуализируются перикарионы нейронов, которые имеют форму, близкую к овальной, и полигональные очертания. В центральной части клетки, как правило, выявляется крупное округлое светлое ядро с хорошо выраженным центрально расположенным ядрышком. В некоторых ядрах ядрышко расположено эксцентрично. В цитоплазме перикарионов большинства нейронов отмечаются равномерно распределенные интенсивно базофильные мелкие гранулы вещества Ниссля, распространяющиеся в начальные отделы дендритов и образующие вокруг ядра более светлую зону (рис. 2).
В ростральных отделах СОЯ у крыс, не склонных к формированию алкогольной зависимости, обнаружены некоторые нейроны с более вытянутой овальной веретеновидной формой перикариона. В таких нейронах центрально расположенное ядро, как правило, имело овальную или, реже, округлую форму. Ядрышко часто не визуализировалось. Встречались отдельные веретеновидные нейроны с гиперхромной цитоплазмой перикариона, в которой сохранялись зоны с умеренной базофилией. При исследовании срезов при импрегнации азотнокислым серебром большинство перикарионов нейронов имели умеренную степень аргирофилии, однако отмечалась меньшая плотность окрашенных нервных волокон в нейропиле.
При проведении иммуногистохимического исследования с использованием антител против тирозингидроксилазы было отмечено высокое содержание иммунореактивного материала в нейропиле СОЯ, в мелких нервных терминалях и волокнах, расположенных вблизи перикарионов нейронов.
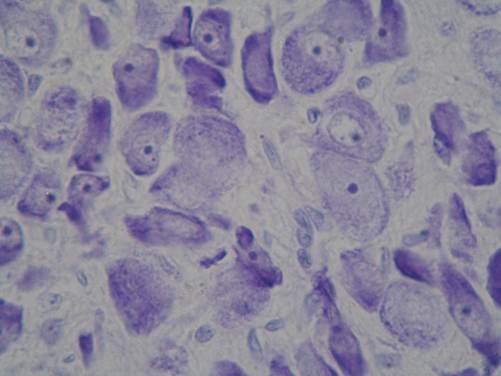
Рис. 2. Супраоптическое ядро гипоталамуса крысы, не склонной к формированию алкогольной зависимости. Плотно расположенные крупные мультиполярные нейроны, очаговый гиперхроматоз цитоплазмы перикарионов большинства нейронов. Окраска тионином по Нисслю. Ув. х1000
При проведении морфометрического исследования определено, что средний объем перикарионов нейронов СОЯ в группе животных, у которых была выявлена склонность к алкоголизации, составляет 2811,7 ± 51,4 мкм3, что на 27,8% ниже по сравнению с крысами, не склонными к формированию алкогольной зависимости, у которых данный морфометрический показатель составил 3894,3 ± 62,2 мкм3 (при р<0,05).
При исследовании среднего объема ядер нейронов СОЯ в группе животных, у которых была выявлена склонность к алкоголизации, значение данного параметра составило 480,7 ± 7,2 мкм3, что на 25,2% ниже аналогичного параметра у крыс, не склонных к формированию алкогольной зависимости, у которых данный морфометрический показатель составил 601,8 ± 9,1 мкм3 (р<0,05).
Кроме того, при изучении стереометрических параметров обнаружено, что объемная плотность перикарионов нейронов в СОЯ в группе животных, у которых не была выявлена склонность к алкоголизации, составила 69,3±2,7%, что на 33,8% выше объемной плотности перикарионов нейронов данного ядра в группе крыс, склонных к формированию алкогольной зависимости, которая составила 51,8 ± 1,9% (при p<0,05) (рис. 1, 2). Напротив, объемная плотность нейропиля СОЯ в группе животных, у которых не была выявлена склонность к алкоголизации, составила 30,7 ± 2,7%, что ниже соответствующего показателя в группе крыс, склонных к формированию алкогольной зависимости, который составляет 48,2 ± 1,9% (при p<0,05).
Обсуждение полученных данных. Исследование структурных изменений головного мозга, лежащих в основе аддиктивного поведения с употреблением алкоголя, является актуальной задачей современной медицины, решение которой поможет приблизиться к пониманию социальных проблем современного общества. При рассмотрении вопросов нейромедиаторного обмена и нейрохимического взаимодействия различных нейротрансмиттеров, нейромедиаторов и нейромодуляторов с учетом количества нейронов только лишь в одном гипоталамическом ядре приходится признать, что задача определения пространственно-временного состояния одного нейрона при хроническом алкоголизме не может решаться без учета его связей и микроокружения. Различные типы синапсов с учетом палитры их нейромедиаторов могут оказывать как синергичное, так и антагонистичное влияние на одни и те же гипоталамические нейроны [6]. Отмечены нарушения в работе дофаминергической системы, которые взаимосвязаны с работой глутаматергических нейронов. Это явление особенно важно, поскольку известно, что, помимо основной роли возбуждающего нейротрансмиттера, глутамат в избыточных концентрациях может проявлять нейротоксические свойства посредством стимуляции различных подтипов рецепторов [2]. При моделировании хронического алкоголизма было выявлено снижение экспрессии метаболических глутаматных рецепторов в головном мозгу животных [15]. Однако реализация механизма эксайтотоксичности при стимуляции глутаматных рецепторов и гиперактивации глутаматергической передачи включает интенсивный внутриклеточный вход ионов кальция, запускающий каскад биохимических процессов, способствующих развитию процессов обратимого и необратимого повреждения нейронов, в том числе посредством образования активных форм кислорода и активации протеинкиназ. В настоящее время эксайтотоксичность рассматривается как механизм запуска глутаматиндуцированной запрограммированной гибели нейронов, при которой дофамин оказывает нейропротекторное действие [8].
Заключение. Таким образом, в головном мозгу крыс, предрасположенных к алкогольной зависимости, определяются морфофункциональные отличия в переднем отделе гипоталамуса, которые выражаются в различиях структурной организации на тканевом, клеточном и молекулярном уровнях, в том числе достоверно меньшей объемной плотностью перикарионов нейронов супраоптического ядра по сравнению с животными, не склонными к алкоголизации.
При иммуногистохимическом исследовании с использованием первичных антител против тирозингидроксилазы обнаружена более низкая степень экспрессии иммунореактивного материала в перикарионах нейронов и в нейропиле супраоптических ядер гипоталамуса крыс, склонных к формированию алкогольной зависимости, что свидетельствует о наличии иммунофенотипических различий и метаболизма катехоламинов в нейронах ядер переднего гипоталамуса.
Библиографическая ссылка
Гуров Д.Ю., Туманов В.П., Смирнов А.В., Быхалов Л.С., Сидоров Д.Н., Седых А.Д., Финагеев С.А. МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ НЕЙРОНОВ СУПРАОПТИЧЕСКИХ ЯДЕР ГИПОТАЛАМУСА КРЫС, ПРЕДРАСПОЛОЖЕННЫХ К АЛКОГОЛЬНОЙ ЗАВИСИМОСТИ // Современные проблемы науки и образования. 2019. № 2. ;URL: https://science-education.ru/ru/article/view?id=28750 (дата обращения: 04.03.2026).



