Во всем мире рак предстательной железы (РПЖ) занимает лидирующие позиции в структуре онкологической патологии. В России рост заболеваемости за 10 лет превысил 140%, а смертности – 45%, это самые высокие значения среди всей онкологической патологии [1]. Устойчивый рост данных показателей делает как никогда актуальной задачу разработки новых методологических подходов к лечению данной патологии. Лучевая терапия является одним из основных методов лечения РПЖ. Облучение используется главным образом у пациентов с локализованными или местно-распространенными формами рака с противопоказаниями для хирургического вмешательства [2]. Радиобиологически обоснованное использование гипофракционных режимов позволило улучшить результаты лечения, существенно уменьшив его продолжительность, при низких уровнях лучевых реакций.
В настоящее время известны основные механизмы, определяющие чувствительность к ионизирующему облучению, это факторы, влияющие на репарацию ДНК: воздействие активных форм кислорода, эпителиально-мезенхимальный переход, экспрессия белка теплового шока (HSP90) и др. [3]. Однако неудачи при радиотерапии РПЖ ставят задачу выявления и прогнозирования радиорезистентности. Для ее решения необходимы модельные эксперименты на соответствующих клеточных культурах, первым этапом которых является оценка влияния лучевой терапии на выживаемость опухолевых клеток.
Целью данной работы явилось изучение воздействия доз облучения 6,4 и 7,25 Гр на протяжении 5 дней на выживаемость опухолевых клеток предстательной железы линии PC-3.
Материалы и методы исследования. В работе использовали культуру клеток человека – рака предстательной железы PC-3. В процессе культивирования проводили генотипирование клеток с помощью набора реактивов COrDIS Sprint («Гордиз», Россия) и реал-тайм амплификатора на соответствие типичному для данной клеточной линии генотипу (на основании данных ATCC [4]) и на отсутствие контаминации. Все работы с клеточной линией проводили в ламинарном шкафу II степени биологической защиты стерильного бокса лаборатории культуры клеток. Клетки культивировали в стерильных плоскодонных культуральных флаконах площадью 25 см2 с адгезионной поверхностью и вентилируемыми крышками (Sarstedt, Германия). Инкубирование осуществляли в условиях контролируемого 5% CO2 и влажности 95% при температуре 37 градусов по Цельсию в мультигазовом инкубаторе CB 150 (Binder, Германия), в среде RPMI-1640 (Биолот, Россия) c 10%-ной фетальной телячьей сывороткой (Thermo Scientific hyclone, США) в присутствие 50 мкг/мл гентамицина (Биолот, Россия) [5, 6].
Для эксперимента были выбраны следующие варианты фракционирования: 6,4 и 7,25 Гр. Облучение проводили ежедневно на протяжении 5 дней, что было обусловлено техническими особенностями исследования. Итоговая изоэффективная суммарная очаговая доза для первого варианта составила 77,4 Гр, что соответствует как российским, так и международным рекомендациям по проведению дистанционной лучевой терапии (как в конвенциональном, так и в гипофракционном режиме) больным локализованным и местно-распространенным раком предстательной железы. Второй вариант воспроизводил в эксперименте влияние на опухолевые клетки стереотаксической радиотерапии. Итоговая изоэффективная доза в этом случае составила 97,6 Гр. Облучение проводили на линейном ускорителе Novalis TX (Varian, США). Для топометрии был использован компьютерный томограф Somatom Definition AS Siemens (Германия), этап сегментирования и планирования выполнен с помощью программного обеспечения Eclips (Varian, США).
Ежедневно через 1 час после облучения во всех флаконах (3 контрольных флакона, 3 для дозы 6,4 Гр и 3 для дозы 7,25 Гр) заменяли питательную среду и проводили подсчет мертвых клеток, находившихся в заменяемой среде. После 1-го, 2-го, 3-го, 4-го и 5-го дня облучения проводили микроскопирование монослойной культуры с помощью инвертированного микроскопа DM IL LED Fluo (Leica, Германия) и цифровой камеры DFC365FX (Leica, Германия). Подсчет общего количества клеток и анализ соотношения живых и мертвых клеток проводили в камере Горяева с использованием 0,4%-ного раствора красителя трипанового синего. После микроскопирования на 5-й день облучения клеточную линию снимали с подложки флакона путем трипсинизации раствором Трипсин/Версена (Биолот, Россия). Далее оценку количества клеток, находящихся на различных стадиях апоптоза, осуществляли на проточном цитофлюориметре FacsCantoII (BD, USA) с использованием Annexin V-FITC Apoptosis Detection Kit (BD Pharminogen, USA).
Annexin V-FITC используется для определения процентной доли клеток, подвергшихся апоптозу. Это основано на свойстве клеток терять асимметричность мембраны на ранних стадиях апоптоза. В апоптотических клетках мембранный фосфолипид фосфатидилсерин (PS) транслоцируется с внутренней стороны плазматической мембраны на ее внешнюю сторону. Annexin V, это Са2+-зависимый фосфолипид-связывающий протеин, имеющий высокую аффинность к PS, связывается с клетками, экспрессирующими PS. Пропидиум йодид (PI) – стандартный витальный краситель, использующийся в проточной цитометрии для разделения живых и погибших клеток. Живые клетки с интактной мембраной не включают PI, тогда как мембрана погибших или поврежденных клеток проницаема для PI. Клетки, позитивные по Annexin V и негативные по PI, являются апоптотическими. Клетки, позитивные по Annexin V и PI, находятся на поздней стадии апоптоза, либо подверглись некрозу, либо уже погибли. Клетки, негативные по Annexin V и PI, – живые, не подвергшиеся апоптозу. 7-амино-актиномицин D (7-AAD) представляет собой краситель нуклеиновой кислоты, который можно использовать вместо пропидия йодида (PI) для исключения нежизнеспособных клеток в анализах проточной цитометрии.
Статистический анализ выполняли с использованием прикладного пакета программ STATISTICA 8.0. Оценку различий проводили с использованием параметрического t-критерия Стьюдента для порогового уровня статистической значимости р<0,05.
Результаты исследования и их обсуждение
В ходе 5-дневного эксперимента по облучению опухолевых клеток предстательной железы были получены данные, характеризующие потенциал дистанционной лучевой терапии и стереотаксической радиотерапии.
В 1-й день облучения независимо от дозы не было обнаружено статистически значимых отличий в количестве мертвых клеток в питательной среде. На 2-й день облучения относительно контроля статистически значимо (р<0,05) в 7 раз увеличилось количество мертвых клеток при дозе 7,25 Гр, на 3-й день – в 12 раз и 7,3 раза при дозах 6,4 Гр и 7,25 Гр соответственно, на 4-й день – в 4 и 7 раз при дозах 6,4 Гр и 7,25 Гр соответственно (рис. 1).
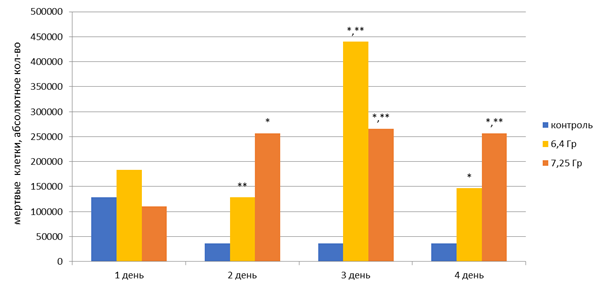
Рис. 1. Динамика показателя мертвых клеток PC-3 в эксперименте с накопительной дозой облучения (в питательной среде):
*– статистически значимые отличия (р<0,05) относительно контроля,
** – статистически значимые отличия (р<0,05) относительно 1-го дня облучения
Следует отметить, что количество мертвых клеток в питательной среде в контрольных флаконах не изменялось на протяжении эксперимента. При этом на 2-й день облучения зарегистрировано статистически значимое (р<0,05) снижение количества мертвых клеток в 1,4 раза при дозе облучения 6,4 Гр, на 3-й день отмечалось увеличение количества мертвых клеток в 2,4 раза при дозах 6,4 Гр и 7,25 Гр соответственно, и на 4-й день – в 2,3 раза при дозе 7,25 Гр относительно 1-го дня эксперимента (рис. 1). Следовательно, значимый эффект облучения на клетки PC-3 для дозы 7,25 Гр проявляется на 2-й день облучения, а для дозы 6,4 Гр – на 3-й день.
Результаты исследования влияния выбранных режимов облучения на культуру клеток РС-3 после 5-дневного облучения представлены на рисунке 2.
Ежедневное облучение на линейном ускорителе Novalis TX культуры клеток PC-3 в дозах 6,4 и 7,25 Гр в течение 5 дней привело к значительному снижению общего количества клеток на 71,6 и 71,4% соответственно (р<0,05) (рис. 2).
В таблице 1 и на рисунках 3, 4 и 5 представлены данные о распределении клеток PC-3 по разным стадиям апоптоза, полученные на проточном цитофлюориметре.


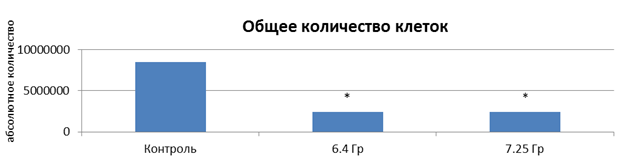
Рис. 2. Микрофотография клеточного монослоя после 5-го дня облучения (слева направо: контроль – доза 6,4 Гр – доза 7,25 Гр) и общее количество клеток: * – статистически значимые отличия (р<0,05) относительно контроля
Из представленных в таблице 1 и на рисунках 3, 4 и 5 результатов видно, что в контроле доля живых клеток составила 92,4±0,4%, одновременно с этим в данных образцах присутствовали и клетки, находящиеся на разных стадиях гибели: ранний апоптоз, поздний апоптоз/некроз, мертвые клетки (соответственно 0,7±0,17%, 7,1±0,44%, 0,1±0,0%).
После облучения культуры РС-3 в дозе 6,4 Гр наблюдали изменение соотношений клеток, находящихся на разных стадиях апоптоза. Закономерно наблюдается снижение процента живых клеток до 57,6±6,5%, что меньше в 1,6 раза по сравнению с контролем (р=0,0008). При этом доля клеток, находящихся на раннем апоптозе, увеличивалась до 3,2±0,6%, что выше контрольных значений в 4,5 раза (р=0,002, табл. 1).
Доля клеток, находящихся на поздних стадиях апоптоза (некроза), и мертвых клеток после облучения достигала значений соответственно 37,57±5,32% и 1,67±0,67%, что в 5,3 (р=0,001) и в 16,7 (р=0,02) раза выше контрольных.
Таблица 1
Оценка уровня апоптоза в культуре клеток PC-3 после различных режимов облучения в течение 5 дней (процентное содержание клеток разного функционального состояния)
|
Живые клетки Ann V- PI- |
Ранний апоптоз Ann V+ PI- |
Поздний апоптоз/ некроз Ann V+PI+ |
Мёртвые клетки Ann V- PI+ |
Мёртвые клетки по 7AAD |
|
|
Контроль, n=3 |
92,4±0,4 |
0,7±0,17 |
7,1±0,44 |
0,1±0,0 |
7,4±0,36 |
|
6,4 Гр |
57,6±6,5 |
3,2±0,6 |
37,57±5,32 |
1,67±0,67 |
33,67±1,25 |
|
% отличия от контроля |
–38 |
+357 |
+429 |
+1570 |
+355 |
|
р=0,0008 |
р=0,002 |
р=0,001 |
р=0,02 |
р=0,00004 |
|
|
7,25 Гр |
46,2±10,8 |
4,47±1,25 |
45,6±9,92 |
3,67±2,1 |
41,7±10,13 |
|
% отличия от контроля |
–50 |
+539 |
+542 |
+3570 |
+464 |
|
Р=0,0018 |
Р=0,0067 |
Р=0,003 |
Р=0,04 |
Р=0,004 |
|
|
% отличия от 6,4 Гр |
–26 |
+40 |
+21 |
+120 |
+24 |
Увеличение дозы облучения до 7,25 Гр приводило к еще большим изменениям соотношения клеток, находящихся на разных стадиях апоптоза. По сравнению с контролем количество живых клеток уменьшилось в 2 раза (р<0,05) и достигло 46,2±10,8%, что также ниже в 1,2 раза (р<0,05) значений после облучения в дозе 6,4 Гр. Процент клеток, находящихся в стадии раннего апоптоза, превысил значения контроля в 6,4 раза (р<0,05) и достиг значений 4,47±1,25%, что также выше данного показателя по сравнению с уровнем облучения 6,4 Гр в 1,4 раза (р<0,05). Доля клеток, находящихся на поздних стадиях апоптоза (некроза), и мертвых клеток после облучения клеток данной культуры достигала значений соответственно 45,6±9,92% (больше в 6,4 раза (р<0,05) контрольных значений и в 1,2 раза (р<0,05) уровня при облучении 6,4 Гр) и 3,67±2,1% (больше в 36,7 раза (р<0,05) контрольных значений и в 2,2 раза (р<0,05) уровня при облучении 6,4 Гр) (табл. 1, рис. 3–5).

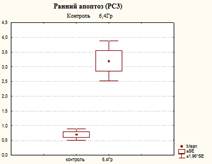

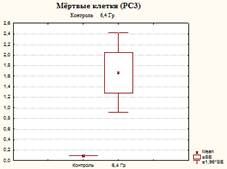
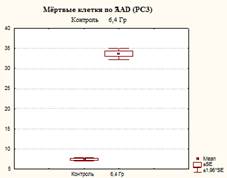
Рис. 3. Оценка уровня апоптоза в культуре клеток PC-3 после ежедневного облучения в дозе 6,4 Гр в течение 5 дней

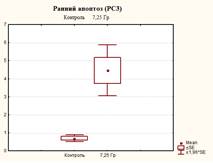
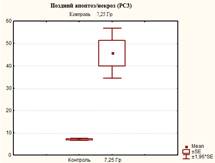


Рис. 4. Оценка уровня апоптоза в культуре клеток PC-3 после ежедневного облучения в дозе 7,25 Гр в течение 5 дней
Таким образом, продемонстрировано, что воздействие различных доз ионизирующего излучения in vitro на опухолевые клетки предстательной железы приводит к значительной их элиминации. Фундаментальным механизмом, посредством которого ионизирующее излучение производит терапевтический эффект, является инициирование повреждения ДНК в опухолевых клетках, в особенности двухцепочечных разрывов (DSB) [7]. Из данных литературы известно, что дозы однократного облучения от 4 Гр до 8 Гр вызывают кратковременную задержку клеточного цикла в фазе G2/M с максимальным эффектом примерно через 16 часов после облучения [8]. Однако опухолевые клетки способны использовать системы репарации DSB для преодоления индуцированной радиацией цитотоксичности [9], которая контрпродуктивна для терапии. В результате может развиться радиорезистентность.
|
PC3. Контроль |
|
|
|
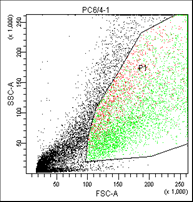
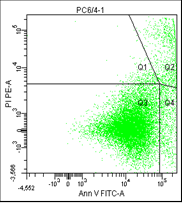
РС3. Облучение 6,4 |
|
|
|
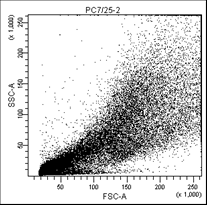
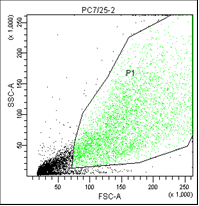
РС3. Облучение 7,25 |
|
|
Слева направо:
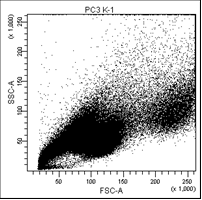
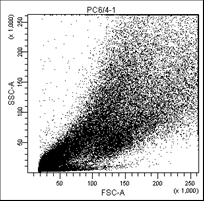
На первом графике показаны клетки в зависимости от их размера и гранулярности, неокрашенные.
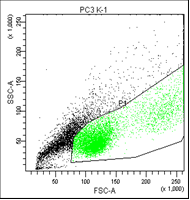
На втором графике выделены опухолевые клетки, без учета дебриса (неживых клеток).
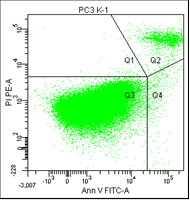
На третьем графике – расположение опухолевых клеток, окрашенных пропидием и аннексином.
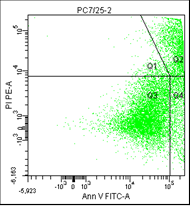
• Q1 – клетки, окрашенные только пропидием, мертвые клетки.
• Q2 – клетки с окраской пропидия и аннексина, это поздний апоптоз/некроз.
• Q3 – живые клетки, на них не садится ни аннексин, ни пропидий.
• Q4 – клетки, окрашенные только аннексином, ранний апоптоз.
Рис. 5. Результаты оценки уровня апоптоза клеток культур РС-3 после облучения различными режимами в течение 5 дней (данные проточного цитофлюориметра)
Другие сигнальные пути, не являющиеся частью репарационных систем клетки, также могут влиять на реакцию опухолевых клеток простаты на излучение [10]. В нашем эксперименте после 5-дневного облучения около 50% от оставшихся опухолевых клеток (15% от изначального количества) все же сохраняют жизнеспособность. Связан ли этот факт с развитием радиорезистентности благодаря определенным молекулярно-генетическим особенностям этих клеток, предстоит установить в дальнейших исследованиях. Важно отметить, что для проецирования данной экспериментальной модели на целостный организм необходимо учитывать другие факторы, такие как активность иммунной системы [11] и особенности микроокружения опухоли, включая интенсивность ангиогенеза [12, 13]. Однако все же, если in vivo сохраняется данный эффект, то оставшиеся опухолевые клетки в последующем, вероятно, рецидивируют и будут более устойчивы к радиотерапии.
Заключение. Проведенное исследование позволило установить, что ежедневное облучение на линейном ускорителе Novalis TX культуры клеток PC-3 в дозах 6,4 и 7,25 Гр в течение 5 дней привело к значительному снижению как общего количества клеток, так и количества жизнеспособных клеток (возросло количество опухолевых клеток, находящихся на разных стадиях апоптоза, и мертвых клеток). При этом эффект от облучения в дозе 7,25 Гр проявился раньше (после 2-го дня облучения) и в конечном итоге после 5-го дня облучения был выражен сильнее, чем от облучения в дозе 6,4 Гр. Тем не менее после 5-дневного облучения около 50% от оставшихся опухолевых клеток (15% от изначального количества) предстательной железы линии PC-3 сохранили свою жизнеспособность, что может быть связано с развитием или исходным наличием у части клеток радиорезистентности.
Библиографическая ссылка
Кутилин Д.С., Сагакянц А.Б., Зинькович М.С., Максимов А.Ю., Гусарева М.А., Бондаренко Е.С., Потемкин Д.С., Васильченко Н.Г. ВЛИЯНИЕ РАЗЛИЧНЫХ ДОЗ ЛУЧЕВОЙ ТЕРАПИИ НА ВЫЖИВАЕМОСТЬ ОПУХОЛЕВЫХ КЛЕТОК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ ЛИНИИ PC-3 // Современные проблемы науки и образования. 2019. № 2. ;URL: https://science-education.ru/ru/article/view?id=28740 (дата обращения: 07.02.2026).
DOI: https://doi.org/10.17513/spno.28740