Рак молочной железы (РМЖ) составляет 25% от всех онкологических заболеваний в мире и занимает лидирующее место по показателю смертности у женщин [1]. В России в популяции женщин РМЖ по частоте встречаемости занимает первое место в возрастной группе 40–85 лет и второе (после рака шейки матки) в возрастной группе 15–39 лет среди онкологических заболеваний [2].
В клинической практике основная терапия гормонпозитивного РМЖ прежде всего направлена на коррекцию гормонального статуса с целью снижения риска метастатического поражения и может включать разные направления, такие как применение агонистов гонадотропин-рилизинг-гормона [3], подавление функций яичников путем хирургической кастрации или лучевой абляции либо сочетанием кастрации с применением ароматазы [4]. Известно, что хирургический способ лечения гормонпозитивного РМЖ приводит к развитию хирургической менопаузы, которая в отличие от менопаузы при естественном старении, когда угасание функции яичников происходит постепенно [5], в 70% случаев характеризуется тяжелой соматической и психической формой протекания и развитием постовариоэктомического синдрома [6]. Одной из проблем в коррекции постовариоэктомического синдрома у женщин с гормонпозитивным РМЖ является низкая эффективность гормонотерапии, применяемой при естественной менопаузе [7], другой – их репродуктивный возраст, социальный и профессиональный статус.
Как правило, удаление молочной железы становится трудноразрешимым психотравмирующим воздействием, приводящим к глубокой деформации личности, значительно ухудшая качество жизни и межличностные взаимоотношения. Помимо физических страданий, психологических и социальных расстройств по поводу удаления молочной железы, на этапе хирургического лечения (пангистероэктомии) женщины испытывают тяжелый стресс, связанный с последующей кастрацией, а, следовательно, с утратой репродуктивных функций. В соответствии с этим признается необходимость внедрения квалифицированной психологической помощи онкобольным и членам их семей (приказ Минздрава России от 15.11.2012 № 915н (с изменениями от 23.08.2016) «Об утверждении Порядка оказания медицинской помощи взрослому населению по профилю «онкология» (Зарегистрировано в Минюсте России 17.04.2013 № 28163)).
Учитывая, что терапия гормонпозитивного РМЖ отягощена необратимыми изменениями на уровне всех систем организма, в том числе и в психоэмоциональной сфере, актуальной является разработка комплексного подхода к коррекции функциональных, компенсаторных и психоэмоциональных изменений у женщин с РМЖ на всех этапах лечения. В этом отношении перспективным является применение инертного газа ксенон, оказывающего не только седативное, но и нейропротекторное, кардиопротекторное [8], иммуномодулирующее, гормономодулирующее и антидепрессивное действие [9] на организм.
Поскольку у женщин репродуктивного возраста с диагнозом «гормонпозитивный РМЖ» уже в первые 2–3 недели после хирургического вмешательства могут развиваться нейровегетативные и психоэмоциональные нарушения, то целью настоящего исследования являлось изучение влияния малых доз ксенона на биоэлектрические и психоэмоциональные показатели центральной нервной системы у этих пациенток в раннем послеоперационном периоде.
Материалы и методы исследования
В исследовании приняли участие 32 женщины репродуктивного возраста (36,4±0,5 года) с диагнозом «гормонпозитивный РМЖ (С50)», находившиеся на лечении в ФГБУ «РНИОИ» МЗ РФ в период 2016–2017 гг. У всех пациенток по данным гистологического анализа была выявлена инфильтрирующая неспецифическая карцинома. В 1-ю группу вошли 16 женщин, госпитализированных в отделение «Опухоли костей, кожи, мягких тканей и молочной железы № 1» с целью выполнения оперативного лечения в объеме радикальной мастэктомии по Маддену. Степень распространенности процесса по классификации TNM соответствовала рT1-2N0-1М0. Во 2-ю группу были включены 16 женщин после радикальной мастэктомии по Маддену и комплексного лечения, госпитализированных в «Онкогинекологическое отделение» для хирургического лечения в объеме пангистерэктомии с учетом гинекологической патологии. Степень распространенности процесса по классификации TNM соответствовала pT2N0-3М0.
В 1-й и 2-г группах были отобраны по восемь человек, которым начиная с четвертых суток после операции в утренние часы дополнительно к основному лечению проводили сеансы ксенонтерапии (препарат КсеМед® (ксенон медицинский), РУ № ЛС-000121), использование которой в медицинской практике разрешено с 1999 г. (Приказ МЗ РФ № 363 от 08.10.1999, ООО Акела-Н (регистрационное удостоверение № 99/363/4). По противопоказаниям к применению ксенон-кислородных ингаляций в исследовании не принимали участие пациентки с сердечно-сосудистыми и дыхательными нарушениями, с нарушением мозгового кровообращения, с подозрением на внутричерепные опухоли, острые заболевания брюшной полости, а также с индивидуальной чувствительностью к препарату.
Сеансы ксенонтерапии проводились врачом-анестезиологом с использованием ксенонового терапевтического комплекса КТК–01. Подача ксенон-кислородной смеси осуществлялась через лицевую маску, при этом дыхание происходило по закрытому контуру (объем газового мешка – 4 литра). Курс ксенонтерапии составил 5 сеансов, проводимых через день согласно медицинским рекомендациям по применению ксенона для лечения невротических расстройств [8], а также коррекции гормонального статуса [9]. Каждый сеанс продолжался 15–20 минут, по его завершении выполнялась дополнительная оксигенация. Рекомендованное терапевтическое содержание ксенона в ксенон-кислородной смеси составляет 20%. Учитывая состояние онкологических пациенток, с целью снижения риска негативного ответа на терапию было применено постепенное повышение содержания ксенона на 2–4%, начиная с малых доз: 1-й сеанс: 10–12%, 2-й сеанс: 12–16%, 3-й сеанс: 16–18%, 4-й сеанс: 18–20%, 5-й сеанс: 20–22%.
Для диагностики постовариоэктомического синдрома был использован менопаузальный индекс Куппермана в модификации Е.В. Уваровой. Регистрацию ЭЭГ и оценку психоэмоционального статуса с помощью 8-цветового теста Люшера и опросника Гаркави с соавт. [10] проводили в три этапа: до операции, на четвертые сутки после операции и после завершения лечения (на день выписки).
ЭЭГ обследование осуществлялось в утренние часы, в затемненной комнате на электроэнцефалографе-регистраторе «Энцефалан ЭЭГР-19/26». Регистрировали 19 монополярных отведений, расположенных по международной системе 10x20. С помощью преобразования Фурье рассчитывалась спектральная мощность ЭЭГ спокойного бодрствования с закрытыми глазами в диапазоне частот 0,5–18,0 Гц на 30 секундах фрагментов записи.
Статистический анализ спектральной мощности ЭЭГ проводился с помощью программных средств Statistica 10.0 («StatSoft», США).
Исследование выполнено с соблюдением этических принципов проведения медицинских исследований с участием человека в качестве субъекта (Декларация Хельсинки, Финляндия, 1964).
Результаты исследования и их обсуждение
Оценка психоэмоционального статуса у пациенток 1-й группы на четвертые сутки после мастэкомии у 80% пациенток показала повышенную утомляемость и низкую работоспособность, у 60% – нарушения сна и у 50% – плохой аппетит. На ЭЭГ установлено снижение мощности дельта-, тета-, альфа- и бета-ритмов, а именно в диапазонах частот: 2,7 Гц, 2,9 Гц, 4,7 Гц, 4,9 Гц, 5,1 Гц, 6,1 Гц, 6,4 Гц, 8,6 Гц, 10,5 Гц, 10,8 Гц, 14,2 Гц, 14,7 Гц (критерий Стьюдента, с поправкой Бонферони достоверные различия при p≤0,017) (рис. 1А, 1В).
У 75% пациенток 1-й группы без сопроводительной ксенонтерапии на момент выписки отмечали низкую работоспособность, у 57% – повышенную утомляемость, у 16,7% – тревожность и агрессивность, у 20% – угнетенность, у 25% – нарушения сна и у 10% – снижение аппетита. На ЭЭГ в сравнении с показателями мощности после операции установлены снижение мощности в частоте дельта-ритма 1,2 Гц и ее прирост в диапазонах частот дельта-, тета-, альфа-ритмов: 2,9 Гц, 6,4 Гц, 8,6 Гц, 8,8 Гц, 9,1 Гц (p≤0,017). В сравнении со спектральной мощностью ЭЭГ до операции после завершения терапии установлены снижение мощности в диапазонах 4,7 Гц, 6,1 Гц, 7,3 Гц тета-ритма и 10,5 Гц, 10,8 Гц, 11,5 Гц альфа-ритма и ее прирост в диапазоне 5,6 Гц тета-ритма и 9,1 Гц, 12,5 Гц альфа-ритма (p≤0,017). Полученные результаты представлены на рисунке 1А.
У пациенток 1-й группы с сопроводительной ксенонтерапией после ее завершения были отмечены позитивная жизненная позиция, отсутствие жалоб на утомляемость, перемену настроения, плохой сон и отсутствие аппетита. На ЭЭГ в сравнении с данными после операции наблюдались прирост мощности дельта-, тета- и альфа-ритмов, а именно в диапазонах частот 1,5 Гц, 2,2 Гц, 2,7 Гц, 2,9 Гц, 3,9 Гц, 4,9 Гц, 5,1 Гц, 9,6 Гц, 9,8 Гц, 10,5 Гц, 12,0 Гц, 12,3 Гц, 12,7 Гц, и ее снижение в частотах 8,8 и 9,1 Гц альфа-ритма (p≤0,017). По сравнению со спектральной мощностью ЭЭГ до операции в этой группе после ксенонтерапии установлены прирост мощности в диапазонах частот дельта-, тета-, альфа-ритмов: 1,5 Гц, 2,0 Гц, 2,2 Гц, 5,4 Гц, 8,3 Гц, 9,8 Гц, 10,3 Гц, 11,0 Гц, 11,3 Гц, 11,5 Гц, 12,3 Гц, 12,5 Гц и ее снижение в следующих частотах дельта-, тета- и альфа-ритмов: 3,2 Гц, 3,9 Гц, 6,1 Гц, 6,4 Гц, 8,6 Гц, 8,8 Гц, 9,1 Гц, 10,5 Гц, 10,8 Гц (p≤0,017). Полученные результаты представлены на рисунке 1В.
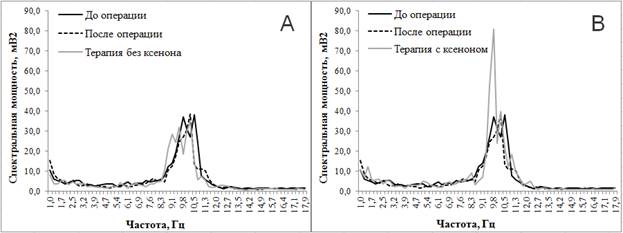
Рис. 1. Спектральная мощность ЭЭГ на разных этапах обследования у пациенток 1-й группы без (А) и с сопроводительной ксенонтерапией (В)
У всех пациенток 2-й группы на четвертые сутки после пангистерэктомии были выявлены ранневременные менопаузальные нейровегетативные и эмоциональные расстройства, обусловленные развитием постовариоэктомического синдрома. Наиболее частыми проявлениями нейровегетативного синдрома являлись: повышение артериального давления (у 62% пациенток), головные боли и головокружения (68%), потливость (42%), нарушения сна (58%). Согласно данным опроса все пациентки отмечали апатию и высокую утомляемость (100%), 80% – низкую работоспособность, 60% – пессимистичное отношение к жизни и высокую тревожность, 40% – агрессивность, 60% – нарушение сна и 25% – снижение аппетита. На ЭЭГ зарегистрированы прирост мощности в диапазоне частот 5,4 Гц тета-ритма и 11,3 Гц альфа-ритма, а также ее снижение в диапазоне 10,8 Гц альфа-ритма (рис. 2А, 2В).
У пациенток 2-й группы с постовариоэктомическим синдромом без сопроводительной ксенонтерапии после завершения лечения сохранились жалобы на повышение артериального давления (68%), головные боли и головокружения (48%), потливость (52%), нарушения сна (48%), 100% отмечали повышенную утомляемость, 94% – пессимистичное отношение к жизни, 75% – апатию, плохой сон и низкую работоспособность, 66% – агрессивность, 50% – угнетенность, 33% – тревожность. На ЭЭГ в сравнении с показателями ЭЭГ после операции отмечены снижение мощности в диапазонах частот 2,0 Гц, 2,2 Гц и 2,5 Гц дельта-ритма, 7,6 Гц и 7,8 Гц тета-ритма, 8,1 Гц, 8,3 Гц, 9,1 Гц, 9,3 Гц, 11,8 Гц, 12,3 Гц и 12,5 Гц альфа-ритма, а также ее прирост в диапазоне 10,8 Гц альфа-ритма (p≤0,017). В сравнении с показателями ЭЭГ до операции у этих пациенток после завершения лечения установлены снижение мощности в диапазонах частот 2,2 Гц дельта-ритма, 6,9 Гц и 7,8 Гц тета-ритма, 8,1 Гц , 8,3 Гц, 9,3 Гц, 10,0 Гц, 12,3 Гц и 12,5 Гц альфа-ритма и ее прирост в диапазоне 4,4 Гц тета-ритма (p≤0,017). Результаты анализа представлены на рисунке 2А.
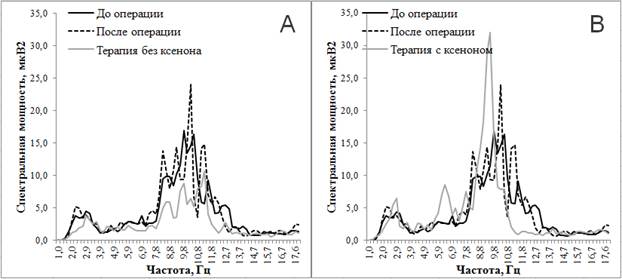
Рис. 2. Спектральная мощность ЭЭГ на разных этапах обследования у пациенток
2-й группы без (А) и с сопроводительной ксенонтерапией (В)
У пациенток 2-й группы с сопроводительной ксенонтерапией после ее завершения отсутствовали жалобы на нейровегетативные проявления постовариоэктомического синдрома, они отмечали активную жизненную позицию, жажду деятельности, оптимизм, отсутствие агрессивности, однако 50% опрошенных жаловались на тревожность, высокую утомляемость и нарушения сна. На ЭЭГ по сравнению с показателями ЭЭГ до операции после завершения ксенонтерапии установлены прирост мощности в диапазоне частот 2,9 Гц дельта-ритма, 6,1 Гц, 6,4 Гц, 6,6 Гц, 7,1 Гц, 7,8 Гц тета-ритма, 9,6 Гц альфа-ритма и ее снижение в диапазонах 11,5 Гц, 11,8 Гц, 12,3 Гц и 12,5 Гц альфа-ритма (p≤0,017).
По сравнению с мощностью ЭЭГ до операции после завершения ксенонтерапии у этих пациенток отмечен прирост мощности в диапазонах 6,1 Гц, 6,4 Гц, 6,6 Гц, 7,1 Гц, 7,6 Гц и 7,8 Гц тета-ритма, 9,1 Гц, 9,3 Гц и 9,6 Гц альфа-ритма (p≤0,017). Результаты представлены на рисунке 2 B.
Таким образом, в результате настоящего исследования установлено, что уже в первые дни после оперативного вмешательства пациентки с гормонпозитивным РМЖ подвержены высокому риску стремительного развития психоэмоциональных, психосоциальных и нейровегетативных расстройств. Эти данные согласуются с результатами исследований, проведенных в Европе и США, которые показали, что оперативные вмешательства при онкопатологии органов женской репродуктивной системы часто приводят к развитию у женщин психосоциальных расстройств, кризисных состояний, проявляющихся депрессией, тревогой, заниженной самооценкой, чувством безнадежности, пессимистичной оценкой будущего [11].
Применение малых доз ксенона в раннем послеоперационном периоде у пациенток с гормонпозитивным РМЖ позволило улучшить их психоэмоциональное и нейровегетативное состояние. При этом терапевтический эффект ксенона, улучшение психоэмоционального и нейровегетативного состояния достигались на фоне изменения параметров биоэлектрической активности. Согласно литературным данным [12] среди существующих подходов психологической реабилитации онкологических больных высокую эффективность показали именно психофизиологические методы, основанные на формировании у пациентов терапевтически целесообразного состояния сознания через изменение активности мозга либо на достижении психологической релаксации через физическое расслабление.
Заключение
Таким образом, использование малых доз ксенона после мастэктомии и пангистерэктомии позволило сформировать благоприятный психоэмоциональный фон, нивелировать патологические симптомы, что субъективно выражалось в нормализации сна, снижении тревоги, формировании активной жизненной позиции, а объективно – в изменении параметров биоэлектрической активности мозга. Следовательно, применение ксенонтерапии в раннем послеоперационном периоде является целесообразным для профилактики ранних проявлений постовариоэктомического синдрома и коррекции психоэмоциональных расстройств у женщин репродуктивного возраста с диагнозом «гормонпозитивный РМЖ».
Библиографическая ссылка
Попова Н.Н., Арапова Ю.Ю., Протасова Т.П., Шихлярова А.И., Ващенко Л.Н., Меньшенина А.П., Тихонова С.Н., Скопинцев А.М. ПРИМЕНЕНИЕ МАЛЫХ ДОЗ КСЕНОНА У ПАЦИЕНТОК С ГОРМОНПОЗИТИВНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ В РАННЕМ ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ // Современные проблемы науки и образования. 2019. № 2. ;URL: https://science-education.ru/ru/article/view?id=28687 (дата обращения: 07.02.2026).



