По данным Всемирной организации здравоохранения (ВОЗ) ожоги представляют глобальную проблему в области здравоохранения: по оценкам, в мире ежегодно происходит 180 000 случаев смерти от ожогов. Несмертельные ожоги являются одной из основных причин заболеваемости, включая длительную госпитализацию, обезображивание и инвалидность, часто сопровождаемые стигматизацией и неприятием [1]. Так, по данным 70 медицинских организаций, за медицинской помощью в течение года обратились более 60 тысяч человек с термической травмой, из них около 40 тысяч пациентов были госпитализированы в ожоговые центры, ожоговые отделения, отделения с выделенными для лечения ожогов койками. Среди госпитализированных взрослых пациентов у 6,1% больных травма закончилась летальным исходом [2]. Наиболее частой причиной смерти обожженных является инфекция, на долю которой, по данным отдельных авторов, приходится 76,3% в структуре летальности пострадавших от ожогов [3]. Помимо непосредственной опасности для жизни больного, длительное существование инфекции приводит к задержке процесса заживления ожоговых ран и способствует избыточному рубцеванию [4].
Этиология возбудителей при инфицированных ожогах, как правило, полимикробная, включающая Staphylococcus aureus, Enterobacteriaceae, Pseudomonas spp., Streptococcus pyogenes [5, 6]. Основными возбудителями инфекционных осложнений у обожженных в США являются метициллинчувствительные Staphylococcus aureus (MSSA) (19,6%), Enterococcus faecalis (12,5%), метициллинрезистентные Staphylococcus aureus (MRSA) (19,6%) [7]. В России значительную роль играют неферментирующие грамотрицательные бактерии (НГОБ) родов Pseudomonas и Acinetobacter (38%), а также Staphylococcus aureus (38,7%), среди которых доля MRSA достигает 62,2% [8].
Факторами риска летальности при ожогах являются неадекватная антимикробная терапия, либо адекватная, но начало которой отсрочено более чем на 24 часа; имеющиеся MRSA и метициллинрезистентные Staphylococcus epidermalis (MRSE) штаммы микроорганизмов; шок; возраст (дети до 10 лет и взрослые старше 60 лет); наличие сопутствующих заболеваний; несанированный первичный локус инфекции [9]. Таким образом, одной из основных составляющих лечения больных с термической травмой является адекватная антимикробная защита пациента.
Назначение антимикробных препаратов обожженным должно основываться на комплексной оценке их состояния с учетом обширности повреждения, его глубины, стадии ожоговой болезни, ее осложнений, степени обсемененности микрофлорой ожоговых ран, иммунного статуса, а также возраста больного, характера и тяжести сопутствующей патологии [10]. Рекомендации по эмпирической терапии нозокомиальных инфекций мягких тканей и сепсиса у ожоговых больных должны быть основаны на результатах локального мониторинга микробной флоры и ее антибиотикочувствительности [6]. Объективно оценить потребление антимикробных препаратов (АМП) в реальной клинической практике возможно при помощи методологии АТС/DDD, в которой единицей измерения потребления лекарственных средств является DDD (Defined Daily Dose) – средняя поддерживающая доза лекарственного средства, применяемого по его основному показанию у взрослых пациентов. Использование системы ATC/DDD позволяет исследовать тенденции в использовании антимикробных препаратов во времени и в различных условиях [11].
В Красноярском крае основной базой лечения обожженных пациентов является ожоговый центр (ОЦ) краевой клинической больницы (ККБ). В состав центра входит отделение ожоговой реанимации (ОР), в котором ежегодно получают помощь более 300 пациентов. Для планирования и проведения эффективной эмпирической антимикробной терапии, прогнозирования резистентности основных возбудителей бактериальных инфекций необходимы локальный мониторинг микрофлоры и оценка уровня потребления АМП.
Цель исследования – изучение микробного пейзажа и уровня потребления АМП в ОР ККБ за 2014–2018 гг.
Материалы и методы исследования
Проведен анализ 2534 положительных результатов микробиологических исследований раневого отделяемого, полученных в отделении ожоговой реанимации за период с 2014 г. по 2018 г. Видовую принадлежность выделенных штаммов определяли в соответствии с приказом МЗ СССР от 22.04.1985 № 535. Резистентность к АМП определена диско-диффузионным методом в соответствии со стандартами Clinical and Laboratory Standards Institute (CLSI). Чувствительность стафилококков к оксациллину определяли методом скрининга в соответствии с рекомендациями CLSI. Продукция металлобеталактамаз (МБЛ) изучена у 253 штаммов Pseudomonas aeruginosa с помощью фенотипического метода «двойных дисков с ЭДТА». Продукцию беталактамаз расширенного спектра действия (БЛРС) у энтеробактерий определяли с помощью фенотипического метода «двойных дисков» на среде Мюллера–Хинтона с использованием дисков BIORAD. Для внутрилабораторного контроля определения антибиотикочувствительности и метициллинрезистентности использовали референс-штаммы из коллекции American Type Culture Collection (АТСС). Анализ чувствительности к АМП проведен с использованием программы «Микроб-2». Сведения о расходе АМП в ОР за 2014–2018 (9 месяцев) гг. получены из базы данных ККБ1С: Аптека. Сведения об общем количестве койко-дней и количестве пролеченных больных получены из годовых отчетов ККБ за анализируемый период. Оценка потребления АМП проведена по АТС/DDD методологии, результат получен в виде количества DDD на 100 койко-дней (DBD).
Результаты исследования и обсуждение
Анализ микробного пейзажа инфицированных ран у ожоговых больных за 2014–2018 гг. показал, что структура выделенных штаммов существенно не изменяется на протяжении всего периода наблюдения. В структуре микробного пейзажа ожоговых ран доминирует грамотрицательная микрофлора: от 62% в 2014 г. до 67% в 2018 г. Грамположительные бактерии составляли 35% и 32% в 2014 г. и в 2018 г. соответственно.
В структуре грамотрицательной флоры наибольшую долю представляют бактерии семейства Enterobacteriaceae (2014 г. – 22%; 2015 г. – 30%; 2016 г. – 22%; 2017 г. – 30%; 2018 г. – 21%), рода Acinetobacter (2014 г. – 20%; 2015 г. – 16%; 2016 г. – 19%; 2017 г. – 13%; 2018 г. – 20%) и рода Pseudomonas (2014 г. – 20%; 2015 г. – 21%; 2016 г. – 19%; 2017 г. – 22%; 2018 г. – 26%). Способность к продукции БЛРС была исследована у 386 штаммов бактерий рода Enterobacteriaceae, который был представлен видами Klebsiella spр., E.coli, Proteus spр., Citrobacter spp., Enterobacter spp.. Продуценты БЛРС выявлены в 83% случаев в 2014 г., в 79% в 2015 г. и в 2016 г., в 84% в 2017 г., в 76% в 2018 г. Среди представителей рода Pseudomonas spp. подавляющее большинство микроорганизмов (89%) относилось к P. aeruginosa. Продукция МБЛ изучена у 253 штаммов Pseudomonas aeruginosa. Доля штаммов – продуцентов МБЛ существенно не изменилась и составляет 69% и 68% в 2014 г. и в 2018 г. соответственно.
Грамположительная флора представлена подавляющим большинством бактерий рода Staphylococcus (2014 г. – 29%; 2015 г. – 25%; 2016 г. – 27%; 2017 г. – 26%; 2018 г. – 25%). Бактерии рода Enterococcus составляли 6–7% от общего количества микроорганизмов. Видовой состав рода Staphylococcus включал коагулазоположительные виды (S.aureus) и был представлен коагулазонегативными стафилококками (S. epidermidis, S. saprophyticus). Доля S. aureus составила более 70% от числа изолированных культур, из них в 2014 г. 70% выделенных микроорганизмов были определены как MRSA, затем постепенно к 2018 г. доля MRSA снизилась до 56%.
Таким образом, анализ микробного пейзажа инфицированных ран у ожоговых больных показал наличие высокой доли «проблемных» грамположительных и грамотрицательных микроорганизмов, требующих как особого внимания клиницистов при выборе АМП, так и проведения комплексных, постоянно действующих мероприятий для стабилизации ситуации с их распространением [12].
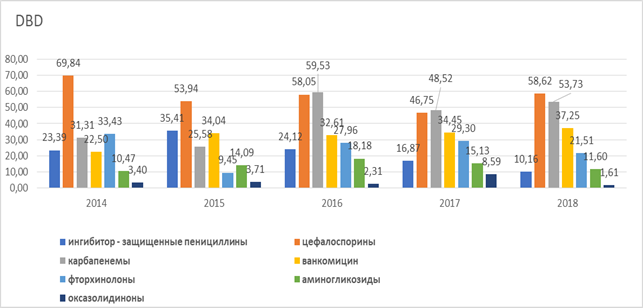
Результат фармакоэпидемиологического анализа показал, что потребление АМП в ОР в динамике по годам отличается не более чем на 11,25%. Потребление АМП в 2014 г. и в 2016 г. находилось на уровне 238,36 DBD и 244,76 DBD соответственно, а в 2015 г., 2017 г. и в 2018 г. – на уровне 212,87 – 211,57 – 215,28 DBD соответственно. При этом имеет место изменение структуры потребления АМП.
Пенициллины. Из препаратов этой группы в ОР применяются только ингибитор – защищенные пенициллины, такие как амоксициллин / клавуланат, ампициллин / сульбактам и пиперациллин / тазобактам. Суммарный уровень потребления ингибиторзащищенных аминопенициллинов был наибольшим в 2015 г. – 32,61 DBD, что составляло 15,32% от общего уровня потребления АМП. В 2014 г., 2016 г., 2017 г., и в 2018 г. уровень потребления составлял 12,5 DBD, 4,12 DBD, 15,67 DBD и 8,84 DBD соответственно. Потребление пиперациллина / тазобактама снизилось от 10,82 DBD в 2014 г. до 1,32 DBD в 2018 г.
Цефалоспорины. В целом потребление цефалоспоринов за период с 2014 по 2018 гг. сохраняется на уровне 69,84–58,62 DBD, что составляет около 30% от общего уровня потребления антимикробных препаратов. Основная доля потребления цефалоспоринов приходится на цефоперазон / сульбактам (23,18 и 35,90 DBD в 2014 г. и 2018 г. соответственно) и цефтриаксон (22,98 и 19,83 DBD в 2014 г. и 2018 г. соответственно). Потребление цефтаролина – цефалоспорина, активного в отношении MRSA [13], увеличилось от 0,13 DBD в 2014 г. до 2,51 DBD в 2018 г., но не превысило 5% от общего уровня потребления цефалоспоринов.
Карбапенемы. За анализируемый период потребление карбапенемов в ОР увеличилось практически в 2 раза: от 13,14 DBD в 2014 г. до 24,96 DBD в 2018 г. за счет увеличения потребления имипенема / циластатина. Доля имипенема в общем уровне карбапенемов также выросла от 36,3% до 75,3% в 2014 г. и 2018 г. соответственно. Наименьший уровень потребления отмечен для препаратов дорипенем и эртапенем.
Гликопептиды. Ванкомицин применяется в ОР в качестве основного антиMRSA препарата. Потребление ванкомицина стабильно увеличивается от уровня 22,5 DBD в 2014 г. до 37,25 DBD в 2018 г. Тейкопланин в ОР не применялся.
Оксазолидиноны. Потребление линезолида нестабильно, находится на уровне 3,40 DBD, 3,71 DBD, 2,31 DBD, 8,59 DBD и 1,61 DBD в 2014–2018 гг. соответственно.
Фторхинолоны. В целом уровень потребления фторхинолонов снизился на 35,6%: от 33,43 DBD в 2014 г. до 21,51 DBD в 2018 г. – за счет сокращения потребления «ранних» фторхинолонов, таких как ципрофлоксацин. При этом уровень потребления «респираторных фторхинолонов» стабильно увеличивается, в основном за счет увеличения потребления левофлоксацина: от 7,58 DBD в 2014 г. до 17,86 DBD в 2018 г. Доля левофлоксацина в общем уровне потребления фторхинолонов увеличилась от 22,6% до 83,2%.
Аминогликозиды. За анализируемый период потребление аминогликозидов II–III поколения находится на уровне 10,46 DBD в 2014 г. до 11,6 DBD в 2018 г. Увеличение потребления аминогликозидов отмечалось в 2016–2017 гг. и составляло 18,8 DBD и 15,3 DBD соответственно. Потребление амикацина составляет от 92% до 98% в группе аминогликозидов.
В целом анализ потребления АМП в ОР показал стабильно высокое потребление цефалоспоринов, рост потребления карбапенемов и гликопептидов (рис.).
|
|
|
Структура потребления АМП в ожоговой реанимации ККБ в 2014–2018 гг. |
Средний уровень потребления АМП в ОР ККБ на уровне 224,56 DBD превышает в 2 раза средний уровень потребления АМП в отделениях реанимации и интенсивной терапии (ОРИТ) многопрофильных стационаров Российской Федерации и Республики Беларусь, составляющий 122,5–133,8 DBD [14], что может быть вызвано, с учетом профиля ОР, более высокой долей пациентов, нуждающихся в проведении системной комбинированной антимикробной терапии. В 2018 г. 80% потребления АМП в ожоговой реанимации ККБ составляли три основные группы АМП: цефалоспорины – 27,23% (58,62 DBD), карбапенемы – 24,96% (53,73 DBD) и гликопептиды (ванкомицин) – 17,3% (37,25 DBD). Указанные препараты являются препаратами выбора при лечении инфекционных осложнений термической травмы. При этом достоверно доказано влияние применения цефалоспоринов на вероятность развития инфекций, вызванных продуцирующими БЛРС штаммами энтеробактерий, а повышение потребления карбапенемов приводит к повышению риска возникновения инфекций, вызванных МБЛ штаммами Pseudomonas aeruginosa [14]. Обращает внимание отсутствие потребления полимиксина при наличии микроорганизмов – продуцентов МБЛ.
Выводы
1. В структуре микробного пейзажа ожоговых ран в ОР доминирует грамотрицательная микрофлора, при этом доля «проблемных» возбудителей, таких как Klebsiella spр., E.coli, Proteus spр., Citrobacter spp., Enterobacter spp. – продуцентов БЛРС, и доля штаммов Pseudomonas aeruginosa – продуцентов МБЛ превышает 60% в каждой группе. Среди грамположительных бактерий лидирует S. аureus, доля MRSA превышает 50%.
2. Структура потребления АМП в целом соответствует данным микробиологического мониторинга раневого отделяемого. Увеличение потребления карбапенемов связано с увеличением доли «проблемных» возбудителей, но в свою очередь может быть причиной увеличения распространения полирезистентных бактерий в ОР, что требует переоценки практики использования АМП, а также ее влияния на эпидемическую ситуацию как в ОР, так и в стационаре в целом.
3. Для лечения инфекций, вызванных Pseudomonas aeruginosa – продуцентами МБЛ, необходимо обеспечить возможность потребления полимиксина, отсутствующего в ОР за анализируемый период.
Библиографическая ссылка
Морозова А.В., Бочанова Е.Н., Дегтярев Д.И., Климец А.А., Бабушкин В.А., Курц Е.М., Копытко Л.Н., Сарматова Н.И., Хохлова О.Е. ОЦЕНКА МИКРОБНОГО ПЕЙЗАЖА И ПОТРЕБЛЕНИЯ АНТИМИКРОБНЫХ ПРЕПАРАТОВ В ОЖОГОВОЙ РЕАНИМАЦИИ КРАЕВОЙ КЛИНИЧЕСКОЙ БОЛЬНИЦЫ Г. КРАСНОЯРСКА // Современные проблемы науки и образования. 2019. № 2. ;URL: https://science-education.ru/ru/article/view?id=28684 (дата обращения: 03.03.2026).