Врожденная дисфункция коры надпочечников представляет собой группу заболеваний, обусловленных дефицитом ферментов, необходимых для синтеза стероидных гормонов надпочечников. В результате нарушения образования конечных продуктов происходит накопление веществ-предшественников, а именно 17OH-прогестерона. Его избыток сбрасывается на синтез мужских половых гормонов в сетчатой зоне коры надпочечников. При неклассическом варианте течения ВДКН дефицит фермента не столь значителен, как при сольтеряющей или вирильной форме, однако длительно существующий гормональный дисбаланс как на уровне желез внутренней секреции, так и на уровне высших звеньев регуляции может приводить к разнообразным нарушениям в работе репродуктивной системы, которые являются причиной бесплодия и невынашивания беременности у пациенток.
Цель работы: анализ литературы, посвященной современным представлениям о влиянии неклассической формы врожденной дисфункции коры надпочечников на репродуктивное здоровье женщин. Раскрытие роли нейроэндокринных нарушений в возникновении патологий организма и развитии бесплодия у пациенток.
По данным ВОЗ около 15% семейных пар репродуктивного возраста во всем мире сталкиваются с проблемой бесплодия [1]. Так, распространенность бесплодных браков в европейских странах составляет около 10%, в США – около 15%, в России – 17,5% (4–4,5 млн супружеских пар) [2]. Согласно данным Росстата за последние десятилетия все чаще регистрируется диагноз «бесплодие». С 1990 по 2012 гг. этот показатель вырос на 85% [3]. Такая тенденция обусловлена влиянием множества факторов, таких как генитальная и экстрагенитальная патология одного или обоих супругов, неблагоприятные социально-экономические условия, вредные привычки (курение, употребление алкоголя в больших количествах, избыток или дефицит массы тела), экологическая обстановка. Ведущими формами женского бесплодия являются трубно-перитонеальная, эндокринная, маточная, шеечная, иммунологическая. Эндокринное женское бесплодие, возникающее вследствие нарушения нормального фолликулогенеза в яичниках и овуляции, выявляется у 30% бесплодных пар [4]. К наиболее распространенным наследственным эндокринным заболеваниям, вызывающим нарушение работы репродуктивной системы, относится неклассическая форма врожденной дисфункции коры надпочечников (нфВДКН) [5].
Врожденная дисфункция коры надпочечников (адреногенитальный синдром, синдром Уилкинса) представляет собой наследственное заболевание с аутосомно-рецессивным типом наследования. Выделяют три формы адреногенитального синдрома: классическая (или сольтеряющая), вирильная и неклассическая (или постпубертатная). Последняя форма является самой распространенной и регистрируется в 0,1–0,2% случаев, а в некоторых обособленных группах при наличии близкородственных связей частота встречаемости может достигать 1–2% [6]. Неклассическая форма врожденной дисфункции коры надпочечников развивается вследствие дефицита ферментов, участвующих в стероидогенезе. Наиболее часто данная патология возникает из-за нехватки фермента 21α-гидроксилаза (90% случаев) или 11β-гидроксилаза [7]. Причиной развития нфВДКН является мутация структурных генов – преимущественно гена CYP21, который кодирует образование фермента 21α-гидроксилазы [8]. Исходя из того, какая мутация произошла – точечная микроконверсия или крупные нарушения в виде делеции и конверсии, – будет наблюдаться разная степень недостаточности фермента. При сохранении его активности более 5% говорят о неклассической форме ВДКН [6].
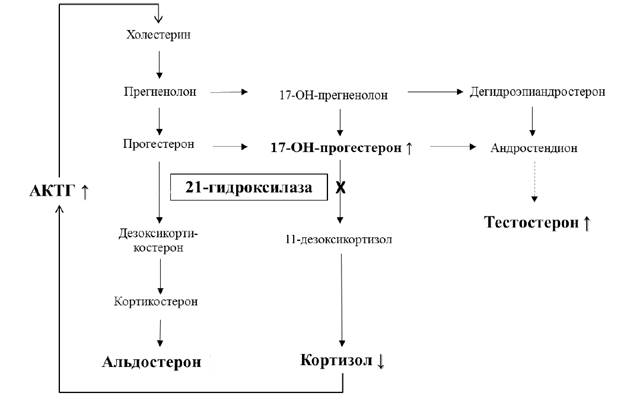
Патогенез развития неклассической формы ВДКН при дефиците фермента 21α-гидроксилазы [6]
Главным звеном патогенеза нфВДКН является блок на стадии синтеза кортизола. Известно, что холестерин служит предшественником прогестерона и 17-OH-прогестерона. Под действием фермента 21α-гидроксилазы данные соединения переходят в альдостерон и кортизол, однако в отсутствие фермента наблюдается их снижение, накапливается 17-OH-прогестерон (маркер ВДКН). Не использованный в пучковой зоне коры надпочечников, он утилизируется в сетчатой зоне, что сопровождается увеличением синтеза надпочечниковых андрогенов, преимущественно дегидроэпиандростерона (ДЭА) [6]. ДЭА является предшественником андростендиона и тестостерона. Из-за недостатка кортизола по принципу отрицательной обратной связи стимулируется выработка АКТГ, и порочный круг замыкается (рисунок). Развивается непрерывная гиперсекреция АКТГ, ведущая к стойкой гиперстимуляции коркового вещества надпочечников. Гиперфункция коры надпочечников приводит к ее патологической гиперплазии [4].
Диагностика нфВДКН представляет собой проблему, что связано, во-первых, с разной степенью выраженности клинических проявлений заболевания. У пациенток отмечаются нерегулярный менструальный цикл, рост волос по мужскому типу, себорея, акне, возникающие в постпубертатном периоде. Перечисленные симптомы зависят от степени дефицита фермента и могут не проявляться клинически. Во-вторых, это связано с недостаточной осведомленностью врачей о ВДКН и преуменьшением значения этой эндокринопатии в патологии репродуктивной системы. Таким образом, диагностика не проводится, назначается симптоматическое лечение юношеского акне и гирсутизма, а нерегулярный менструальный цикл связывают с подростковым возрастом.
В современном представлении нфВДКН рассматривается как полиэндокринопатия, так как дисбаланс стероидных гормонов не только отражается в нарушениях на уровне надпочечников, но и вызывает изменения в регуляции высших звеньев репродуктивной системы и приводит к развитию ряда нарушений.
Данная патология может быть причиной возникновения недостаточности лютеиновой фазы цикла вследствие развития гиперпролактинемии, что проявляется нарушением формирования желтого тела, снижением выработки прогестерона и уменьшением толщины эндометрия матки < 10 мм к концу второй фазы менструального цикла (при норме до 17 мм) [9]. Избыток пролактина при нфВДКН обусловлен повышением уровня гестагена 17-OH-прогестерона, оказывающего «пролактиногенный» эффект, и снижением тормозного влияния дофамина за счет ускорения его обратного захвата под действием стероидов надпочечников [10]. Кроме этого, к пролактинингибирующим факторам относят глюкокортикоиды, уровень которых снижен при нфВДКН [11]. Однако их влияние на пролактинотрофы значительно меньше. Патогенез нарушения репродуктивной системы обусловлен тем, что из-за воздействия избытка пролактина возрастает количество опиоидных нейропептидов (эндорфинов, энкефалинов) – ингибиторных модуляторов, действующих на синтез гонадолиберина в гипоталамусе, а также нарушается чувствительность гипоталамо-гипофизарной системы к эстрогенам [12]. Следовательно, уменьшается синтез ЛГ и ФСГ в гипофизе. Также пролактин конкурентно ингибирует рецепторы гонадотропного гормона в яичниках, что обусловливает торможение стероидогенеза и снижение уровня эстрогенов. Блокируя рецепторы, пролактин нарушает стимулирующее действие ФСГ на ароматазу P450arom, препятствуя переходу андрогенов в эстрогены. Вследствие уменьшения образования эстрогенов нарушается созревание фолликулов и развитие лютеинового тела, что приводит к снижению синтеза прогестерона. Нечувствительность рецепторов яичников к ФСГ и ЛГ постепенно делает овуляцию невозможной [13]. Таким образом, возникает стойкая гипофункция яичников, которая дополнительно усиливается возросшим уровнем надпочечниковых андрогенов, синтез которых стимулирует пролактин за счет увеличения выработки АКТГ. Клинически недостаточность лютеиновой фазы проявляется укорочением цикла менее 21 дня, олиго- или полименореей, ановуляторными циклами, галактореей, невынашиванием беременности и бесплодием. Также повышенная концентрация пролактина проявляется в снижении либидо и развитии кист, аденом и рака молочных желез [14].
Более подробное изучение нфВДКН позволило по-новому взглянуть на причины возникновения синдрома Форбса–Олбрайта [10]. Как известно, данный синдром сопровождается гиперпролактинемией и увеличением надпочечниковых андрогенов, что клинически проявляется гирсутизмом, галактореей и отсутствием менструации, а также ожирением [15, 16]. Ранее считалось, что причиной возникновения данного синдрома являются нарушения деятельности гипофиза, однако недостаточное изучение стертых форм ВДКН и проведение гормонального обследования пациенток только при ярко выраженной клинической картине, сопровождающейся длительной аменореей, привело к искажению понимания причинно-следственных связей. Сейчас изучается теория, в которой нфВДКН рассматривается как причина возникновения синдрома Форбса–Олбрайта, так как доказано, что повышение уровня 17-OH-прогестерона, ДЭАС и тестостерона (надпочечниковых андрогенов) приводит к гиперпролактинемии. Повышенная концентрация пролактина обусловливает развитие нарушений в работе репродуктивной системы – аменореи и галактореи, а увеличение надпочечниковых андрогенов и 17-OH-прогестерона – ожирение и гирсутизм.
Гормональный дисбаланс, имеющийся при нфВДКН, может способствовать развитию хронической ановуляции [17]. Причинами ее возникновения являются избыточный уровень пролактина и появление у женщин с дисфункцией надпочечников синдрома поликистозных яичников [18]. Механизм развития нарушений репродуктивной системы при гиперпролактинемии сводится к влиянию избытка гормона, во-первых, на гипоталамус, что сопровождается подавлением выработки гонадолиберина и, следовательно, угнетением образования гонадотропина гипофизом. Во-вторых, в яичниках пролактин снижает образование стероидных гормонов, а также уменьшает их чувствительность к регуляторным влияниям гипофиза и подавляет секрецию прогестерона лютеинов телом.
Длительно существующая гиперандрогенемия подавляет в яичниках фолликулогенез. Это приводит к развитию синдрома вторичных поликистозных яичников (СПКЯ). Повышение количества андрогенов и яичникового, и надпочечникового генеза в конечном счете приводит к формированию порочного круга и развитию идентичных клинических симптомов. Диагноз СПКЯ регистрируется у четверти женщин репродуктивного возраста, столкнувшихся с проблемой бесплодия. При этом поликистозные яичники выявляют у 80–90% женщин с разными формами гиперандрогенемии [9]. Под влиянием избыточного количества мужских половых гормонов в яичниках происходит рост примордиальных и первичных фолликулов [12]. Дисбаланс половых гормонов с повышением уровня андрогенов вызывает ускорение роста фолликулов до антральных, препятствует их атрезии и инициирует поликистозную трансформацию яичников [19]. Также гиперандрогенемия сопровождается ускоренным созреванием желтого тела и кистозной атрезией доминантного фолликула [18]. При гистологическом исследовании обнаруживаются гиперплазированные клеток оболочки фолликулов (тека-клеток), часто с признаками лютеинизации, и гиперплазия стромы яичников, что обусловлено действием повышенного уровня ЛГ. Данные нарушения свидетельствуют об увеличении продукции андрогенов [3, 4]. Снижение секреции ФСГ обусловливает торможение образования эстрадиола и накопление андрогенов вследствие недостаточной стимуляции зернистых клеток и нарушения образования энзимов, ароматизирующих андрогены в эстрогены, – P450arom [20]. Чем более выражен дефицит ФСГ и эстрогенов, тем больше накапливается незрелых гранулезных клеток, что приводит к постепенному увеличению выработки ингибина. Однако по принципу короткой петли обратной связи стимулируется выброс гонадотропного релизинг-гормона (ГнРГ) гипоталамусом. ГнРГ сильнее стимулирует выработку ЛГ, чем ФСГ, что проявляется относительной недостаточностью ФСГ, то есть возникает гонадотропная дисфункция. Таким образом, нарушение выработки ФСГ обусловлено действием ингибинов и ГнРГ. Описанные нарушения гипоталамо-гипофизарной системы, нарушения стероидогенеза, угнетение пролиферации фолликулярных клеток и утолщение белочной оболочки яичника способствуют развитию хронической ановуляции.
Прогрессирование патологических процессов в звеньях репродуктивной системы при адреногенитальном синдроме развивается постепенно. Отличительной чертой СПКЯ на фоне ВДКН является то, что вследствие повышенного уровня надпочечниковых андрогенов сначала поражается только один яичник, а нарушение структуры второго происходит позднее [4]. Таким образом, при исследовании пациенток с ВДКН выявляется разная степень патологических изменений в яичниках. Также в отличие от первичных поликистозных яичников при адреногенитальном синдроме возможна спонтанная овуляция и даже беременность за счет функционирования гипоталамо-гипофизарно-яичниковой системы. Однако неполноценное формирование фолликулов, недостаточность желтого тела и, следовательно, дефицит прогестерона приводят к нарушению имплантации и ранней плацентации [4].
Установлено, что гиперандрогенемия и инсулинорезистентность часто сочетаются при СПКЯ. Свободные андрогены блокируют рецепторы инсулина, расположенные снаружи клеточной мембраны. Также они активируют внегонадный синтез эстрогена в жировой ткани, следовательно, запускается пролиферация адипоцитов, прогрессирует ожирение, что приводит к блокировке инсулиновых рецепторов внутри клетки [21]. Избыток мужских половых гормонов, действуя на мышечную ткань, способствует увеличению в ней количества мышечных волокон 2-го типа, которые обладают меньшей чувствительностью к инсулину [22].
Помимо бесплодия, увеличение свободных андрогенов у пациенток приводит к изменениям в андрогензависимых тканях, что проявляется избыточным ростом волос по мужскому типу, себореей, появлением стрий, акне в форме комедонов, папул и кист, которые могут воспаляться и оставлять после устранения пигментные рубцы. У многих пациенток наблюдаются депрессивное подавленное состояние и избыточная масса тела (35–60% случаев) [23]. Женщины с СПКЯ входят в группу повышенного риска развития сердечно-сосудистых заболеваний, рака эндометрия и молочных желез.
Таким образом, можно сделать вывод, что полиморфизм клинических проявлений и разная степень их выраженности создают проблему не только на этапе выявления нфВДКН, но и при определении необходимости лечения. При этом особая опасность заключается в том, что многие пациентки не имеют выраженных симптомов, однако риск невынашивания беременности, мертворождения и ранней детской смертности в результате рождения детей с ВДКН является существенным. Вероятность рождения ребенка с классической формой составляет 2,5%, а с нфВДКН – не менее 15%, что также зависит от генотипа отца [24]. Необходимо подчеркнуть, что диагноз нфВДКН практически никогда не регистрируется у мужчин, так как у них не наблюдается выраженных нарушений [6]. Наибольшую угрозу для жизни новорожденного представляет сольтеряющая форма ВДКН. Ее проявления обусловлено блоком синтеза альдостерона, что приводит к значительной нехватке этого гормона [25]. Вследствие этого в организме ребенка нарушается обратное всасывание натрия и воды, задерживаются ионы калия и хлориды. При этом варианте дисфункции надпочечников наблюдаются снижение тонуса мышц, нарушение кровоснабжения головного мозга и периферических тканей. У детей отмечаются гипотония, брадикардия, которая может переходить в атриовентрикулярную блокаду и синдром Морганьи–Адамса–Стокса, рвота, ведущая к обезвоживанию, метаболический ацидоз, нарастающая адинамия и судороги. Гиперандрогенемия у девочек приводит к развитию псевдогермафродитизма, у мальчиков половые органы развиваются по изосексуальному типу, однако это часто приводит к постановке ошибочного диагноза и выбору неправильной тактики лечения [24]. Вирильная форма ВДКН развивается без сольтеряющего синдрома, при рождении отмечаются признаки неправильного строения половых органов у девочек (урогенитальный синус и гипертрофия клитора), при отсутствии лечения в постнатальном периоде рано наступает половое созревание (6–7 лет), из-за преждевременного замещения эпифизарной пластики костной тканью девочки имеют низкий рост. У них также возникают нарушение развития молочных желез и первичная аменорея, связанная с подавлением деятельности гипофизарно-яичниковой системы избытком андрогенов [26].
У беременных женщин с нфВДКН избыток андрогенов нарушает имплантацию плодного яйца, вызывает склероз сосудов миометрия и хориона, что ведет к развитию плацентарной недостаточности и невынашиванию беременности (76%) Также у данных пациенток регистрируются роды с последующим вторичным бесплодием (23,8%), самопроизвольное прерывание в сроки от 8 до 28 недель, замершая беременность [27].
Заключение. Исходя из вышеописанных изменений в организме женщин с нфВДКН можно сделать вывод, что возникающие нарушения репродуктивной и эндокринной систем могут вызывать осложнения в виде бесплодия, привычного невынашивания беременности, самопроизвольного прерывания беременности на ранних и поздних сроках гестации, рака эндометрия, яичников и молочной железы, полипов и миом матки, гиперплазии эндометрия, ожирения, развития инсулинорезистентности и сахарного диабета 2-го типа, повышения свертываемости крови и тромбозов, а также ухудшения качества жизни. Поэтому проведение диагностики нфВДКН действительно необходимо, так как только при выборе правильной тактики лечения врач может предотвратить описанные нарушения у пациенток.
Библиографическая ссылка
Петров Ю.А., Купина А.Д. ВЛИЯНИЕ НЕКЛАССИЧЕСКОЙ ФОРМЫ ВРОЖДЕННОЙ ДИСФУНКЦИИ КОРЫ НАДПОЧЕЧНИКОВ НА РЕПРОДУКТИВНОЕ ЗДОРОВЬЕ // Современные проблемы науки и образования. 2019. № 2. ;URL: https://science-education.ru/ru/article/view?id=28625 (дата обращения: 04.03.2026).



