Процессы воспаления в кардиомиоцитах можно выявить при различных повреждениях сердца, включая ишемические нарушения, механическую травму или генетические кардиомиопатии. В то же время остается неизменным тот факт, что для классического варианта миокардита характерно воспаление в результате воздействия бактерий, паразитов, вирусов или реже лекарственных препаратов либо вследствие запуска аутоиммунных реакций [1].
Классические критерии Dallas для подтверждения диагноза «миокардит» учитывают присутствие как минимум двух составляющих на одном и том же срезе при анализе эндомиокардиальной биопсии (ЭМБ): выявление воспалительных клеток плюс некротических кардиомиоцитов [1, 2]. В дальнейшем было предложено относительно широкое понятие миокардита, включающее присутствие вирусного генома или молекулярных маркеров активации иммунной системы, но и в настоящее время не удается создать единых рекомендаций с учетом предложенных показателей [3].
Чрезвычайно трудно установить и уровень распространенности данной патологии в связи с тем, что на практике используются разные критерии включения, сложности выявления бессимптомных и малосимптомных случаев и сохраняется высокий дефицит всех необходимых диагностических методов. На основании исследований ряда авторов заболеваемость миокардитами составляет от 8 до 10 случаев на 100 тыс. населения [1].
Кроме того, процент летальных исходов, возникших в результате миокардита, до конца остается нераспознанным. В результате проведенных патологоанатомических исследований есть подтверждение высокой частоты (8,6%) миокардита среди внезапно возникших смертей у лиц 20–30 лет [4]. В группе пациентов с диагнозом «дилатационная кардиомиопатия (ДКМП) неуточненной этиологии» в 10–40% случаев в дальнейшем выявляется миокардит [5].
Основные сложности в классификации и диагностике миокардита начинаются на этапе оценки скудного или «разношерстного» спектра проявлений: от бессимптомных изменений на электрокардиограмме (ЭКГ) и по эхокардиоскопии (ЭХО-КС) до симптомов тяжелого нарушения ритма и проводимости, сердечной недостаточности (СН) и гемодинамического коллапса. Фактически в клинической практике миокардит не выставляют в дифференциально-диагностический ряд в достаточно большом количестве случаев. С.Н. Felker с соавторами, основываясь на критериях Dallas, по результатам биопсии у взрослых установили, что в случае впервые возникшего синдрома дилатации полостей сердца в 9–16% наблюдений подтверждался классический миокардит [6].
Цель исследования – выделить особенности развития данного заболевания и обсудить возможности своевременной постановки правильного диагноза.
Материалы и методы исследования. В качестве клинического примера представлен случай наблюдения пациента с неверно установленным диагнозом «дилатационная кардиомиопатия».
Пациент С., 33 лет, 25.08.2016 г. бригадой скорой медицинской помощи был доставлен в стационар и госпитализирован в хирургическое отделение с жалобами на боли в эпигастральной области опоясывающего характера, тошноту, ощущение распирания в брюшной полости, чувство нехватки воздуха, затрудненное дыхание, повышение температуры тела до 37,5оC, сухость во рту, общую слабость.
Из анамнеза заболевания: больным себя считает с 15.07.2016 г., когда после переохлаждения стали беспокоить сухой, в дальнейшем влажный кашель с мокротой, повышение температуры до 38°С. 18.07.2016 г. обследовался в поликлинике по месту жительства у терапевта. В результате назначена и выполнена рентгенография органов грудной клетки, проведено обследование показателей периферической крови. Выявленные изменения были расценены как обострение хронического бронхита. Получал лечение: несколько курсов антибактериальных препаратов в связи с недостаточным противовоспалительным эффектом предыдущего курса (антибиотикотерапия – ципролет по 500 мг 7 дней, левофлоксацин 500 мг в сутки – 5 дней, в дальнейшем в/м цефтриаксон по 1000 мг 2 раза в день 3 дня), десенсибилизирующую и отхаркивающую терапию. В результате 10.08.2016 г. интенсивность кашля уменьшилась, но сохранялось повышение температуры в вечерние часы до 37,5°С, присоединились одышка при физической нагрузке, приступы затрудненного дыхания в ночные часы и общая слабость. С 20.08.2016 г. по 25.08.2016 г. появились жалобы на боли в эпигастральной области опоясывающего характера, ощущение распирания в брюшной полости, тошноту и сухость во рту.
На момент поступления: общее состояние удовлетворительное. Температура тела составляла 37,5оС. Кожные покровы бледные, цианоз губ. В легких дыхание везикулярное, выслушиваются единичные рассеянные сухие хрипы. Частота дыхания (ЧД) 20 в минуту в покое. Артериальное давление (АД) 140/ 90 мм рт. ст. Частота сердечных сокращений (ЧСС) 98 ударов в минуту. Живот симметричный, умеренно вздут, участвует в акте дыхания. При пальпации болезненный в верхних отделах живота, преимущественно в области эпигастрия. Перитонеальные симптомы отрицательные. В общем анализе крови (ОАК) от 25.08.2016 г.: Умеренный лейкоцитоз (лейкоциты 11,3×10*9/л), скорость оседания эритроцитов (СОЭ) 5 мм/ч. Общий анализ мочи (ОАМ) – без патологии. На ЭКГ от 25.08.2016 г.: Cинусовый ритм с частотой сердечных сокращений 102 в минуту. Электрическая ось сердца горизонтальная. Переходная зона в V4. В отведениях V3–V6 глубокие асимметричные (–) зубцы Т, дисметаболические изменения миокарда. При проведении ультразвукового исследования (УЗИ) органов брюшной полости от 25.08.2016 г.: Признаки умеренной гепатомегалии, диффузных изменений паренхимы печени, утолщение стенок желчного пузыря (отек), диффузных изменений поджелудочной железы по типу хронического панкреатита, в стадии обострения. Свободной жидкости в брюшной и плевральной полости не выявлено. Эзофагогастродуоденоскопия (ЭГДС) от 25.08.2016 г.: Поверхностный гастродуоденит. Дуодено-гастральный рефлюкс. На рентгенограмме органов грудной клетки от 25.08.2016 г. выявлено расширение всех границ сердца. В результате осмотра терапевта выставлен диагноз: Кардиомиопатия идиопатическая? Хроническая сердечная недостаточность (ХСН) 0 стадия. Хронический панкреатит, стадия обострения.
В период нахождения в стационаре получал инфузионную терапию (раствор Рингера 250 мл 1 раз в день в/в капельно, ежедневно цефтриаксон 1,0 г с раствором натрия хлорида 200 мл 1 раз в день в/в капельно, а также в/м анальгин, платифиллин) и таблетированные формы препаратов (антациды, ферменты и блокаторы протонной помпы). На фоне активной инфузионной терапии, которая проводилась с 25.08.2016 г. по 27.08.2016 г., самочувствие пациента ежедневно ухудшалось (нарастала одышка, появились удушье в горизонтальном положении, отеки на нижних конечностях), в связи с чем он самостоятельно покинул хирургическое отделение стационара.
02.09.2016 г. самостоятельно обратился к кардиологу в поликлинику по месту жительства. Предъявлял жалобы на одышку при незначительной физической нагрузке и в покое, чувство нехватки воздуха и удушье в горизонтальном положении, колющие и давящие боли в области сердца и сердцебиение при минимальной физической нагрузке, увеличение живота в объеме и отеки на нижних конечностях, головные боли, выраженную общую слабость. При более подробном сборе анамнеза заболевания было выявлено: артериальное давление повышается в течение 7 лет Максимальные цифры 175/130 мм рт. ст., адаптирован к цифрам АД 140–150/110 мм рт. ст. (более низкие цифры АД не регистрировал). Гипотензивные препараты регулярно не принимает, только периодически использует капотен. В течение последних 2 лет беспокоят колющие боли в области сердца и редкие приступы сердцебиения при значительной физической нагрузке, купирующиеся самостоятельно. Со слов пациента, ухудшение состояния возникло остро в течение последних двух недель. Обращает на себя внимание появление и прогрессирование в течение последней недели следующих симптомов: отеки нижних конечностей и увеличение живота в объеме. Из анамнеза жизни было выяснено, что пациент работает автомаляром (стаж около 10 лет, ежедневно контактирует с токсичными лакокрасочными и смазочными материалами, токсическими аэрозолями). Имеет вредные привычки: курит 0,5 пачки в день в течение 8 лет, алкогольные напитки употребляет редко, применение наркотических и запрещенных тонизирующих средств отрицает. Семейный анамнез ранних сердечно-сосудистых заболеваний не отягощен. Из перенесенных заболеваний: желтуха в детском возрасте, хронический обструктивный бронхит, хронический панкреатит и хронический холецистит. Общее состояние расценено как средней тяжести. Индекс массы тела (ИМТ) – 29. Цианоз губ. Акроцианоз. При переходе в горизонтальное положение – цианоз лица, ушей. Выраженные отеки голеней и стоп. В легких дыхание с жестким оттенком, в нижних отделах выслушиваются единичные влажные мелкопузырчатые хрипы. ЧД 20 в минуту (в покое). Границы относительной сердечной тупости смещены: правая на 1,0 см от правого края грудины, левая на 2,5 см кнаружи от левой срединно-ключичной линии по 5-му межреберью. Тоны сердца приглушены, систолический шум на верхушке, в 3-й точке аускультации – легочной артерии и в 4-й точке аускультации – проекции трикуспидального клапана. Ритм сердца правильный, ЧСС 95 в минуту, АД 168/109 мм рт. ст., пульс 95 в минуту. Живот увеличен в объеме за счет асцита, при пальпации безболезненный. Печень выступает на 2 см из-под края правой реберной дуги.
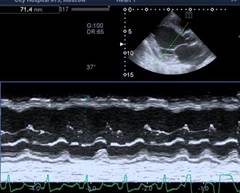
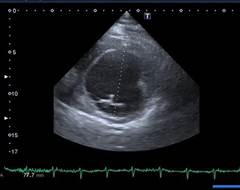
По рекомендации кардиолога 28.08.2016 г. выполнена ЭХО-КС, где впервые выявлены дилатация камер сердца (левое предсердие (ЛП) 4,3 см, левый желудочек (ЛЖ): конечный диастолический размер (КДР) 6,4 см, конечный систолический размер (КСР) 5,5 см; правый желудочек (ПЖ) 3,8 см, правое предсердие (ПП) 5,7×4,6 см), выраженное снижение фракции выброса (ФВ 26%), диффузный гипокинез стенок, признаки недостаточности относительного генеза митрального клапана (митральная регургитация (МР) II степени), трикуспидальная регургитация (ТР) II степени, легочная регургитация (ЛР) I–II степени, умеренная легочная гипертензия с систолическим давлением в легочной артерии (СДЛА) 52 мм рт. ст. (рис. 1). По мнению врача ультразвуковой диагностики, все указывало на признаки дилатационной кардиомиопатии, что и было указано в заключении.
 а)
а)
 б)
б)
Рис. 1. Эхокардиоскопия. а) М – модальный режим по длинной оси – КДР левого желудочка 6,4 cм,
б) Двухмерный режим по короткой оси – КСР левого желудочка
Из дообследований по результатам биохимического анализа крови (БАК) от 30.08.2016 г. выявлено: повышение содержания С-реактивного белка (до 7 мг/л), а показатели билирубина и печеночных ферментов, сахара крови, электролитного состава, свертывающей системы крови, липидного спектра и МВ фракции креатинфосфокиназы (МВ-КФК) оставались в пределах нормы, качественный метод оценки тропонина-Т был отрицательным. По данным иммуноферментного анализа крови на HIV, НВsAg и НСV получен отрицательный результат. Холтеровский монитор ЭКГ (ХМ-ЭКГ) зарегистрировал синусовый ритм. Средняя суточная ЧСС 94 ударов в минуту. Одиночные наджелудочковые экстрасистолы до 16. Смещения сегмента ST не зарегистрировано. По результатам цветного дуплексного сканирования (ЦДС) вен нижних конечностей получено варикозное расширение вен в системе малой подкожной вены левой нижней конечности. Суточное мониторирование АД от 29.08.2016 г. выявило стойкую артериальную гипертензию в дневное и ночное время. ЦДС брюшной аорты и сосудов почек от 02.09.2016 г. без патологии (брюшной отдел аорты не изменен, признаков гемодинамически значимого стенозирования устьев почечных артерий не выявлено). На 28.09.2016 г. прогрессировала дилатация полостей сердца, ФВ составляла 22% по данным ЭХО-КС.
В результате пациент наблюдался и лечился в течение всего этого времени с диагнозом «Дилатационная кардиомиопатия. Митральная недостаточность II степени. Трикуспидальная недостаточность II степени. Умеренная легочная гипертензия. Недостаточность клапана легочной артерии I–II степени. Артериальная гипертензия II стадии, III риск. Хроническая сердечная недостаточность III стадия (II Б стадия в быстрой динамике), III ФК». Под динамическим контролем кардиолога получал: Конкор по 5 мг утром, Зокардис по 7,5 мг или (Лориста 100 мг утром), Диувер 10 мг утром, Верошпирон по 25 мг утром и 25 мг в обед, Предуктал МВ по 1 таблетке 2 раза в день (курс 3 месяца), Кардиомагнил по 75 мг вечером.
Консультации кардиолога и в дальнейшем кардиохирурга не поставили под сомнение диагноз «дилатационная кардиомиопатия». После согласия больного с целью исключения ишемических изменений в миокарде (ишемической кардиомиопатии) 20.09.2016 г. в плановом порядке была выполнена коронароангиография (КАГ), которая не выявила патологических изменений по контрастному наполнению коронарных артерий.
На основании Национальных клинических рекомендаций, утвержденных решением Координационного Совета общероссийской общественной организации трансплантологов «Российское трансплантологическое общество», утвержденных 29.11.2013 г., были выделены показания для трансплантации сердца. В данный период времени лечащим врачом с пациентом обговаривался вопрос о возможности трансплантации сердца (записи в лист ожидания трансплантации сердца). Только на основании его полного письменного отказа от проведения данной операции и информирования о возможных последствиях вопрос был снят с дальнейшей разработки.
С 22.09.2016 г. по 3.10.2016 г. пациент проходил стационарное лечение в кардиологическом отделении. Учитывая ежедневный амбулаторный прием вышеперечисленных лекарственных препаратов, отмечал уменьшение одышки и отеков на нижних конечностях, живота в объеме, сохранялись редкие приступы колющих болей в области сердца только при физической нагрузке.
На ЭКГ от 22.09.2016 г. Ритм синусовый. ЧСС 69 ударов в минуту. Горизонтальное положение ЭОС. Гипертрофия миокарда левого желудочка с систолической перегрузкой. ЭХО-КС от 23.09.2016 г. Заключение: Дилатация всех камер сердца. Диффузный гипокинез. Снижение глобальной сократимости ЛЖ (УО 64 мл, ФВ 30%). Диастолическая дисфункция ЛЖ. Незначительная регургитация на МК, ТК, ЛК. Умеренная легочная гипертензия. Проведение офтальмоскопии, полного биохимического анализа крови, общего анализа мочи не выявило патологических изменений. И только в общем анализе крови от 22.09.2016 г. сохранялся лейкоцитоз до 10,4*109/л. При выписке было рекомендовано: ЭХО-КС в динамике, консультация ангиохирурга и кардиохирурга после проведения спиральной томограммы сердца. Продолжить прием лекарственных препаратов: Триметазидин 35 мг 2 раза в сутки (утром и вечером на 2 месяца), Верошпирон 25 мг утром или Эспиро 25 мг утром, Торасемид 10 мг утром, Дигоксин 0,00025 мг – по 1/2 таблетки утром 5 дней в неделю, Престанс (10 мг/5 мг) 1 таблетку утром и дополнительно Таурин 500 мг 2 раза в сутки в течение 3 месяцев.
11.12.2016 г. при оценке ограничений жизнедеятельности в учреждении медико-социальной экспертизы (МСЭ) пациенту установлена II группа инвалидности.
26.12.2016 г. при проведении ЭХО-КС зарегистрированы повышение ФВ до 55%, что соответствовало нижней границе нормы, уменьшение выраженности дилатации полостей ЛЖ (КДР ЛЖ 5,6 см, ПЖ 2,9 см, ЛП 4,0 см), снижение СДЛА до 27 мм рт. ст., уменьшилась степень недостаточности на клапанах до 0–I степени.
Учитывая длительный период наблюдения за пациентом и использование большого количества диагностических методов, для лучшего понимания положительной динамики по данным ЭХО-КС исследований более значимые показатели представлены в виде диаграмм на рисунках 2, 3 и 4.
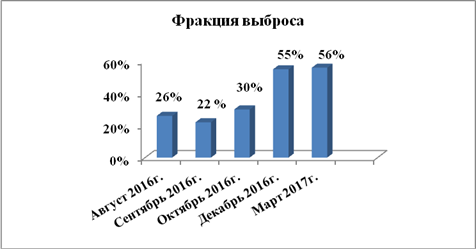
Рис. 2. Изменение систолической функции (показателей ФВ) левого желудочка по данным ЭХО-КС с 08.2016 по 03.2017 г.
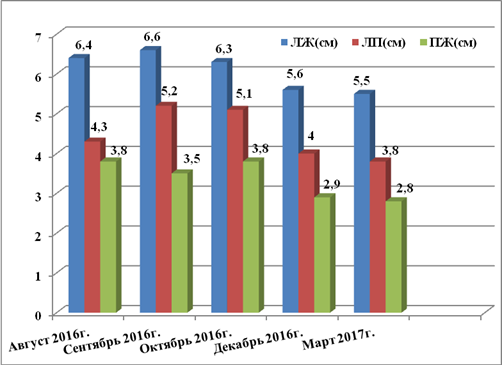
Рис. 3. Динамика размеров камер сердца по данным ЭХО-КС с 08.2016 по 03.2017 г.
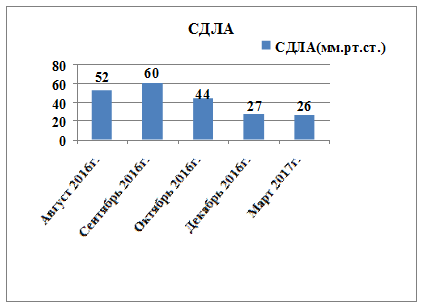
Рис. 4. Динамика изменений систолического давления в легочной артерии по данным ЭХО-КС с 08.2016 по 03.2017 г.
И только в январе 2017 г. появилась возможность выполнения магнитно-резонансной томографии (МРТ) до и после введения контрастного препарата (рис. 5). При интерпретации результатов оценивались особенности накопления контрастного препарата поврежденным миокардом, локализация и масштаб изменений.
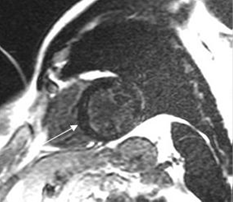
Рис. 5. Магнитно-резонансная томография сердца. Срез желудочков сердца по короткой оси (двухкамерная позиция) – восстановление через 15–20 мин после введения контрастного препарата. Мелкоочаговые включения контраста (указаны стрелкой) в толщу межжелудочковой перегородки (МЖП)
Визуализируются неяркие и без четких контуров мелкие расположенные по цепочке интрамуральные очаги на протяжении трех сегментов. Для выделения достоверно поврежденного участка миокарда использовали общепринятую схему сегментарного строения миокарда левого желудочка.
Выделяют следующие МРТ-критерии, предложенные международной рабочей группой (Lake Louise Criteria – «Критерии озера Луизы») для диагностики миокардита: 1) локальное или диффузное усиление интенсивности Т2-сигнала; 2) увеличение отношения интенсивности раннего Т1-сигнала от миокарда к сигналу от скелетных мышц; 3) визуализация как минимум одной зоны с повышенным накоплением контрастного препарата, свидетельствующая о некротических или фибротических изменениях сердечной мышцы [7]. Метод позволил оценить активность заболевания, и с высоким процентом диагностической точности (чувствительности и специфичности) можно говорить, что выявленный процесс соответствует умеренно выраженным поствоспалительным изменениям. В итоге получены два из трех критериев Lake Criteria, что подтверждает диагноз «миокардит».
В связи с хорошим гемодинамическим приростом и отсутствием потребности в подборе более специфической терапии был снят вопрос о проведении эндомиокардиальной биопсии.
В октябре 2017 г. при повторном освидетельствовании в учреждении МСЭ инвалидность присвоена не была.
В настоящее время пациент предъявляет жалобы на редкие эпизоды головных болей в период подъемов АД (максимально до 150/80 мм рт. ст.), при объективном осмотре и по результатам дополнительных диагностических методов не имеет признаков сердечной недостаточности, а из лекарственных препаратов принимает нерегулярно Престанс (10 мг/5 мг) по 1 таблетке утром.
Обсуждение. Пациент, которого мы впервые увидели с тяжелыми проявлениями недостаточности кровообращения и неблагоприятным прогнозом (практически претендующий на пересадку сердца), в настоящее время ведет полноценный образ жизни и имеет возможность продолжать трудовую деятельность по своей специальности, исключив контакт с токсическими и химическими агентами.
И только через один год, анализируя всю картину заболевания, где четко прослеживается уменьшение клинических проявлений гемодинамических нарушений на фоне значительного и достаточно эффективного увеличения систолической функции ЛЖ (ФВ до 56%), положительной составляющей в изменении полостей сердца, можно подчеркнуть, что при истинной (генетически обусловленной) ДКМП, в основе которой лежит необратимый прогрессирующий фиброз миокарда, подобных положительных моментов не отмечается. В результате изложенного можно сделать вывод о том, что в 2016 г. пациент перенес острый миокардит.
C первого шага курации необходимо было сделать акценты на возраст и мужской пол пациента, так как ранее неоднократно в результате выполненных гистологических исследований биоптатного материала миокарда у достаточно большой группы лиц мужского пола с подтвержденным диагнозом «миокардит» был определен средний возраст, составляющий 30–35 лет [8].
В данном случае складывается впечатление о вирусной этиологии миокардита, поскольку именно он имеет благоприятный прогноз даже при использовании обычной стандартной терапии сердечной недостаточности, но нельзя исключить и роль бактериальной флоры. Кроме того, токсическое воздействие на кардиомиоциты могли оказать лекарственные препараты (агрессивная комбинированная терапия по поводу перенесенной инфекции органов дыхания) и длительное воздействие химических агентов, используемых ежедневно на рабочем месте. И мы не можем исключить ассоциацию этиологических факторов, учитывая такую «композицию» факторов. Зачастую многие этиологические факторы остаются вообще не выявленными или не учитываются, как было в данном случае.
Поражает, насколько долго растягивается диагностический путь пациента и составляет порой от нескольких недель до нескольких месяцев и более, что также подтверждается многими исследованиями [9].
Связь клинических симптомов с предшествующими эпизодами респираторных, вирусных и бактериальных инфекций, эпизодами неясной лихорадки, контактом с токсичными веществами четко прослеживается только при подробном сборе анамнеза заболевания и уточнении особенностей профессиональной деятельности. Кроме того, многие медикаментозные препараты являются кардиотоксичными, поэтому следует уделять самое пристальное внимание расспросу обо всех принимаемых лекарственных и нелекарственных средствах, дозах, а также длительности приема.
Обязательно в диагностический поиск необходимо включать максимум дополнительных методов обследования, уделяя их динамике также особое внимание [10]. В данном примере сочетаются: яркая клиническая картина тяжелых проявлений сердечной недостаточности и скудная лабораторная панель положительных результатов – критериев воспалительного характера в процессе повреждения миокарда, так как был получен умеренный лейкоцитоз и повышение С-реактивного белка, хотя это сохранялось на протяжении нескольких месяцев.
С учетом малой информационной значимости лабораторных показателей в сомнительных случаях для постановки диагноза «миокардит» обязательным является контроль показателей ЭХО-КС (порой в тяжелых случаях ежемесячный), что и было выполнено в данном клиническом примере. Именно практическая неограниченная доступность этого метода для основной массы пациентов в настоящее время позволяет обеспечивать ЭХО-КС наблюдение.
В связи с возможностью перехода перенесенного острого миокардита в хроническую форму и постоянным присутствием угрозы возникновения отдаленных осложнений у данного пациента в дальнейшем требуется регулярный длительный контроль за гемодинамическими показателями по данным ЭХО-КС (систолической функцией ЛЖ и размерами полостей сердца) и состоянием проводящей системы сердца при выполнении ЭКГ.
Применение высокотехнологических методов ядерной медицины, например МРТ и ее модификаций, незаменимо в современном мире и становится основой для верификации диагноза «миокардит» вследствие отсутствия доступности, а порой и необходимости в практическом применении более сложного метода эндомиокардиальной биопсии [11].
В подобных клинических ситуациях (при длительном сохранении признаков СН) не стоит придерживаться классических правил, требующих в кратчайшие сроки постановки клинического диагноза, а следует в полном объеме продолжить реализацию всех лабораторных и инструментальных методов обследования дифференциально-диагностического ряда.
Заключение. Таким образом, одними из наиболее сложных в диагностике нозологий на современной кардиологической платформе остаются воспалительные заболевания миокарда. При постановке диагноза «миокардит» многое зависит от знаний и опыта практического врача: необходимы грамотное использование основ медицины и пропедевтики (планирование и своевременное назначение современных диагностических методов обследования, составление дифференциально-диагностического ряда), а самое главное – возможность и смелость изменить диагноз на любом этапе заболевания. Это позволяет двигаться в правильном направлении, четко и обоснованно корректировать схемы лечения, тем самым улучшать качество и продолжительность жизни конкретного пациента.
Библиографическая ссылка
Сергутова Н.П., Гончарова Л.Н., Усанова А.А., Вагапова Н.Р., Еремкина Т.Я. ДОЛГИЙ ПУТЬ К ДИАГНОЗУ «МИОКАРДИТ». КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ // Современные проблемы науки и образования. 2019. № 1. ;URL: https://science-education.ru/ru/article/view?id=28595 (дата обращения: 07.03.2026).
DOI: https://doi.org/10.17513/spno.28595



