Одной из важнейших причин смерти больных ургентной хирургической патологией органов брюшной полости остается эндогенная интоксикация. Токсические продукты приводят к поражению различных органов и систем, вызывая нарушение их функционирования, что может замыкать порочный круг и зачастую порождать необратимый их сбой [1; 2]. Поэтому неслучайно в последние десятилетия отмечается активная исследовательская работа по поиску новых способов детоксикационной терапии [3; 4]. Получены обнадеживающие результаты, итогом чего стало существенное уменьшение летальности даже у тяжелейших больных. Однако поиск новых способов детоксикационной терапии продолжается [5; 6]. Одним из недостаточно изученных объектов для мотивированного купирования эндогенной интоксикации остаются катаболические процессы, которые, по современным сведениям, являются неотъемлемым спутником острых ургентных болезней живота, причем их присутствие не только в зоне основного воспалительного очага, но и вне его (организменный уровень) [7; 8].
Цель исследования. При различной ургентной патологии (острый перитонит, острый панкреатит) определить сопряженность эндогенной интоксикации организма с одними из триггерных механизмов катаболических процессов (перекисным окислением мембранных липидов и фосфолипаз), на основе чего разработать новый подход детоксикационной терапии.
Материал и методы исследования. Опыты поставлены на 40 кроликах породы шиншилла массой от 3,9 до 4,7 кг. Исследования поставлены в соответствии с этическими нормами и рекомендациями по работе с лабораторными животными, согласно «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей» (Страсбург, 1985). При манипуляциях, причиняющих боль, применялась тотальная анестезия путем внутривенного введения тиопентал-натрия из расчета 0,04 г/кг массы тела животного.
Выделены четыре группы исследований. Первая группа (n=10) - на модели острого перитонита в раннем послеоперационном периоде изучали явления эндогенной интоксикации, активность фосфолипаз и интенсивность окислительного стресса. Вторая группа (n=10) - такого рода исследования проводили на модели острого отечного панкреатита. Третья группа (n=10) - на модели острого перитонита в раннем послеоперационном периоде изучали эффективность ремаксола в коррекции расстройств гомеостаза. Четвертая группа (n=10) – исследования, аналогичные третьей группе, проводили на модели острого панкреатита.
Модель острого перитонита. Животным под наркозом вводили в брюшную полость 20% каловой взвеси из расчета 0,8 г/кг. Через 24 ч проводили лапаротомию, санацию брюшной полости, шов лапаротомной раны (Власов А.П., 1991).
Модель острого панкреатита. Кроликам под наркозом выполняли лапаротомию, забор желчи из желчного пузыря с последующим ее введением в ткань поджелудочной железы в 6 точках по 0,2 мл (Буянов В.М. и др., 1989).
Контрольные этапы периода наблюдения – 1, 3, 5-е сутки.
В раннем послеоперационном периоде животным проводили инфузионную (70 мл/кг), а в первой и третьей группе – антибактериальную терапию. В третьей и четвертой группе ежедневно внутривенно капельно вводили ремаксол из расчета 30 мл/кг. В этих группах общий объем инфузий приравнивали к группам сравнения (первой и второй).
В работе использовали следующие методы.
Оценку эндогенной интоксикации проводили по уровню токсических продуктов гидрофильной (молекулы средней массы) и гидрофобной природы (расчет резерва связывающей способности альбумина и индекса токсичности плазмы по альбумину на основе определения общей и эффективной концентрации альбумина).
Интенсивность процессов перекисного окисления мембранных липидов (ПОЛ) определяли по уровню первичных и вторичных молекулярных продуктов (диеновых и триеновых конъюгатов, малонового диальдегида) в плазме крови, а также в тканевых структурах печени, почек и кишечника. В указанных тканях определяли активность фосфолипазы А2 и супероксиддисмутазы.
Статистическую обработку результатов выполняли с помощью программы Statistica 7,0. Использовали оценку различий средних величин с помощью критерия t (Стьюдента), корреляционную зависимость – критерия r.
Результаты исследования и их обсуждение
Как указано выше, в работе исследованы две патологии, которые относятся к ургентным: острый перитонит и острый отечный панкреатит. Однако оба заболевания кардинально отличаются друг от друга. Различие заключается в том, что при первом в патогенезе превалируют воспалительные явления гнойного характера, при втором – воспаление протекает по асептическому варианту.
Такой методологический подход позволяет установить значение различных этиологических факторов в патогенезе эндогенной интоксикации, с одной стороны, и определить некоторые универсальные эндотоксикозиндуцированные процессы – с другой.
Выбранные модели оказались вполне адекватными для решения поставленной цели. У животных развивался острый перитонит или острый панкреатит.
Нами установлено, что в начальные сроки после моделирования у животных первых двух групп отмечались выраженные явления эндогенной интоксикации, о чем свидетельствовало значительное повышение в плазме крови животных токсических продуктов как гидрофильной (на 34,7–93,2%), так и гидрофобной природы (на 25,3–79,6%) (рис. 1).
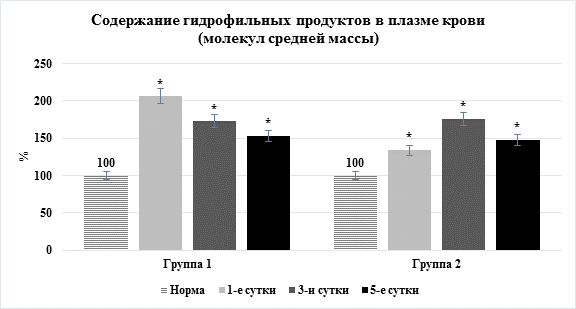
Рис. 1. Динамика содержания молекул средней массы в плазме крови (* – достоверность изменения показателя относительно нормы)
При изучении их содержания в динамике выявлен факт резкого их увеличения при остром перитоните в первые сутки после операции и на третьи сутки при остром панкреатите.
Интересные сведения нами получены при исследовании интенсивности перекисного окисления мембранных липидов.
Оказалось, что при обеих патологиях отмечено существенное повышение уровня молекулярных продуктов липопероксидации. Так, уровень начальных продуктов ПОЛ при остром перитоните повышался на 33,1–114,2% (p<0,05), вторичных – на 27,9–106,1% (p<0,05), при остром панкреатите – на 22,5–99,7% и 19,3–87,4% (p<0,05) соответственно. Отметим, что максимальное повышение интенсивности оксидативного стресса при остром перитоните выявлено в первые сутки после операции, при остром панкреатите – через трое суток (рис. 2).
Указанные расстройства гомеостатических констант сопровождались существенным снижением активности супероксиддисмутазы (на 12,5–38,4% (p<0,05) при остром перитоните и на 14,8–34,3% (p<0,05) при остром панкреатите).
Подчеркнем, что при обоих заболеваниях, особенно при остром панкреатите, в плазме крови резко повышалась фосфолипазная активность. Так, активность фосфолипазы А2 при остром перитоните повышалась в 1,7–4,3 раза (p<0,05), при остром панкреатите – в 4,4–9,8 раза (p<0,05).
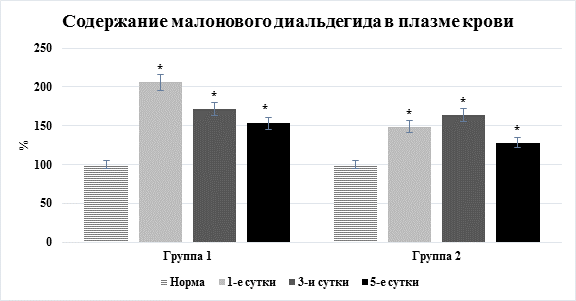
Рис. 2. Динамика содержания малонового диальдегида в плазме крови (* – достоверность изменения показателя относительно нормы)
При проведении корреляционного анализа установлено, что между содержанием в плазме крови токсических продуктов и интенсивностью липопероксидации, а также между первыми и активностью фосфолипазы А2 существует корреляционная зависимость: r=0,834–0,923 и 0,856–0,945 (p<0,05) соответственно.
Интересен для науки выявленный факт сопряженности выраженности эндогенной интоксикации при изученных заболеваниях с перекисным окислением мембранных липидов и фосфолипазной активностью тканевых структур исследованных органов (печени, почек и кишечника).
Оказалось, что как при остром перитоните, так и при остром панкреатите в тканях органов возникают существенная интенсификация (на 17,4–47,1% (p<0,05) в печени, на 12,2–39,8% (p<0,05) в почках, на 14,7–44,2% (p<0,05) в кишечнике) липопероксидации и активизация (на 22,3–78,2% (p<0,05) в печени, на 15,5–59,7% (p<0,05) в почках, на 19,0–82,9% (p<0,05) в кишечнике) фосфолипаз.
Статистические расчеты показали, что между содержанием в плазме крови токсических продуктов и интенсивностью липопероксидации, а также между первыми и активностью фосфолипазы А2 в тканях исследованных органов также имеется корреляционная зависимость: r=0,783–0,879 и 0,805–0,917 (p<0,05) соответственно.
Таким образом, анализ полученных результатов позволяет сделать важный вывод, что в патогенезе увеличения уровня токсических продуктов в плазме крови при острой хирургической патологии (на примере острого перитонита и острого панкреатита) важнейшую роль играют катаболические процессы, вызванные мембранодестабилизирующими явлениями, возникшими вследствие активизации перекисного окисления мембранных липидов и фосфолипаз. Следует обратить внимание на факт существования такого рода закономерности вне зависимости от характера воспалительного процесса. Важнейшим прикладным аспектом полученных результатов видим в разработке нового подхода в коррекции эндогенной интоксикации при ургентной патологии живота. В основе его положен принцип управления патологическим процессом по количественным и качественным изменениям основных мембранообразующих липидов – патофизиологических явлений, итогом которых являются мембранодестабилизирующие и/или мембранодеструктивные проявления. Непосредственным объектом для влияния на этот компонент патогенеза эндотоксикоза являются оксидативный стресс и активизация фосфолипаз.
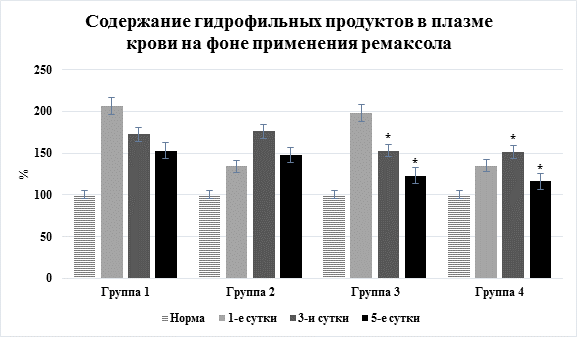
Рис. 3. Динамика содержания молекул средней массы в плазме крови на фоне применения ремаксола (* – достоверность изменения показателя относительно группы сравнения без применения ремаксола)
Указанное явилось научной базой для апробации в качестве инструмента воздействия на указанные триггерные механизмы препаратов, обладающих способностью их корригировать. С этой целью нами апробирован ремаксол, который обладает антигипоксантной, антиоксидантной и гепатопротекторной активностью.
Оказалось, что включение в терапию ремаксола приводило к заметному уменьшению выраженности эндогенной интоксикации как при остром перитоните, так и при остром панкреатите. Уровень токсических продуктов в плазме крови снижался уже после первого приема, а через трое суток эффект был отчетливым: достоверное снижение гидрофобных (на 12,4–24,2%) и гидрофильных (на 17,7–31,6%) токсических продуктов (рис. 3).
Уменьшение выраженности эндогенной интоксикации на фоне использования препарата сопровождалось уменьшением интенсивности перекисного окисления липидов и активности фосфолипаз.
Позитивное действие препарата на указанные процессы зарегистрировано также уже после первого его введения, а достоверный эффект – через трое суток, когда уровень молекулярных продуктов ПОЛ в плазме крови снижался при остром перитоните на 17,9–28,5% (p<0,05), при остром панкреатите – на 19,3–26,9% (p<0,05) (рис. 4), а активность фосфолипазы А2 – на 14,1–26,3% (p<0,05) и 37,4–48,1% (p<0,05) соответственно.
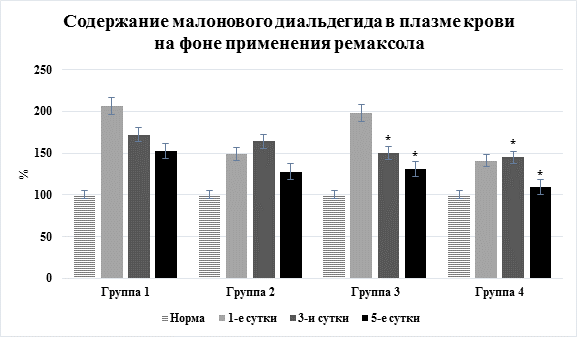
Рис. 4. Динамика содержания малонового диальдегида в плазме крови на фоне применения ремаксола (* – достоверность изменения показателя относительно группы сравнения без применения ремаксола)
Подчеркнем, что во многом аналогичный эффект влияния препарата определялся на органном уровне. Оказалось, что как при остром перитоните, так и при остром панкреатите в тканях органов происходило снижение интенсивности ПОЛ и активности фосфолипаз: в печени – на 11,2–29,1% и 8,1–17,3% (p<0,05) соответственно; в почках – на 9,0–18,4% и 7,4–16,6% (p<0,05) соответственно; в кишечнике – на 12,3–24,8% и 8,9–20,4% (p<0,05) соответственно.
Таким образом, полученные экспериментальные данные по апробации ремаксола подтверждают важность мембранодестабилизирующих явлений в патогенезе эндогенной интоксикации. Способность препарата снижать активность одних из триггерных механизмов мембранодеструктивных явлений неминуемо реализовывалась в уменьшении выраженности эндотоксикоза. Акцентируем внимание и на том, что указанный эффект определялся вне зависимости от характера воспалительного процесса брюшной полости, что также вносит определенный вклад в доказательную базу разработанной концепции.
Выводы. В патогенезе эндогенной интоксикации при острой хирургической патологии живота вне зависимости от характера воспалительного процесса важную роль играют катаболические процессы, обусловленные мембранодестабилизирующими явлениями вследствие избыточной активности липопероксидации и фосфолипаз.
С детоксикационной целью патогенетически обосновано применение терапии, направленной на уменьшение активности триггерных механизмов поражения биомембран клеток – основы катаболических процессов.
Библиографическая ссылка
Болотиских В.А., Власов А.П., Васильев В.В., Власова Т.И., Ганина М.В., Шейранова Н.С., Глушков В.М., Худайберенова Г.Д. ОБОСНОВАНИЕ НОВОГО ПОДХОДА В КОРРЕКЦИИ ХИРУРГИЧЕСКОГО ЭНДОТОКСИКОЗА РАЗЛИЧНОГО ПРОИСХОЖДЕНИЯ // Современные проблемы науки и образования. 2019. № 1. ;URL: https://science-education.ru/ru/article/view?id=28575 (дата обращения: 07.03.2026).
DOI: https://doi.org/10.17513/spno.28575



