Миксома сердца является редкой доброкачественной опухолью сердца мезенхимального происхождения, которая встречается у 0,5–1 на 1 млн у взрослого населения. Большой интерес в изучении данных новообразований обусловлен их уникальной локализацией (левая часть межпредсердной перегородки рядом с fossa ovalis), различными клиническими проявлениями и неустановленным гистогенезом [1–4].
Клинические проявления миксом сердца разнообразны и могут быть обусловлены размерами самой опухоли с нарушением ритма сердца, присоединением и прогрессированием тромбоза, тромбоэмболическими осложнениями в бассейне артерий большого круга кровообращения. Данные опухоли не всегда поддаются полноценной и адекватной прижизненной визуализации (ультразвуковое исследование, компьютерная томография), что в ряде случаев связано с различной плотностью структуры миксомы, наличием вторичного тромбоза в полости предсердий сердца [5, 6].
Макроскопическая оценка миксомы сердца порой бывает затруднительной из-за схожести ее с пристеночным тромбозом, так как она может иметь вид плоского или полиповидного образования [2, 7–9].
В последние годы в литературе активно обсуждаются вопросы гистогенеза, биологических свойств, клеточной активности миксом сердца. Различные морфо-иммуногистохимические исследования, посвященные оценке белков CD31, CD34, CD44 в структуре опухоли, указывают лишь на наличие сосудистого компонента, другие же, наоборот, акцентируют свое внимание на клеточном составе опухоли без оценки ее гистогенеза [4, 10–12].
Цель исследования – уточнить гистогенез миксомы сердца с помощью морфологического и иммуногистохимического методов исследований на примере секционного наблюдения.
Материалы и методы исследования. Было произведено собственное секционное наблюдение больной 71 года, получавшей лечение на базе клиники РостГМУ. Из истории болезни известно, что больная поступила по скорой помощи в тяжелом состоянии, обусловленном развитием инсульта. В течение ряда лет больная страдала постоянной формой мерцательной аритмии, артериальной гипертензией, в связи с чем постоянно принимала антиаритмические, антигипертензивные препараты.
СКТ выявила ишемические изменения в бассейне левой средней мозговой артерии, территориальный ишемический инсульт в бассейне правой средней мозговой артерии, правосторонний полушарный отек ткани головного мозга. ЭХО-КС выявило гипертрофию левого желудочка сердца, диастолическую дисфункцию левого желудочка 1-го типа, регургитацию на митральном клапане 1-й степени.
Проводимые лечебные мероприятия не дали положительного эффекта, и на фоне прогрессирующей сердечной и дыхательной недостаточности у больной наступила смерть спустя 8 суток от начала заболевания.
Морфологический этап исследования включал фиксацию ткани опухоли сердца и кусочков внутренних органов забуференным 10%-ным раствором формалина в течение 24 ч с последующей автоматизированной изопропиловой проводкой в гистопроцессоре Miele (производство Италия). После проводки кусочки тканей заливались в парафин и после микротомии толщиной срезов не более 3 мкм на микротомах фирмы Leica (производства ФРГ) окрашивались гематоксилином-эозином по Массону для выявления эластических и коллагеновых волокон соединительной ткани. Проводилось иммуногистохимическое исследование к антителу альфа-актин (ready to use, фирма DAKO) в иммуностейнере фирмы BOND (производство ФРГ). Микроскопический этап исследования выполнялся с помощью микроскопа фирмы Leica модель DM 1000 с цифровой фото-видеокамерой разрешением не менее 8,5 мегапикселей с увеличением 200, 400.
Результаты исследования и их обсуждение. На вскрытии наибольшие изменения были обнаружены со стороны сердечно-сосудистой системы. В полости ушка левого предсердия сердца, в проекции fossa ovalis, имелось три образования размерами 1,5х1,5 см, 1х0,5 см, 1х0,5 см, плотно прикрепленных к пристеночному эндокарду, серовато-розового цвета, дряблой консистенции, два из которых были покрыты плотными сухими кровяными свертками темно-красного цвета. Кроме того, в сердце имелись гипертрофия преимущественно левых отделов, диффузный мелкоочаговый кардиосклероз, рубцовые изменения в передней стенке левого желудочка.
В просвете интракраниального отдела правой внутренней сонной артерии имелся обтурирующий плотный сухой темно-красный свободно извлекающийся кровяной сверток (тромбоэмбол). Правое полушарие головного мозга было представлено дряблой кашицеобразной бесструктурной массой, что указывало на наличие полушарного ишемического инфаркта головного мозга. В остальных органах отмечались острое венозное полнокровие, дистрофические изменения.
Гистологическое исследование образований полости сердца выявило особенности их строения. Пристеночный эндокард левого предсердия был утолщен за счет развития миксоматоза, с формированием опухоли, представленной клеточным и экстрацеллюлярным компонентами.
Клеточный компонент опухоли был представлен вытянутыми, паукообразными, звездчатыми светлыми элементами, то строящими отдельные мозаичные и причудливые структуры, то расположенными поодиночке (рис. 1).
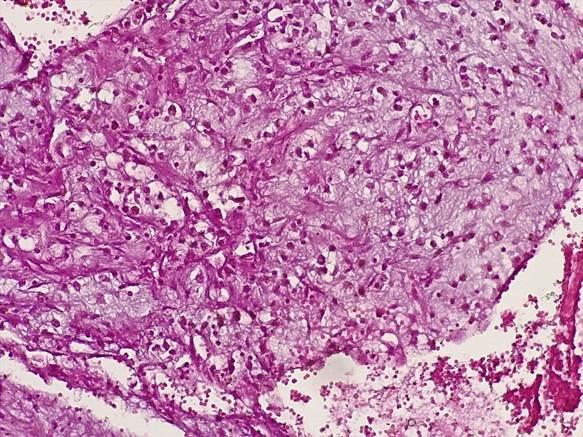
Рис. 1. Клеточный компонент миксомы представлен скоплением вытянутых, звездчатых элементов со светлой цитоплазмой среди миксоидной стромы. Окраска гематоксилином-эозином. Ув.х200
Экстрацеллюлярный компонент опухоли был представлен отечной эозинофильной стромой с признаками гиалиноза, содержащей тонкостенные кровеносные сосуды капиллярного типа, окруженные глыбками гемосидерина, светлыми и звездчатыми клеточными элементами (рис. 2). Обращало внимание, что светлые клеточные элементы опухоли содержали в цитоплазме гранулы гемосидерина (рис. 3).
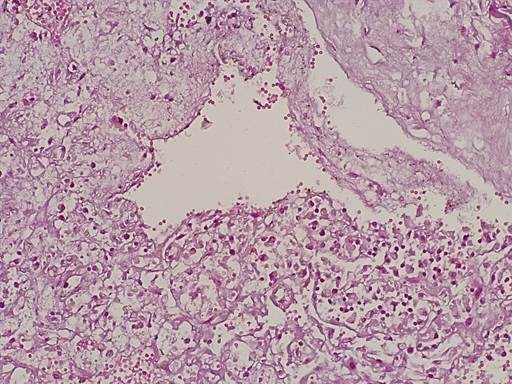
Рис. 2. Миксома содержит мелкие тонкостенные сосуды капиллярного типа, окруженные глыбками гемосидерина, светлыми и звездчатыми клеточными элементами. Окраска гематоксилином-эозином. Ув.х200
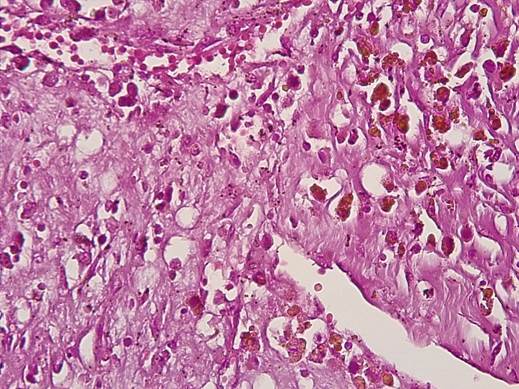
Рис. 3. Гемосидерин откладывается в светлых клетках миксомы.
Окраска гематоксилином-эозином. Ув.х400
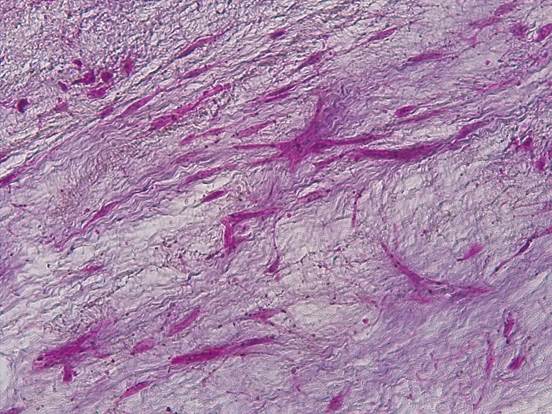
Рис. 4. Клетки миксомы представлены звездчатыми клеточными элементами, дающими позитивную реакцию в реакции Массона с докраской альфа-актином (ИГХ-реакция). Ув.х400
Для уточнения гистогенеза данных клеточных элементов опухоли была проведена комплексная гистохимическая и иммуногистохимическая окраска (реакция по Массону для выявления коллагеновых волокон, гладких миоцитов, иммуногистохимическая реакция с альфа-актином для выявления экспрессии гладких миоцитов).
Как видно на рисунке 4, клеточные элементы звездчатой формы давали положительную реакцию в окраске по Массону на альфа-актин, что указывало на то, что они являются трансформированными гладкими миоцитами, а окружающее их межклеточное вещество с обилием гликопротеинов может быть результатом их секреторной активности.
Данные морфологические, гистохимические признаки указывали на наличие доброкачественной опухоли сердца сложного строения – миксомы, а содержащиеся в ней новообразованные тонкостенные сосуды, признаки гемосидероза указывали на наличие рецидивирующих кровоизлияний в опухоли.
Можно полагать, что обилие кровоснабжения и клеточный состав миксомы могли способствовать формированию пристеночных тромбов в предсердии с развитием тромбоэмболического синдрома (тромбоэмболии интракраниального отдела правой внутренней сонной артерии с развитием правостороннего ишемического инфаркта головного мозга).
Среди опухолей сердца миксома является наиболее редкой и малоизученной патологией. Такое заболевание чаще всего обнаруживают при аутопсийном исследовании в связи со сложностями проведения прижизненной дифференциальной диагностики, в том числе с использованием УЗИ или МРТ сердца. В клиническом отношении наиболее опасно возникновение таких осложнений миксомы, как образование пристеночного тромба с последующей тромбоэмболией артерий большого и малого круга кровообращения. Согласно литературным данным результаты морфологических и иммуногистохимических исследований противоречивы и не дают полного представления о гистогенезе опухоли. В этой связи нами приводится описание секционного наблюдения умершей женщины 71 года с миксомой правого предсердия. Особенностью ее строения было сочетание клеточного и экстрацеллюлярного компонентов с выраженным миксоматозом стромы и обилием новообразованных тонкостенных сосудов капиллярного типа. Клеточный компонент опухоли был представлен клетками вытянутой и звездчатой формы, имеющими иммунофенотип гладких миоцитов (позитивная экспрессия альфа-актина при иммуногистохимическом исследовании). Экстрацеллюлярный компонент опухоли был представлен отечной эозинофильной стромой с признаками гиалиноза, содержащей тонкостенные кровеносные сосуды капиллярного типа, окруженные глыбками гемосидерина .
Таким образом, миксома сердца представляет собой редкую доброкачественную мезенхимальную опухоль, основным клеточным компонентом которой являются гладкие миоциты, которые совместно с гликопротеинами межуточного вещества опухоли могут являться ангиогенными факторами и способны принимать участие в развитии и прогрессировании тромбоза опухоли [13–15]. Данные факты следует принимать во внимание при разработке тактики ведения таких больных с использованием таргетных антиангиогенных (ингибиторов ангиогенеза) препаратов.
Библиографическая ссылка
Тодоров С.С., Сидоров Р.В., Дерибас В.Ю., Казьмин А.С., Кузнецов И.И., Насытко А.Д., Осипова А.В. К ВОПРОСУ О ГИСТОГЕНЕЗЕ МИКСОМЫ СЕРДЦА // Современные проблемы науки и образования. 2019. № 1. ;URL: https://science-education.ru/ru/article/view?id=28555 (дата обращения: 15.01.2026).



