Для успешной трансплантации комплекса тканей первостепенное значение имеет строение сосудистого русла, у которого могут быть свои особенности. Одним из методов реконструкции пальцев кисти при посттравматических деформациях и врожденных пороках является микрохирургическая аутотрансплантация пальцев стопы [1, 2]. Большое разнообразие патологии верхней конечности врожденного и приобретенного характера обязывает пристально изучать вопрос сосудистого строения донорской и реципиентной зон, поскольку правильное выделение сосудистой ножки трансплантата и выбор источника кровоснабжения в реципиентной зоне определяют ближайший результат операции – приживление пальца на кисти [3, 4].
Согласно данным литературы большинство осложнений сосудистого характера при микрохирургических пересадках пальцев стопы связано с погрешностями техники выделения трансплантатов, недостаточностью их кровоснабжения из-за неправильного выбора питающих артерий, а также из-за недооценки адекватности артериального и венозного кровотока в реципиентной области [5–7].
В настоящее время имеют место единичные публикации об особенностях ангиоархитектоники пальцев стоп у детей при их использовании в качестве донорских аутотрансплантатов при микрохирургических реконструкциях пальцев кисти [8, 9]. По данным исследования А.А. Щербаковой (1955), артериальное кровоснабжение пальцев стопы можно разделить на 3 типа:
1) дорзальный – с преобладанием a. dorsalis pedis;
2) подошвенный – при преимущественном развитии подошвенных артерий;
3) равномерный – при симметричном развитии обоих артериальных стволов [10].
Статьи, посвященные топографической анатомии артерий первого межплюсневого промежутка, в свете микрохирургических аутотрансплантаций также носят единичный характер. Так, на основе данных Leungс с соавторами (1983) было выделено 7 типов кровоснабжения первого и второго пальцев стоп в зависимости от расположения и размеров 1-й тыльной плюсневой артерии (1ТПА). Однако данное исследование не учитывало строение и использование 1-й подошвенной плюсневой артерии (1ППА), пересадка пальцев на подошвенных артериях не рассматривалась [11].
В наших ранее опубликованных работах [12] выделены основные разновидности питания аутотрансплантатов: через систему a. tibialisanterior 70,7% при врожденной патологии и 77,4% в случаях приобретенной патологии, через систему a. tibialisposterior соответственно 29,3% и 22,6%. Источником питания в 25,9% случаев врожденной патологии и 37,9% приобретенной служила 1ТПА. Питающим артериальным стволом второго пальца в 17,1% случаев врожденной и 16,9% приобретенной патологии являлась подошвенная плюсневая артерия, анастамозирующая с тыльной артерией стопы глубокой подошвенной ветвью. В 8%, по данным автора, питание трансплантата осуществлялось за счет подошвенных плюсневых артерий ввиду полного отсутствия системы тыльных артерий.
Kay и Wiberg (1996) произвели свободную пересадку пальцев стопы на кисть у 40 пациентов в возрасте от 9 месяцев до 14 лет. 1ТПА использовалась в 66% случаев, а в 34% случаев – 1ППА. Также было отмечено в одном наблюдении использование 2ППА ввиду повреждения 1ППА при проведении оперативного вмешательства [13].
Цель исследования – показать роль и значение исследования микрососудистого строения донорской и реципиентной зон для успешной микрохирургической аутотрансплантации пальцев стопы у детей.
Материалы и методы исследования
Исследование основано на данных обследования и лечения с 2000 по 2018 годы в НИДОИ им Г.И. Турнера 541 ребенка от 8 месяцев до 17 лет с врожденными пороками развития и посттравматическими деформациями верхней конечности. Пациенты мужского пола составили 45,2% (244 наблюдения), женского пола – 54,8% (297 наблюдений). Всего перемещено 696 аутотрансплантатов. В 522 случаях произведена пересадка одного пальца стопы (второй палец – 95%, третий, четвертый и пятый пальцы – 5%), также в 174 случаях выполняли аутотрансплантацию блока второго-третьего пальцев.
Выделение аутотрансплантата пальцев стоп начинали с фигурного разреза по тылу стопы в проекции первого межплюсневого промежутка, который продлевали через первый и второй межпальцевые промежутки на подошвенную поверхность стопы. Далее из окружающих тканей выделялась большая подкожная вена. Следующим этапом проводилось пересечение сухожилия короткого разгибателя первого пальца. Затем визуализировали тыльную артерию стопы (ТАС) и ее продолжение в виде 1-й тыльной плюсневой артерии (ТПА). Разрез продлевали через первый и второй межпальцевые промежутки на подошвенную поверхность стопы. В первом межпальцевом промежутке выделяли 1-ю подошвенную плюсневую артерию (ППА) от места ее бифуркации, затем в проксимальном направлении, до ее слияния с подошвенной артериальной дугой. Таким же образом производилось выделение 2-й ППА, а также 3-й подошвенно-плюсневой артерии, если в состав трансплантата входил блок двух пальцев. Данный этап подразумевал обязательную идентификацию глубокой артериальной ветви, связывающей тыльную и подошвенную системы кровообращения. Одномоментно с этим выполнялась мобилизация подошвенных пальцевых нервов и сухожильного аппарата пальцев стопы. При выявлении на этапе выделения гипоплазии или аплазии каких-либо артерий стопы этапность операции не меняли.
После подготовки реципиентной области трансплантат(-ы) переносили на кисть. Остеосинтез производили спицами 1,0 мм. Далее проводилось наложение анастомозов между сухожилиями и нервами трансплантата и соответствующими структурами реципиентной области. В качестве реципиентных артерий в большинстве случаев использовали a. radialis и a. ulnarisартерии на уровне кистевого сустава. Анастомозирование вен проводилось с ветвями v. basilica и v. cefalica.
В случаях недостаточности длины питающей ножки трансплантата (менее 4,0–5,0 см) для анастомозирования использовались ладонная артериальная дуга и (или) общие пальцевые артерии. В тех случаях, когда отмечалось недоразвитие сосудов на уровне запястья (диаметр сосуда менее 1,0 мм, низкая скорость кровотока), анастомозы с a. radialis и a. ulnaris накладывали проксимальнее (на предплечье). В случаях аплазии или гипоплазии вышеуказанных артерий использовались другие артерии предплечья (тыльная межкостная, срединная и плечевая артерии). Для восполнения длины артериальной ножки трансплантата применяли аутовенозную вставку из v. saphena magna.
Результаты исследования и их обсуждение
Правила выделения сосудов в донорской области
По данным проведенного нами исследования выявлено, что трансплантат второго пальца стопы может преимущественно кровоснабжаться из бассейна как a. tibialis anterior, так и a. tibialisposterior. Тыльная артерия стопы, являясь продолжением a. tibialis anterior, обеспечивает адекватное кровоснабжение аутотрансплантатов в 79% (550 трансплантатов). В 21% случаев (146 трансплантатов) питание осуществлялось из a. tibialis posterior и сопровождалось полным отсутствием или выраженной гипоплазией a. dorsalis pedis. Диаметр сосудистой ножки трансплантата варьировал в зависимости от возраста пациентов и степени развития конечностей (при врожденной патологии). В среднем диаметр питающих артерий составил от 1,5 до 2,5 мм. Однако в некоторых случаях, когда из-за анатомических особенностей нам приходилось брать трансплантаты на короткой сосудистой ножке (менее 3 см), то есть на уровне плюсневых артерий, диаметр сосудов мог составлять 1 мм и менее. При стандартном выделении сосудистой ножки трансплантата (в случае нормально развитой тыльной артерии стопы) удавалась заимствовать ее на протяжении до 6–7 см. Для определения интенсивности кровотока в трансплантатах в основном оценивали следующие параметры: цвет и температуру поверхности трансплантата и скорость капиллярного ответа. В некоторых случаях для определения насыщенности кислородом тканей трансплантата использовали накожный датчик пульсоксиметра.
При наличии ТАС кровоснабжение второго и третьего пальцев стопы может происходить за счет тыльных и подошвенных плюсневых артерий. В 68% 1-я ТПА могла быть использована в качестве одного из кровоснабжающих сосудов трансплантата, так как имела хорошее развитие (рис. 1), в оставшемся проценте случаев (32%) она была резко гипоплазирована (менее 0,5 мм в диаметре) либо полностью отсутствовала.
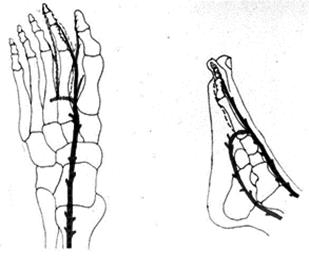
Рис.1. Вариант преобладания тыльного артериального кровоснабжения трансплантата пальца стопы (схема)
По данным ранее проводимых нами исследований [12] при наличии и хорошем развитии тыльной плюсневой артерии считали, что дальнейшее выделение остальных артериальных стволов нецелесообразно. Но, столкнувшись с серьезными осложнениями, которые проявлялись недостаточностью артериального кровотока в аутотрансплантате, при последующих оперативных вмешательствах мы стали выделять все артерии тыльной и подошвенной систем кровообращения.
Когда ТАС и 1-й ТПА были хорошо развиты, нами обнаружены различные сочетания кровоснабжающих палец артерий. Особо хочется отметить несколько случаев, когда отсутствовала связь 1-й ППА с подошвенной артериальной дугой. Данная артерия залегала над апоневрозом, в поверхностных слоях подошвы стопы. В такой ситуации выделяли 1-ю ТПА и 2-ю ППА, анастамозировавшие с ТАС через глубокую артериальную ветвь. 1-ю ППА выделяли на максимально возможном протяжении, при необходимости на кисти выполняли дополнительный микрососудистый анастомоз (диаграмма 1).
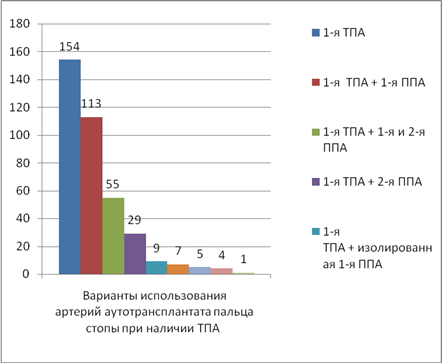
Диаграмма 1. Варианты кровоснабжения аутотрансплантатов при наличии ТПА
В случаях гипоплазии или аплазии ТПА выделение аутотрансплантата производили на подошвенных плюсневых артериях, которые отходят от подошвенной артериальной дуги и через глубокую артериальную ветвь, соединенных с ТАС (диаграмма 2).
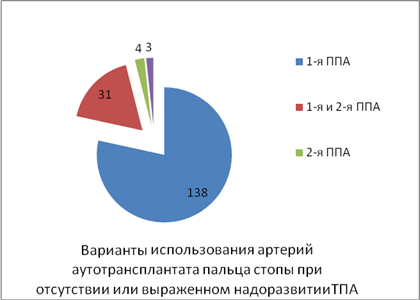
Диаграмма 2. Варианты кровоснабжения аутотрансплантатов при наличии ТПА
ТАС в 21% наблюдений была недоразвита или полностью отсутствовала, что требовало формировать аутотрансплантат на подошвенных артериях. В таких случаях приступали к этапу выделения 1-й ППА. Основным питающим сосудом в 36% случаев был выделенный фрагмент подошвенной артериальной дуги и в 64% мобилизовывались исключительно дистальные артериальные стволы – плюсневые артерии (ППА и ТПА) (рис. 2, 3).
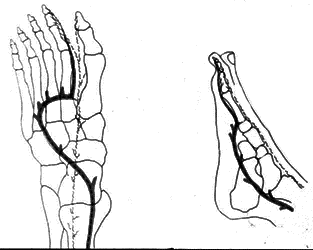
Рис.2. Вариант кровоснабжения трансплантата из системы задней большеберцовой артерии (схема)
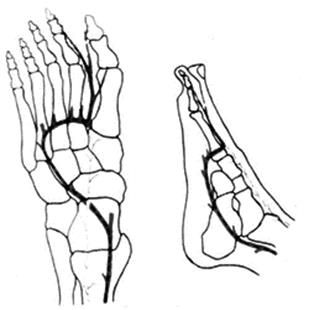
Рис.3. Вариант кровоснабжения трансплантата из подошвенной артериальной дуги с продолжением в тыльную систему кровоснабжения (через глубокую артериальную ветвь) (схема)
В диаграммах 3 и 4 приведены различные варианты кровоснабжения аутотрансплантата, которые применялись при заимствовании на фрагменте подошвенной артериальной дуги и на дистальных плюсневых артериях.
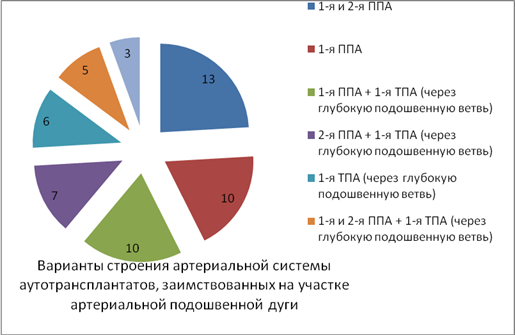
Диаграмма 3. Варианты кровоснабжения аутотрансплантатов, заимствованных на участке артериальной подошвенной дуги
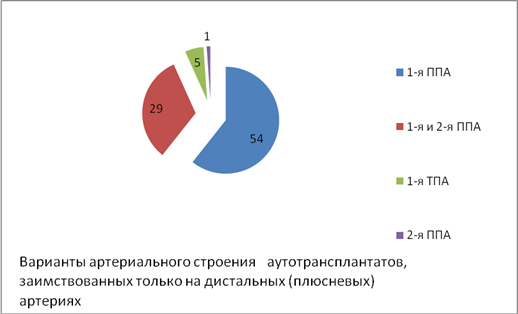
Диаграмма 4. Варианты кровоснабжения аутотрансплантатов, заимствованных на дистальных (плюсневых артериях)
Принципы подготовки питающих сосудов в реципиентной области
Для выбора и подготовки питающего сосуда в реципиентной области во внимание принимали два основных показателя – соразмерный диаметр и высокую интенсивность кровотока [14, 15]. При неправильной оценке данных показателей у детей в послеоперационном периоде возникали сосудистые осложнения, вызванные недостаточностью кровообращения в аутотрансплантате. При тяжелых врожденных аномалиях верхней конечности степень гипоплазии могла быть настолько велика, что затрагивала дистальные отделы a. radialis и a. ulnaris. При таком развитии событий приходилось накладывать артериальный анастомоз более проксимально, вплоть до уровня дистальной трети плеча, с использованием аутовенозной вставки. В некоторых случаях использовались тыльная межкостная артерия, срединная и плечевая артерии.
Выбор питающего сосуда верхней конечности тоже определялся вариантом ангиоархитектоники донорской области. Стандартными вариантами подключения сосудов считались сосудистые анастомозы с a. radialis и a. ulnaris. Они использовались в случаях достаточной длины донорской артерии. Сосудистые анастомозы с ладонной артериальной дугой или общей ладонной пальцевой артерией применялись в случае короткой артериальной ножки аутотрансплантата (3,0 см и менее). При одномоментной транспозиции двух аутотрансплантатов с обеих стоп в качестве кровоснабжающего сосуда применяли одну артерию. Если питающая артерия имела адекватный диаметр (менее 0,9 мм) и отличалась высокой интенсивностью кровотока, то после ее пересечения для кровоснабжения обоих аутотрансплантатов использовали обе части пересеченного сосуда. В данном случае в качестве питающей артерии использовали a. radialis, a. ulnaris или ладонную артериальную дугу (таблица).
Варианты подключения сосудов на верхней конечности
|
Выбор питающего сосуда |
Пересадка одного аутотрансплантата |
Одномоментная пересадка двух аутотрансплантатов |
|
А. radialis |
235 |
– |
|
А. ulnaris |
84 |
– |
|
Ладонная артериальная дуга |
19 |
– |
|
Общая ладонная пальцевая артерия |
23 |
– |
|
Тыльная межкостная артерия |
5 |
– |
|
Плечевая артерия (ветвь или анастомоз «конец в бок») |
10 |
– |
|
Срединная артерия |
1 |
– |
|
Проксимальный и дистальный фрагменты a. radialis после ее пересечения |
– |
107 |
|
Проксимальный и дистальный фрагменты a. ulnaris после ее пересечения |
– |
13 |
|
Проксимальный и дистальный фрагменты ладонной артериальной дуги после ее пересечения |
– |
11 |
|
Две общие ладонные пальцевые артерии |
– |
21 |
|
Проксимальные фрагменты a. radialis и a. ulnaris |
– |
5 |
|
Проксимальный фрагмент a. radialis и общая ладонная пальцевая артерия |
– |
6 |
Осложнения, связанные с нарушением кровотока в пересаженных аутотрансплантатах, зависели от многих факторов, в том числе от размеров и диметра сосудистой ножки. В случаях достаточного диаметра сшиваемых сосудов (более 2 мм) риск тромбообразования снижался до минимума, тогда как при более мелких размерах либо недостаточности длины сосудистой ножки (когда приходилось использовать венозную вставку) риск возникновения осложнений, связанных с тромбозом в зоне анастомоза, повышался.
Выводы
1. При кровоснабжении трансплантата из a. tibialis anterior (79%) в 68% случаев определялась хорошо развитая тыльная плюсневая артерия, при этом в 32% случаев кровоснабжение трансплантата осуществлялось только за счет подошвенных плюсневых артерий. Данные, полученные в результате исследования, соответствуют данным зарубежных авторов [6, 9].
2. Методика хирургического выделения аутотрансплантатов пальцев стоп остается неизменной и не зависит от вариантов ангиоархитектоники донорской области. При мобилизации аутотрансплантата второго или блока второго-третьего пальцев стопы необходимо производить выделение всех имеющихся артерий – тыльных и подошвенных, обеспечивая тем самым наиболее адекватное кровоснабжение аутотрансплантата, снижая риски возникновения сосудистых осложнений в послеоперационном периоде.
3. Адекватный диаметр и высокая пропускная способность питающего сосуда в реципиентной области необходимы для обеспечения достаточной перфузии тканей трансплантата.
4. От качества мобилизации сосудов донорской и подготовки таковых в реципиентной области зависят приживление перемещенного микрососудистого аутотрансплантата и, соответственно, успех микрохирургического вмешательства.
Сокращения:
ТАС – тыльная артерия стопы;
1ТПА – 1-я тыльная плюсневая артерия;
1ППА – 1-я подошвенная плюсневая артерия
Библиографическая ссылка
Голяна С.И., Гранкин Д.Ю. АНГИОАРХИТЕКТОНИКА СОСУДОВ, ПИТАЮЩИХ АУТОТРАНСПЛАНТАТ ВТОРОГО ПАЛЬЦА СТОПЫ, И ВАРИАНТЫ ИХ «ПОДКЛЮЧЕНИЯ» К РЕЦИПИЕНТНЫМ СОСУДАМ ПРИ ПЕРЕСАДКЕ НА КИСТЬ У ДЕТЕЙ // Современные проблемы науки и образования. 2018. № 6. ;URL: https://science-education.ru/ru/article/view?id=28367 (дата обращения: 05.01.2026).
DOI: https://doi.org/10.17513/spno.28367



