Синдром диабетической стопы (СДС) поражает около 8–10% людей, страдающих сахарным диабетом. Он представлен язвенно-некротическими осложнениями стоп разной тяжести в 85% случаев. Первичной причиной ампутаций конечностей при сахарном диабете служит синдром диабетической стопы. В настоящее время, несмотря на очевидный прогресс во всех областях хирургии, эффективное лечение язвенно-некротических форм синдрома диабетической стопы по-прежнему остается приоритетной задачей, и результаты при этом лечении далеки от совершенства [1-3].
У 47% больных с синдромом диабетической стопы лечение данной патологии начинается позднее возможного. В результате более позднего начала терапии увеличиваются смертность данных пациентов в 2 раза, стоимость лечения и, как следствие, реабилитации данной категории больных в 3 раза [4]. Улучшение тактики диагностирования, диспансеризации и лечения данной категории пациентов позволит уменьшить частоту ампутаций у больных на 43–85% [5].
При синдроме диабетической стопы с выраженными атеросклеротическими поражениями артерий ног и имеющимися трофическими нарушениями одной из методик спасения нижних конечностей является комплексная консервативная внутриартериальная терапия, направленная на улучшение микроциркуляции в ране и реологии крови, стимуляцию развития сосудистых коллатералей, повышение концентрации антибиотика в патологическом очаге [6].
Применение современных методов воздействия на раневой процесс способствует наилучшему ускорению заживления ран и улучшению показателей лечения пациентов при воспалительных процессах. Одной из таких инновационных отечественных методик лечения ран и раневых инфекционных процессов оказалась терапия NO-содержащими плазменными потоками с помощью отечественного аппарата «Плазон». Созданный отечественными учеными уникальный аппарат «Плазон» генерировал на выходе воздушно-плазменный поток экзогенного монооксида азота.
Спектр лечебного воздействия на биологические ткани и на область воспалительного очага NO-содержащей газообразной плазмы разнообразен и высокоэффективен. Направленные на рану плазменные потоки экзогенного монооксида азота от аппарата «Плазон» эффективно и без осложнений осуществляют многосторонние лечебные воздействия (антибактериальное, устранение воспаления и отека мягких тканей), активизируют микроциркуляцию, в разы ускоряют заживление инфицированных ран [7].
Проведенные в течение нескольких лет клинические исследования применения экзогенного монооксида азота отечественным аппаратом «Плазон» подтвердили целый спектр лечебных эффектов в лечении инфицированных форм синдрома диабетической стопы (особенно выраженную антибактериальную и биостимулирующую активность на раневой процесс), ускоряющих заживление инфицированных ран в 2 раза и усиливающих кровоснабжение нижних конечностей [8].
Цель исследования: сравнить изменения критериев воспаления в ране при применении экзогенного монооксида азота и внутриартериальной терапии в комплексном лечении язвенно-некротических поражений при синдроме диабетической стопы.
Материалы и методы исследования. В основу исследования положен анализ 84 клинических случаев. Все пациенты, включенные в исследование, имели язвенно-некротические поражения вследствие синдрома диабетической стопы и проходили лечение с применением общепринятой комплексной терапии, назначаемой в стационарах при появлении вышеуказанных осложнений.
Критерием включения было наличие у пациентов язвенно-некротических осложнений при синдроме диабетической стопы вне зависимости от локализации, количества и объема распространения язвенно-некротических дефектов. Всем больным при поступлении выполнялось дуплексное сканирование сосудов нижних конечностей. В исследование были включены только пациенты, которым невозможно было выполнить сосудистые реконструктивные операции. У всех пациентов был сахарный диабет 2-го типа. В исследовании представлены только результаты лечения больных с синдромом диабетической стопы, которые имели изменения со 2-й по 4-ю степень по классификации Wagner F.W.
К критериям исключения отнесены: возможность выполнения сосудистых реконструктивных операций для восстановления кровотока, сахарный диабет 1-го типа, так как у данной категории пациентов язвенно-некротические изменения наступают раньше и прогрессируют быстрее, что исключает возможность сравнения их с пациентами, имеющими сахарный диабет 2-го типа, изменения с 1-й и 5-й степенью по классификации Wagner F.W., так как 1-я степень не подразумевает язвенно-некротических осложнений, а 5-я не подразумевает консервативного лечения.
Большая часть пациентов, которые были включены в данную работу, находились в работоспособном возрасте – от 30 до 60 лет: в первой группе – 28 (71,7%), во второй группе – 36 (80%) пациентов, что является немаловажным фактором. Но, даже учитывая этот факт, нельзя не обратить внимание на достаточно значительный удельный вес пациентов пожилого и старческого возраста: в первой группе – 11 (28,3%), во второй группе – 9 (20%) больных. Но необходимо отметить, что данная ситуация характерна для группы пациентов, имеющих язвенно-некротические осложнения синдрома диабетической стопы.
Принявшие участие в исследовании пациенты были разделены на две полностью равнозначные клинические группы.
В первую группу были включены 39 пациентов, проходивших лечение с назначением традиционной комплексной терапии. В качестве дополнительного метода терапии использовалась местная обработка язвенно-некротического дефекта и окружающих его тканей плазменным потоком, содержащим молекулы экзогенного монооксида азота. Получение последнего возможно при применении современного аппарата «Плазон».
В основу методики положены современные плазменно-хирургические технологии, применение которых возможно при использовании аппарата «Плазон». При выполнении исследования, во время обработки ран аппарат настраивался на терапевтический режим. Диаметр канала для вывода монооксида азота составлял 2 мм, что в свою очередь позволяло получать низкотемпературные (25–40°С) газовые потоки с повышенным содержанием молекул монооксида азота (до 2000–3000 ррm). Экспозиция составляла 30 секунд на 1 см2, удаленность манипулятора от поверхности язвенно-некротического дефекта – 5 см. Обработка язвенно-некротических дефектов осуществлялась ежедневно. В тех случаях, когда у больного имели место тканевые некротические изменения, было выполнено их термическое удаление, с этой целью применялся режим коагуляции.
Основу второй группы составили 45 больных. Данной категории пациентов применялась общепринятая комплексная терапия в сочетании с внутриартериальной терапией.
При проведении внутриартериальной терапии инъекционно (попеременно в правую и левую конечности) в бедренную артерию вводились спазмолитики, антибиотики, антикоагулянты и антиоксиданты (депротеинизированный гемодериват из крови телят). Введение препаратов осуществлялось ежедневно в течение 10 суток.
Интенсивность клинических изменений процессов, происходящих в ране, определялась путем оценки ряда показателей: ежесуточного мониторинга температурных показателей кожных покровов, оценки динамических показателей болевого синдрома, изменения динамики отечности тканей вокруг язвенно-некротического дефекта, количественных показателей отделяемого из раневого дефекта, а также скорости появления в ране грануляционной ткани.
Флора язвенно-некротического дефекта оценивалась путем взятия посевов раневого отделяемого на 1-е и 7-е сутки, так как на 1-е сутки назначалась антибактериальная терапия, а на 7-е сутки требовалась ее коррекция или отмена. На конечном этапе оценка флоры язвенно-некротического дефекта не проводилась, так как полученные данные не повлияли бы на проводимую терапию вследствие отмены или коррекции антибактериальной терапии на 7-е сутки.
Как вариант лабораторного контроля применялся метод контроля лейкоцитоза в общем анализе крови. Также оценивалась напряженность лейкоцитарной формулы, с этой целью нами использовался метод определения лейкоцитарного индекса интоксикации (ЛИИ). В качестве временного контроля применяемых методов выбраны 1-е, 5-е, 10-е и 15-е сутки проведения терапии пациенту в условиях лечебного учреждения.
Лейкоцитарный индекс интоксикации представляет собой один из важнейших критериев, характеризующих ответ процессов воспаления в человеческом организме. Косвенно данный показатель указывает на присутствие или отсутствие осложнений при протекании воспалительных процессов непосредственно в ране. В данном исследовании применялась норма лейкоцитарного индекса интоксикации, равная 0,6–1,5. Расчет ЛИИ проводился по формуле Кальф-Калифа.
Обработка статистических данных осуществлялась с использованием статистических компьютерных программ «IBM®SPSS® Statistics 21» и Microsoft Office® Excel® 2010. Для анализа данных в ходе нашего исследования использовалось сопоставление таблиц. В таблицах оценивалось значение χ2-квадрат. В получаемых результатах статистического анализа за значение, называемое критическим пределом значимости «р», принято 0,05.
Результаты исследования и их обсуждение. Всем пациентам первой и второй групп выполнялось измерение температуры тела во время поступления. Из 45 пациентов, входящих в состав второй группы, у 34 (75,5%) имела место гипертермия тела, в то время как в первой группе гипертермия кожных покровов отмечалась у 27 (69,2%) из 39 больных (р=0,333).
Окончательная стабилизация нормотермии тела (за норму принята температура тела менее 37,0°С) у пациентов, которые получали внутриартериальную терапию, происходила к 5,16±1,2 суткам, у больных, которым применялся экзогенный монооксид азота, – к 6,72±1,54 суткам (р=0,646).
Интенсивность динамики болевого синдрома исследовалась путем ежедневного сбора данных у пациентов на предмет присутствия у них болевого синдрома в ране. Болевой синдром в месте язвенно-некротического дефекта купировался у пациентов в первой группе в среднем к 2,88±0,53 дню, группы два – в среднем к 4,39±0,6 дню (р=0,003).
Изменение динамики отечности окружающих рану тканей оценивалось визуально – путем каждодневного осмотра ран во время перевязок. Пастозность тканей, окружающих язвенно-некротический дефект, исчезала во второй группе в среднем к 5,79±0,97 суткам, в первой группе – к 4,25±0,54 суткам (р<0,001).
В зависимости от пропитывания материала раневым отделяемым оценивался объем продукции экссудата из раны. Снижение продукции раневого отделяемого из язвенно-некротического дефекта во второй группе было отмечено в среднем к 4,86±1,4 суткам, а в первой группе – к 1,77±0,41 суткам (р<0,001).
Во второй группе активные грануляции появлялись в усредненном значении на 5,65±1,25 сутки, в первой группе – на 4,79±0,41 сутки (р<0,001). Полученные результаты клинических показателей воспалительного процесса в ране обеих групп для сравнения объединены в таблице.
Клинические показатели воспалительного процесса в ране обеих групп при использовании терапии язвенно-некротических осложнений
синдрома диабетической стопы
|
Группы |
Клинические показатели воспалительного процесса язвенно-некротического дефекта |
||||
|
Температура тела |
Болевой синдром |
Отек окружающих тканей |
Раневое отделяемое |
Грануля-ционная ткань |
|
|
Первая группа (n=39) |
5,16±1,2 |
2,88±0,53 |
4,25±0,54 |
1,77±0,41 |
4,79±0,41 |
|
Вторая группа (n=45) |
6,72±1,54 |
4,39±0,6 |
5,79±0,97 |
4,86±1,4 |
5,65±1,25 |
|
Критерий χ2 |
р=0,646 |
р=0,002 |
р<0,001 |
р<0,001 |
р<0,001 |
В результате проведенного исследования выявлено, что пейзаж микробной флоры язвенно-некротических поражений, возникших в результате осложнений синдрома диабетической стопы, в каждом случае представлен ассоциациями микроорганизмов. По этой причине микрофлора оценивалась в общем для обеих групп.
Дрожжевые грибы составили 1,3% от общего числа случаев. Представителями грамотрицательной микрофлоры оказались бактерии рода энтеробактерии (29,8%), псевдомонады (21,9%), гемофилус (3,4%). Грамположительная микрофлора была представлена следующими возбудителями: стрептококк – 23,2%, стафилококк – 20,4%.
Полное отсутствие микрофлоры в посеве на 7-е сутки отмечено у 29 (74,9%) пациентов первой группы, во второй группе – у 36 (80%) человек (р=0,005). Все полученные данные посевов обобщены и представлены на диаграмме (рисунок).
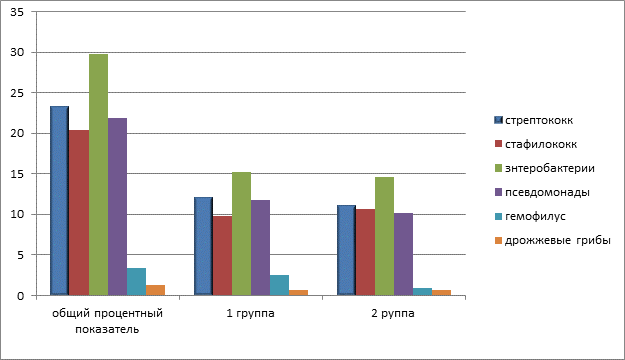
Микробный пейзаж язвенно-некротических дефектов при синдроме диабетической стопы на 7-е сутки проводимой терапии
Колебание динамики уровня лейкоцитов принято считать одним из важнейших методов лабораторного контроля воспалительных процессов в организме человека. В данной работе значение лейкоцитоза определялось в 1-е сутки проведения терапии. В первой группе пациентов данный критерий был равен 11,58±1,06×109/л, во второй – 11,23±1,38×109/л. Показатели числа лейкоцитов, полученные на старте терапии, в обеих группах статистически были практически одинаковыми при одинаковой степени поражений по классификации Wagner F.W. В то же время разница значений лейкоцитоза на начальном этапе терапии в ранах статистически не доказана (р=0,654).
При контроле на 5-е сутки терапии раневого процесса: лейкоцитоз (более 11×109/л) во второй группе был у 12 (30,7%) больных, в первой группе – у 16 (35,5%) пациентов. Значение лейкоцитов в первой группе составило в среднем 12,29±3,38×109/л, в группе два – 10,75±1,57×109/л (р=0,514). Значение критерия достоверности р составило 0,074.
На 10-е сутки наблюдения за раневым процессом уровень лейкоцитоза был 12,48±2,57×109/л для второй группы, а в первой группе он составлял 8,74±1,8×10/л (р=0,215). Лейкоцитоз (более 11×109/л) во второй группе отмечался у 10 (25,6%), у пациентов первой группы – у 9 (20%) (р=0,107).
На 15-е сутки терапии раневого процесса уровень лейкоцитов во второй группе составил 7,25±2,28×109/л, а в первой – 6,61±0,89×109/л (р=0,922). Лейкоцитоз (более 11×109/л) во второй группе был у 5 (12,8%) пациентов, а в первой – у 4 (8,8%) (р=0,043).
Начальный уровень лейкоцитарного индекса интоксикации (1-е сутки) более 1,5 во второй группе был в 27 (60%) случаях, а в первой группе – в 23 (58,9%) случаях (р=0,846 по критерию χ2).
На 5-е сутки уровень лейкоцитарного индекса интоксикации выше нормы во второй группе был в 24 (53,3%) наблюдениях, в первой группе – в 22 (56,4%) (р=0,327 по критерию χ2). На 10-е сутки уровень лейкоцитарного индекса интоксикации выше нормы был у 19 (42,2%) больных второй группы, тогда как в первой группе лейкоцитарный индекс интоксикации оставался повышенным только у 20 (51,2%) (р=0,014 по критерию χ2).
На 15-е сутки в первой группе лейкоцитарный индекс интоксикации был выше нормы у 2 (5,1%) больных, во второй группе лейкоцитарный индекс интоксикации у всех больных был в пределах нормы (р<0,001 по критерию χ2).
Учитывая полученные данные, можно говорить о том, что дальнейшее исследование комплексного применения внутриартериальной терапии и экзогенного монооксида азота является необходимым с целью повышения эффективности лечения данной категории больных, принимая во внимание разные эффекты и механизмы действия.
Выводы
- Учитывая полученные результаты, можно статистически достоверно говорить о более выраженном противоболевом и противоотечном действии экзогенного монооксида азота, уменьшении сроков очищения ран, стимуляции роста грануляционных тканей и ускорении заживления язвенно-некротических дефектов у больных первой группы.
- Наиболее быстрая стерилизация раны отмечена у больных, лечившихся с применением внутриартериальной терапии.
- Статистически достоверное снижение интоксикации (уменьшение уровня лейкоцитов и нормализация лейкоцитарного индекса интоксикации) наблюдалось у больных второй группы.
Библиографическая ссылка
Суздальцев И.В., Ионов П.Ш., Печёнкин Е.В., Полапин И.А. ДИНАМИКА ПОКАЗАТЕЛЕЙ ВОСПАЛИТЕЛЬНОГО ПРОЦЕССА ЯЗВЕННО-НЕКРОТИЧЕСКИХ ОСЛОЖНЕНИЙ СИНДРОМА ДИАБЕТИЧЕСКОЙ СТОПЫ ПРИ ПРИМЕНЕНИИ ЭКЗОГЕННОГО МОНООКСИДА АЗОТА И ВНУТРИАРТЕРИАЛЬНОЙ ТЕРАПИИ // Современные проблемы науки и образования. 2018. № 6. ;URL: https://science-education.ru/ru/article/view?id=28305 (дата обращения: 22.01.2026).



