Депрессия является тяжелым заболеванием, распространяющимся более чем на 12% населения экономически развитых стран; к 2020 году она может стать второй по частоте причиной нетрудоспособности в мире [1; 2]. В России проблема заболеваемости депрессией приобрела большую значимость из-за колоссальных социальных потрясений последних десятилетий [1]. Все это предполагает высокую социальную ценность исследований основ этого заболевания, что может улучшить его профилактику и лечение.
Согласно диагностической системе DSM V-TR, агедония, или сниженная способность воспринимать положительные стимулы, относится к основным симптомам депрессии [2; 3]. Когнитивные нарушения часто сопутствуют депрессивным расстройствам [3]. Хронический стресс является наиболее разработанным способом индукции агедонии у грызунов [4-6], снижение потребления сахара / сахарина в этой модели расценивают как признак агедонии [7-9], поскольку антидепрессанты препятствуют его развитию [10; 11].
Ранее нами была разработана мышиная модель хронического стресса [10-12], в которой стресс вызывает агедонию, определяемую по снижению предпочтения к раствору сахара, у части, но не у всех животных. Это позволяет раздельно исследовать агедоничную и неагедоничную подгруппы и обеспечивает внутренний контроль тех эффектов хронического стресса, которые не связаны с депрессивым состоянием. В данном исследовании мы изучали вопрос, нарушены ли когнитивные функции при агедонии и в результате воздействия хроническим стрессом, не сопровождающегося ее развитием. Так, известно, что хронический стресс нарушает пластичность гиппокампа [5; 9]. Также для изучения этой взаимосвязи использовали хроническую подачу антидепрессанта циталопрама [10].
Цель исследования
Изучить эффекты антидепрессантной терапии на показатели агедонии и когнитивные функции в мышиной модели стресса.
Материал и методы исследования
Животные. Использовали 3.5-месячных самцов C57BL/6N, содержащихся в стандартных лабораторных условиях, как описано ранее [10], в соответствии с действующими положениями этических норм в ЕС и одобрением этического комитета Научно-исследовательского института общей патологии и патофизиологии.
Схема эксперимента. За 2 недели до стресса у всех мышей были изучены социальное поведение, предпочтение к 1%-ному раствору сахара. 12 контрольных животных и 23 мыши из группы стресса получали обычную воду для питья, 10 контрольных животных и 22 мыши из группы стресса получали раствор циталопрама за 1 неделю до начала стресса. 4-недельный стресс включал три вида стресса (см. ниже), через 2.5, 3.5 и 4 недели стресса определяли вес мышей и предпочтение к 1%-ному раствору сахара, после чего животные были классифицированы как агедоничные либо неагедоничные. Далее мыши были протестированы в модели вынужденного плавания, модели аудиторного и контекстуального условно-рефлекторного замирания и тесте гиппокамп-зависимого поведения дислокации предметов из рубки.
Хронический стресс. Стрессоры ротировали по дням: 1-7 – непрерывная экспозиция крысы; 8-10 – иммобилизация 11-17 – периодическая экспозиция крысы; 18-19 – водная иммерсия; 20-22 - водная иммерсия и иммобилизация; 23 – подвешивание за хвост; 24-26 – подвешивание за хвост и водная иммерсия; 27-28 – стресс подвешивания за хвост и иммобилизация [10].
Непрерывная экспозиция крысы в клетках. Мышь помещалась в клетку (22x8.5x14 см), которую ставили в домашнюю клетку крысы (21.00 - 9.00).
Периодическая экспозиция крысы. Мышей в прозрачных цилиндрических контейнерах (15xØ8 cм) помещали в крысиную клетку на 12 ч (21.00 - 9.00).
Стресс иммобилизации. Животных помещали в пластиковые трубки (8xØ2,6 cм) на 2 часа в светлое время цикла освещения.
Стресс водной иммерсии. Животных помещали в пластиковые трубки (8xØ2,6 cм), в которых они могли двигаться, и ставили их в емкость с водой 21 °C на 10 мин, так что тела были в воде наполовину.
Стресс подвешивания за хвост. Мышей подвешивали за хвост на 40 мин.
Сахарозный тест. Между 9.00 – 19.00 мыши получали 10-ч доступ к 1%-ному раствору сахара и обычной воде. Бутылки взвешивали до и после теста, предпочтение к раствору сахара рассчитывали в процентах от объема выпитой жидкости. По его снижению <65% мышей определяли как агедоничных, остальных мышей причисляли к неагедоничным.
Тест вынужденного плавания. Мышей помещали на 2 мин в прозрачный контейнер (20x35x15 cм) с водой (30 °C). При красном свете измеряли латентный период флотирования и его общую длительность.
Модель условно-рефлекторного замирания. Установка (Evolocus LLC Tarrytown, NY, USA и «Открытая наука», Москва) состояла из прозрачного пластикового контейнера (25х25х50 см) с решётчатым полом из нержавеющей стали (33 стержня 2 мм в диаметре). Одиночный разряд переменного тока (AC, 50 Гц, 0,7 мА) подавался на решётчатый пол после двухминутного периода акклиматизации, по окончании 30-секундного звукового сигнала, который производился с помощью звукового генератора (80дБ). Поведение замирания или его отсутствие отмечалось каждые 10 сек через 24 часа при помещении мышей в экспериментальный контейнер для оценки контекстуальной памяти и через 30 часов при помещении мышей в новый контейнер (15х20х40 см) и подаче звукового сигнала в течение 180-секундного интервала. Подсчитывался процент времени, в течение которого животное проявляло поведение замирания.
Тест на гиппокамп-зависимое поведение. В домашнюю клетку мышей помещали бумажную трубку (10xØ4 cм), заполненную 20 фрагментами корма, и определяли динамику ее опустошения в течение 20 мин [13].
Подача циталопрама. Циталопрам (Lundbeck, Копенгаген, Дания) вводили растворенный в воде, исходя из дозы 15 мг/кг и среднего потребления воды 3 мл/сут.
Статистический анализ. Использовали программу Statistica 5.01 (Чикаго, Иллинойс, США), применяя непараметрические тесты Кruskal-Wallis test и Mann-Whitney U, множественный регрессионный анализ Multiple R и F и тест Fischer. Доверительный интервал был 95% (p<0.05).
Результаты исследования и их обсуждение
Эффекты циталопрама в сахарозном тесте. В стрессированной группе животных, не получавших циталопрам, через 2,5, 3,5 недели (данные не представлены) и 4 недели стресса наблюдалось достоверное снижение предпочтения к раствору сахара в сравнении с контролем (p=0,003, р=0,002 и p=0,042 соответственно; рис. 1). При этом на фоне введения антидепрессанта этот эффект наблюдался после 4 недель стресса (p=0,025), но не через 2,5 и 3,5 недели стресса (р<0,05). Через 3,5 и 4,5 недели стресса стрессированные животные, не получавшие циталопрам, имели достоверно сниженное потребление раствора сахара в сравнении с контролем (p=0,008 и р=0,01), а также стрессированной группой, получавшей антидепрессант (р=0,035 и р=0,46).
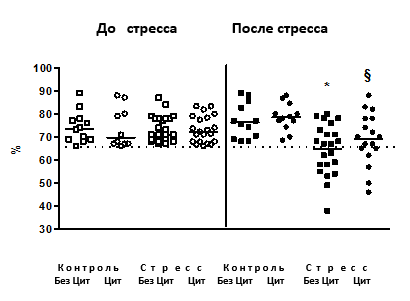
Рис. 1. Предпочтение к раствору сахара
До стресса после недельного введения циталопрама предпочтение к раствору сахара (ось У) не различалось между группами. Мыши, подвергнутые стрессу и не получавшие циталопрам, проявили достоверное снижение предпочтения к раствору сахара в сравнении с контрольными. У мышей, подвергнутых стрессу и получавших циталопрам, таких изменений не наблюдалось (*р<0,05 в сравнении с контролем, §р< 0,05 в сравнении с группой стресса, получавшей циталопрам); пунктирная линия обозначает 65% - предпочтение к раствору сахара - порог критерия «агедонии» (см. текст). БезЦит / Цит: без введения циталопрама, с введением циталопрама соответственно.
Последняя группа не отличалась по этому параметру от контрольных мышей (р<0,05); введение циталопрама контрольной группе не меняло параметры сахарозного теста (данные не представлены).
Согласно 65%-ному критерию агедонии, введение циталопрама приводило к достоверному снижению доли агедоничных животных после стрессирования (p=0,028). Таким образом (Т.о.), циталопрам замедлял развитие агедонии, что считается классическим проявлением антидепрессантного воздействия в различных моделях депрессии [4; 13]. Описанные эффекты известны как типичные для длительного введения антидепрессантов при стрессе [4; 5; 11].
Эффекты циталопрама в тесте вынужденного плавания. В сравнении с контролем стрессированные животные без антидепрессанта, но не стрессированные мыши, получавшие циталопрам, проявляли укорочение латентного периода и увеличение продолжительности флотирования (р=0,044, p=0,015, p=0,25 и p=0,86 соответственно, данные не представлены). Т.о., введение циталопрама препятствовало увеличению продолжительности поведения флотирования в результате стресса; эти эффекты считаются классическими признаками антидепрессантного воздействия в моделях депрессии [3; 11].
Влияние циталопрама на массу тела. Вес тела был достоверно снижен у стрессированной группы на протяжении всего периода стресса; циталопрам противодействовал этому эффекту стресса в период 2,5–4 недель стрессирования (данные не представлены). Этот эффект, как было ранее показано, сопровождает антидепрессивное воздействие, в частности, циталопрама [10; 12].
Эффекты стресса и циталопрама на гиппокамп-зависимое поведение в тесте дислокации предметов. Анализ продолжительности замирания в тесте аудиторного кондиционирования не выявил достоверных различий между группами (p=0,62, рис. 2А), что свидетельствует об отсутствии нарушения миндалина-зависимой памяти на фоне развития стресс-индуцированной агедонии при подаче циталопрама. Сравнение продолжительности замирания в тесте контекстуального кондиционирования выявило значительное различие между группами (p=0,03) и показало, что группа стрессированных животных без введения циталопрама, проявивших признаки агедонии, имела значительно меньшую продолжительность замирания по сравнению с контрольной группой (p<0,01, рис. 2Б).
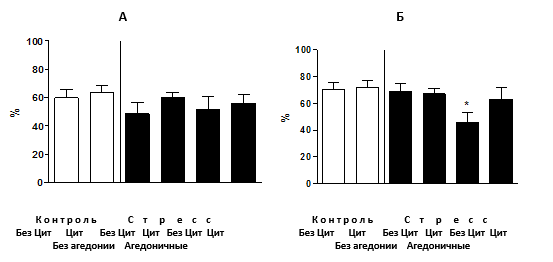
Рис. 2. Условно-рефлекторное замирание при кондиционировании
(А) Процент продолжительности замирания в модели аудиторного кондиционирования достоверно между группами не различался. (Б) Мыши, подвергнутые стрессу, классифицированные как агедоничные (см. текст) и не получавшие циталопрам, проявили достоверное снижение продолжительности замирания в модели контекстуального кондиционирования в сравнении с контрольными. У остальных групп мышей таких изменений не наблюдалось (*р< 0,05 в сравнении с контролем). Ось У - процент продолжительности замирания от времени тестирования. БезЦит / Цит: без введения циталопрама, с введением циталопрама соответственно.
Других достоверных различий между группами выявлено не было. Т.о., развитие стресс-индуцированной агедонии сопровождается снижением показателей гиппокамп-зависимой формы памяти. Введение циталопрама предотвращало эти нарушения у стрессированных мышей.
Эффекты стресса и циталопрама на гиппокамп-зависимое поведение в тесте дислокации предметов. Агедоничные мыши среди животных, не получавших циталопрам, проявляли резкое увеличение латентного периода и периода 50%-ного опустошения трубки с мелкими предметами (р<0,001), тогда как в других группах такого явления не наблюдалось (рис. 3). Т.о., циталопрам предупреждал развитие когнитивной дисфункции, типичной для состояния агедонии в данной модели [12].
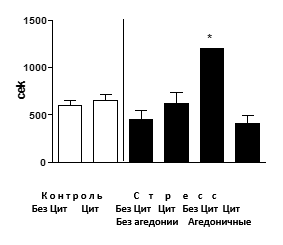
Рис. 3. Поведение в тесте дислокации предметов
Агедоничные мыши среди животных, не получавших циталопрам, проявляли резкое увеличение латентного периода 50%-ного опустошения трубки с мелкими предметами (*р< 0,05, в сравнении с контролем), тогда как в других группах такого явления не наблюдалось. Ось У - латентный период 50%-ного опустошения трубки с мелкими предметами. БезЦит / Цит: без введения циталопрама, с введением циталопрама соответственно.
Заключение
Полученные данные свидетельствуют о том, что хронический стресс нарушает гиппокамп-зависимые когнитивные функции исключительно у подгруппы животных, предрасположенных к развитию агедонии, что также отражает ограниченную функцию генома в регуляции системных функций, учитывая использование инбредной линии в работе [13]. Животные, устойчивые к развитию депрессивноподобного синдрома на фоне стресса не обнаружили снижения показателей контекстуальной памяти и поведения дислокации мелких предметов из трубки. Миндалина-зависимая форма обучения, как показали данные в модели аудиторного кондиционирования, не была нарушена на фоне стресса и агедонии. Введение циталопрама предотвращало вышеописанные нарушения у группы мышей, классифицированных как агедоничные, что требует дальнейшего изучения и может быть интепретировано как проявление антидепрессантных эффектов хронической подачи циталопрама в данной модели, подтверждая основное заключение работы.
Работа выполнена при поддержке гранта РФФИ 11-04-14, программы «5-100» и Министерства здравоохранения Российской Федерации (программа «Изучение механизмов гиппокампальной пластичности у устойчивых и предрасположенных к стресс-индуцированному синдрому депрессии мышей»).
Библиографическая ссылка
Стрекалова Т.В., Лыско А.И., Трофимов А.Н., Прошин А.Т., Помыткин И.А., Умрюхин А.Е. ЦИТАЛОПРАМ ПРОТИВОДЕЙСТВУЕТ РАЗВИТИЮ КОГНИТИВНЫХ НАРУШЕНИЙ МЫШЕЙ В МОДЕЛИ СТРЕСС-ИНДУЦИРОВАННОЙ АГЕДОНИИ // Современные проблемы науки и образования. 2018. № 6. ;URL: https://science-education.ru/ru/article/view?id=28262 (дата обращения: 16.02.2026).



