Применение доксорубицина в разных схемах химиотерапии при лечении злокачественных новообразований различных локализаций обусловлено его высоким антибластическим эффектом, способностью вызывать гибель быстро делящихся клеток преимущественно за счет интеркалирования между парами оснований двойной спирали ДНК, связывания с топоизомеразами I и II с формированием ДНК-расщепляемых комплексов [1]. Несмотря на побочные эффекты доксорубицина, которые связаны прежде всего с кардиотоксичностью, его использование за последние три десятилетия заметно возросло [2], что определяет необходимость дальнейшего изучения всех возможных механизмов цитотоксического действия этого препарата, а также поиск новых цитопротекторов для снижения неблагоприятных последствий химиотерапии.
Кардиотоксические эффекты доксорубицина связывают в основном с его способностью генерировать свободные радикалы, что может приводить к дальнейшему повреждению ДНК, ингибированию воспроизводства разных макромолекул (в том числе структурных белков), раскручиванию/разделению ДНК, усилению алкилирования. Кроме того, доксорубицин может непосредственно связываться с белками плазматической мембраны, вызывая ее повреждение [1]. В экспериментах показано, что использование некоторых антиоксидантов может уменьшать кардиотоксические эффекты доксорубицина [3]. Однако в клинической практике, к сожалению, достичь таких результатов по снижению частоты развития антрациклиновых кардиомиопатий с помощью антиоксидантов все еще не удается, что предполагает наличие других, кроме окислительного стресса, механизмов развития сердечной недостаточности после применения доксорубицина [4], а следовательно, и разработку других классов цитопротекторов, а также стимуляторов функциональной активности и регенераторных реакций кардиомиоцитов.
Среди биорегуляторов сердечной деятельности катехоламины (адреналин, норадреналин) занимают особое место, поскольку они постоянно вовлечены в регуляцию частоты и силы сердечных сокращений в физиологических условиях. Однако высокие дозы катехоламинов (адреналина или изопротеренола) или их продолжительное воздействие вызывают так называемые инфарктоподобные состояния (некрозы кардиомиоцитов, мелкоочаговый фиброз миокарда) или гипертрофию сердца [5–7]. Поэтому использование катехоламинов для стимуляции сердечной деятельности при антрациклиновой кардиомиопатии, для которой характерны снижение силы сокращений и уменьшение фракции выброса, может усилить гибель кардиомиоцитов и существенно усугубить положение. Для выяснения характера изменений кардиомиоцитов при сочетанных воздействиях доксорубицина и катехоламинов, в частности адреналина, необходимо проведение экспериментальных исследований, позволяющих проследить динамику изменений. Ультраструктурный анализ позволяет выяснить основные типы повреждения кардиомиоцитов с оценкой характера и выраженности повреждений основных внутриклеточных компартментов (ядерного, миофибриллярного, митохондриального, ретикулярного), что позволяет предположить механизмы их повреждения и предложить дополнительные критерии для морфологической диагностики антрациклиновой кардиомиопатии.
Цель работы – изучить характер и выраженность ультраструктурных изменений кардиомиоцитов при сочетанном воздействии доксорубицина и адреналина.
Материал и методы исследования
Эксперименты проведены на 23 крысах-самцах линии Вистар, которым однократно внутрибрюшинно вводили доксорубицина гидрохлорид в дозе 10 мг/кг массы тела, а затем ежедневно в течение 3–5 дней подкожно вводили раствор адреналина гидрохлорида (в дозе 10 мг/кг массы тела). Крыс выводили из опыта декапитацией через 5, 7, 14 и 21 сутки после введения доксорубицина. Животные, декапитированные через 5 суток, получали по 3 инъекции адреналина, в остальные сроки – по 5 инъекций. Контролем служили животные (12 особей), которым по таким же схемам и в соответствующем объеме вводили 0,09%-ный раствор хлористого натрия; контрольных животных выводили из опыта в те же сроки, что и опытных. Все эксперименты выполнены с одобрения Комитета по биомедицинской этике ФИЦ ФТМ. Эксперименты проводились с соблюдением правил и рекомендаций Европейской конвенции по защите позвоночных животных, используемых в экспериментальных работах.
Для электронно-микроскопического исследования образцы миокарда левого желудочка фиксировали в 4%-ном параформальдегиде (рН 7,4), постфикисировали в 1%-ном растворе четырехокиси осмия, затем обезвоживали и заливали в смесь эпона и аралдита. Ультратонкие срезы получали на ультратомах LKB III и Leica ULTRACUT EM UC7 (Leica, Германия), контрастировали уранилацетатом и цитратом свинца. Исследование проводили в электронных микроскопах JEM-100B и JEM-1400 (фирмы «Jeol», Япония).
Результаты исследования и их обсуждение
Ультраструктура миокарда контрольных крыс во все сроки эксперимента соответствовала таковой у мелких грызунов: миофибриллярные пучки располагались параллельными рядами вдоль длинной оси кардиомиоцитов, между ними находились плотно упакованные митохондрии, а также небольшие везикулы агранулярной саркоплазматической сети и трубочки Т-системы на уровне Z-дисков. Ядра кардиомиоцитов были овальной формы, содержали преимущественно эухроматин, одно-два гранулярно-фибриллярных ядрышка петлистой формы. В околоядерной зоне располагались большое количество митохондрий, единичные лизосомы.
Через 5 суток после однократной инъекции доксорубицина (10 мг/кг массы тела) и 3 инъекций раствора адреналина (10 мг/кг массы тела) в миокарде различались три субпопуляции кардиомиоцитов в зависимости от выраженности и вида повреждений: кардиомиоциты с преимущественно нормальной ультраструктурой, кардиомиоциты с преимущественно литическими повреждениями миофибрилл и саркоплазматического матрикса (характерные для действия антрациклиновых антибиотиков), кардиомиоциты с преимущественно контрактурными повреждениями миофибрилл (характерными для адреналиновых воздействий). В литически измененных кардиомиоцитах отмечался диффузный и мелкоочаговый лизис миофиламентов (рис. 1, а); иногда в результате лизиса одного или нескольких саркомеров миофибриллярные пучки становились дискретными. В отдельных клетках литические изменения саркоплазматического матрикса и деструкция органелл были особенно выражены в околоядерной зоне, что приводило к образованию своеобразных зон «опустошения» (рис. 1, б). При этом в зонах литически измененных миофибрилл появлялись скопления полисом, что отражало возобновление процессов внутриклеточной регенерации.
а 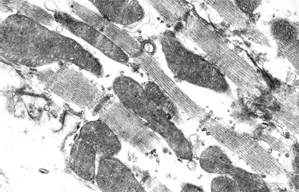 б
б 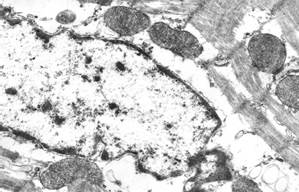
в 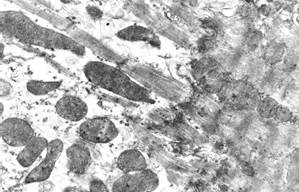 г
г 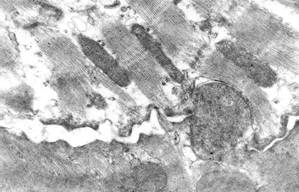
Рис. 1. Ультраструктура кардиомиоцитов через 5 суток после однократного введения доксорубицина и трехкратного введения адреналина:
а – литические изменения миофибрилл и саркоплазматического матрикса;
б – «опустошение» околоядерной зоны; в – выраженные литические изменения в одном кардиомиоците и выраженные контрактуры – в соседнем кардиомиоците; г – расширения межклеточного пространства в области fascia adherens. Ув. х15000
В контрактурно поврежденных кардиомиоцитах (регистрировались в основном сегментарные контрактуры I и II, реже – III степени) органеллы были очень компактно упакованы, литические изменения в таких клетках практически отсутствовали. В некоторых участках миокарда на протяжении мышечного волокна встречались гиперсокращенные (сегментарные контрактуры III степени) и «перерастянутые» кардиомиоциты (рис. 1, в). В последних отмечался выраженный лизис саркоплазматического матрикса и миофибрилл, регистрировались аутофагические процессы.
Во всех кардиомиоцитах отмечались выраженные расширения агранулярной саркоплазматической сети и околоядерного межмембранного пространства. Митохондрии в большинстве кардиомиоцитов сохраняли свое строение, но появлялись органеллы с разреженным матриксом и нерегулярным расположением крист. В ядрах кардиомиоцитов распределение и соотношение эухроматина и гетерохроматина существенно не отличались от контроля, но во многих ядрах ядрышки были фрагментированы.
В этот экспериментальный срок начинали проявляться изменения вставочных дисков. Отмечались расширения межклеточного пространства в области fascia adherens (рис. 1, г), вероятно, в результате выраженных контрактур в кардиомиоцитах. В некоторых случаях наблюдались нарушения плотных контактов, что приводило к частичной диссоциации кардиомиоцитов в мышечных волокнах.
Ультраструктура эндотелиоцитов кровеносных капилляров в этот срок при данных фармакологических воздействиях существенно не изменялась. На ламинарной поверхности эндотелиоцитов формировались небольшие выросты. В просвете капилляров и в межклеточных пространствах находились остаточные тельца и мембранные образования небольших размеров, а также хлопьевидная субстанция.
Через 7 суток эксперимента межмембранное околоядерное пространство оставалось расширенным, так же как и цистерны агранулярной саркоплазматической сети (рис. 2, а). Литические изменения миофибрилл в большинстве кардиомиоцитов были незначительными, чаще отмечались контрактурные повреждения различной степени (от умеренной до выраженной). Следует отметить, что в этот срок в некоторых кардиомиоцитах наблюдались обрывки миофибриллярных пучков с гиперсокращениями (рис. 2, б), которые представляли собой ультраструктурные эквиваленты первичного глыбчатого распада, одного из типов альтеративных повреждений кардиомиоцитов, регистрируемых при инфаркте миокарда и инфарктоподобных повреждениях, в частности адреналиновых (изопротереноловых) воздействиях [5].
а 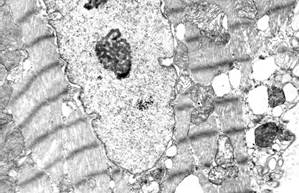 б
б 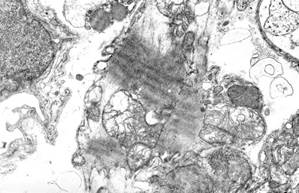
в 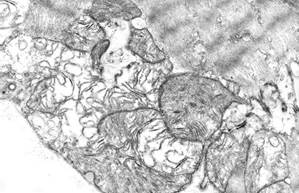 г
г 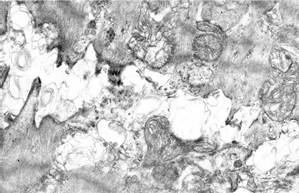
Рис. 2. Ультраструктура кардиомиоцитов через 7 суток после однократного введения доксорубицина и пятикратного введения адреналина:
а – выраженное расширение цистерн агранулярной саркоплазматической сети. Ув. х6000;
б – фрагмент кардиомиоцита с первичным глыбчатым распадом миофибрилл. Ув. х8000;
в – выраженная деструкция митохондрий. Ув. х10000; г – разрыв мышечного волокна по вставочному диску. Ув. х10000
Характерной особенностью ультраструктурных изменений кардиомиоцитов при сочетанном воздействии доксорубицина и адреналина было усиление полиморфизма митохондрий, появление в контрактурно поврежденных клетках большого количества органелл с деструктивными изменениями. В таких кардиомиоцитах одновременно присутствовали митохондрии с нормальной ультраструктурой и митохондрии с расширением и деструкцией крист, значительным лизисом матрикса и миелиноподобной трансформацией (рис. 2, в). Размеры таких органелл, как правило, были увеличены, иногда отмечались гигантские формы. В некоторых митохондриях присутствовали электронно-плотные включения (которые рассматривают как отложения кальция) (см. рис. 2, в). Часто в местах скопления митохондрий находились полиморфные миелиноподобные структуры, иногда заметно осмиофильные, которые трансформировались в остаточные тельца.
Более значительно, чем в предыдущий срок, была изменена ультраструктура вставочных дисков. Расширения между клетками в области fascia adherens были заполнены выводимыми остаточными тельцами и хлопьевидной субстанцией. В некоторых случаях происходила полная диссоциация кардиомиоцитов по вставочным дискам (рис. 2, г). Такие изменения вставочных дисков и нарушения структурной целостности мышечных волокон способствовали нарушению трансмиссии сокращений. Диссоциированные кардиомиоциты не способны к восстановлению функционального синцития и подвергаются апоптозу [8, 9].
По истечении 14 суток после однократного введения доксорубицина и 5-кратного введения адреналина ультраструктура большинства кардиомиоцитов существенно не отличалась от нормальной (рис. 3, а). В отдельных кардиомиоцитах саркоплазматический матрикс и миофибриллярные пучки были умеренно лизированы, отмечались литические процессы, которые захватывали один или несколько саркомеров. В таких участках часто регистрировались рибосомы и полисомы. Расширения цистерн агранулярной саркоплазматической сети были менее выраженными и регистрировались преимущественно в околоядерной зоне (см. рис. 3, а). По-прежнему в некоторых кардиомиоцитах наблюдались митохондрии с деструктивными изменениями (очаговый лизис матрикса, уменьшение количества крист и их деструкция), но их выраженность была меньше, чем в предыдущий срок. Отмечался полиморфизм митохондрий, иногда их форма была причудливой. Между митохондриями в редких случаях наблюдались мелкие липидные капли.
а 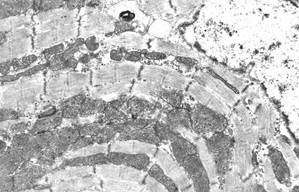 б
б 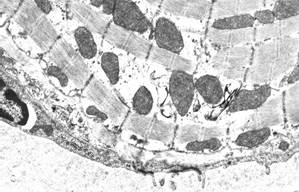
Рис. 3. Ультраструктурные изменения кардиомиоцитов через 14 суток эксперимента:
а – расширения цистерн агранулярной саркоплазматической сети и остаточные тельца в околоядерной зоне; б – литические изменения саркоплазмы и миелиноподобные структуры в подсарколеммальной зоне. Ув. х8000
Аутофагические процессы были выражены в меньшей степени: в кардиомиоцитах встречались немногочисленные миелиноподобные структуры небольших размеров, преимущественно в местах скопления митохондрий (рис. 3, б), в околоядерной зоне наблюдались единичные вторичные лизосомы. В некоторых клетках отмечались очаги парциальной деструкции органелл, содержащие вакуолеподобные структуры или хлопьевидную субстанцию. Как и в предыдущий срок, в некоторых мышечных волокнах наблюдались расширения межклеточных пространств в области вставочных дисков с полной потерей контактов между соседними клетками.
Ультраструктура эндотелиоцитов кровеносных капилляров не отличалась от контроля. Однако следует отметить истончение эндотелиальной выстилки в некоторых капиллярах. В просветах капилляров и в межклеточном пространстве содержались немногочисленные миелиноподобные структуры, хлопьевидные массы. Среди клеточных элементов преобладали активные формы фибробластов.
Через 21 сутки после начала эксперимента ультраструктура большинства кардиомиоцитов и их ядер восстанавливалась, но встречались отдельные кардиомиоциты (как правило, атрофированные) с выраженным лизисом саркоплазматического матрикса, истончением и редукцией миофибриллярных пучков (рис. 4, а). В некоторых кардиомиоцитах отмечалось нерегулярное, хаотичное расположение разреженных миофибриллярных пучков (рис. 4, б), которое может возникать при восстановлении процессов внутриклеточной регенерации из-за предшествовавших нарушений цитоскелета и отсутствия восстановления его архитектоники.
а 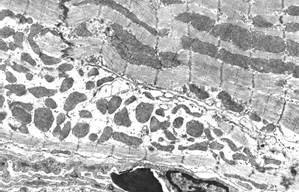 б
б 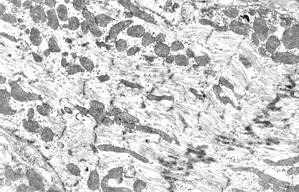
Рис. 4. Ультраструктура кардиомиоцитов через 21 сутки эксперимента:
а – гетерогенность кардиомиоцитов; внизу – атрофированный кардиомиоцит с редукцией и литическими изменения миофибриллярных пучков и разреженной саркоплазмой;
б – хаотичное расположение истонченных миофибриллярных пучков. Ув. х5000
В околоядерной зоне сохранялось умеренное расширение цистерн агранулярной саркоплазматической сети, в остальных зонах агранулярная саркоплазматическая сеть была представлена небольшими везикулами. Саркоплазматический матрикс был просветлен, но в целом меньше лизирован, чем в более ранние сроки эксперимента. Митохондрии были полиморфными, в околоядерной зоне регистрировались, как правило, небольшие округлые органеллы, их тонкая структура не изменялась. В то же время вблизи митохондрий обнаруживались небольшие осмиофильные миелиноподобные структуры, которые представляли собой остаточные тельца после трансформации деградировавших митохондрий. Следует отметить, что в этот срок эксперимента практически не регистрировались расширения межклеточных пространств в области вставочных дисков (рис. 4, б), но их строение часто приобретало зигзагообразный вид. Тонкое строение капилляров, их эндотелиальной выстилки соответствовало норме.
Ультраструктурные изменения кардиомиоцитов при сочетанном действии доксорубицина и адреналина в значительной степени носили сочетанный характер: одновременно регистрировались ультраструктурные изменения, характерные для доксорубициновых повреждений [8, 9], и ультраструктурные изменения, которые были обусловлены адреналиновыми воздействиями [5]. Наиболее манифестными ультраструктурными изменениями кардиомиоцитов, обусловленными действием доксорубицина, были значительные расширения межмембранного околоядерного пространства и агранулярной саркоплазматической сети, разной степени выраженности литические повреждения миофибриллярных пучков, усиление аутофагических процессов с формированием остаточных телец, которые выделялись через вставочные диски в интерстиций. Важно также отметить нарушения межклеточных контактов с полным разрушением плотных контактов и дезинтеграцией мышечных волокон и выраженные литические изменения саркоплазмы.
Адреналиновые повреждения кардиомиоцитов манифестировали преимущественно контрактурными изменениями миофибрилл разной степени выраженности и значительными деструктивными изменениями митохондрий, которые в некоторых кардиомиоцитах носили тотальный характер. Следует отметить, что для доксорубициновых повреждений такие формы деструктивных изменений митохондрий не характерны. При антрациклиновой кардиомиопатии происходит в основном миелиноподобная трансформация митохондрий с образованием миелиноподобных остаточных телец, которые локализуются в местах скопления этих органелл.
Выраженные литические изменения миофибрилл и саркоплазмы при доксорубициновых воздействиях могут быть обусловлены активацией внутриклеточной матриксной металлопротеиназы-2 (ММП-2) в условиях развивающегося окислительного стресса. Активация ММП-2 в кардиомиоцитах была выявлена как в физиологических условиях (в эмбриогенезе, постнатальном онтогенезе), так и при разных патологических процессах, в том числе и при доксорубицин-индуцированной кардиомиопатии [10–12] и циклофосфамид-индуцированной кардиомиопатии [13]. Показано, что ММП-2 локализуется в разных внутриклеточных компартментах кардиомиоцитов (в саркомерах, вблизи белков цитоскелета, в ядрах, митохондриях и кавеолах) [11, 14] и может быстро активироваться при накоплении свободных кислородных радикалов и пероксинитритов. ММП-2 вызывает протеолитическое расщепление тропонина I, легкой цепи-1 миозина, α-актинина, титина, в результате чего происходят нарушение сборки миофибрилл, их ремоделирование и развитие сократительной недостаточности. Подобные протеолитические изменения миофибрилл могут также вызывать нарушения целостности миофибриллярных пучков при первичном глыбчатом распаде в условиях адреналиновых воздействий.
Усиление аутофагических процессов в кардиомиоцитах при действии доксорубицина связывают с усилением их апоптотической гибели [4], что позволяет рассматривать интенсивность и распространенность аутофагии в качестве одного из критериев повреждения кардиомиоцитов. Следует отметить, что аутофагия является одним из основных внутриклеточных механизмов деградации и рециклинга долгоживущих белков и органелл, которые секвестрируются в аутофагосомах. В физиологических условиях аутофагия способствует выживанию клеток, рассматривается как цитопротекторный механизм, способствующий элиминации агрегированных белков и поврежденных органелл, сохранению энергетического гомеостаза клеток. Поэтому вопрос о цитопротекторной или цитодегенеративной роли аутофагии в конкретных условиях должен решаться на основании совокупности морфофункциональных изменений, главным из которых является развитие сердечной дисфункции. Значительное усиление аутофагических процессов в кардиомиоцитах при разных цитотоксических воздействиях некоторые авторы предлагают рассматривать как один из вариантов клеточной смерти – аутофагическую клеточную смерть [15].
Оценивая совокупность ультраструктурных изменений кардиомиоцитов при сочетанных воздействиях доксорубицина и адреналина, можно отметить более выраженный характер изменений, чем при действии каждого из соединений по отдельности, которые детально были описаны ранее [5, 8, 16]. Важно отметить, что адреналиновые (изопротереноловые) повреждения кардиомиоцитов/миокарда по данным большинства исследования при использованных в них дозах и схемах применения носят обратимый характер, часто характеризуются гипертрофическими изменениями, имеют в экспериментальных условиях, как правило, благоприятный исход [5, 6]. Но антрациклиновые антибиотики, доксорубицин в частности, даже при однократном введении в сублетальной дозе могут вызывать гибель значительного количества кардиомиоцитов (до 30% от их общего числа) [9], существенные нарушения их регенераторного потенциала, что и служит структурной основой развития дилатационной кардиомиопатии, необратимого терминального варианта ремоделирования сердца.
При оценке сочетанного воздействия доксорубицина и адреналина на кардиомиоциты важно отметить фенотипическую гетерогенность повреждений кардиомиоцитов: в одних клетках преобладали повреждения ультраструктур, характерные для цитотоксического действия доксорубицина, в других – обусловленные действием адреналина. Такая фенотипическая гетерогенность свидетельствует о популяционно-клеточной неоднородности миокарда, обусловленной присутствием кардиомиоцитов с разной метаболической активностью и разной чувствительностью к действию цитотоксических соединений и регуляторных молекул.
Заключение
Однократное введение сублетальной дозы доксорубицина (10 мг/кг массы тела) и многократное введение адреналина (10 мг/кг массы тела) вызывали в одних кардиомиоцитах преимущественно литические изменения, характерные для действия антрациклиновых антибиотиков, в других – преимущественно контрактурные повреждения миофибрилл, характерные для действия высоких доз катехоламинов. Наиболее манифестными доксорубицин-индуцированными изменениями кардиомиоцитов были выраженные расширения межмембранного околоядерного пространства и везикул агранулярной саркоплазматической сети, истончение и лизис миофибриллярных пучков, усиление аутофагических процессов с образованием миелиноподобных остаточных телец, нарушения плотных межклеточных контактов и дезинтеграция мышечных волокон. Адреналин-индуцированные повреждения кардиомиоцитов, кроме контрактурных изменений миофибрилл, характеризовались значительной, иногда тотальной, деструкцией митохондрий. Ультраструктурные изменения кардиомиоцитов, вызванные цитотоксическим действием доксорубицина и адреналина, прогрессировали в течение 14 суток эксперимента, затем регистрировалось восстановление тонкой структуры клеточных компартментов, но умеренные и слабо выраженные литические изменения саркоплазмы и миофибрилл сохранялись до конца эксперимента. Полученные результаты позволяют полагать, что применение адреналина в постхимиотерапевтический период (особенно после применения доксорубицина) для стимуляции сердечной деятельности может вызвать более выраженное повреждение миокарда, особенно в ранние сроки после химиотерапии, что необходимо учитывать в клинической практике.
Библиографическая ссылка
Лушникова Е.Л., Клинникова М.Г., Клочкова С.В., Молодых О.П. УЛЬТРАСТРУКТУРНАЯ ХАРАКТЕРИСТИКА ПОВРЕЖДЕНИЙ КАРДИОМИОЦИТОВ ПРИ СОЧЕТАННЫХ ДОКСОРУБИЦИНОВЫХ И АДРЕНАЛИНОВЫХ ВОЗДЕЙСТВИЯХ // Современные проблемы науки и образования. 2018. № 6. ;URL: https://science-education.ru/ru/article/view?id=28235 (дата обращения: 16.02.2026).



