Лекарственно-устойчивый туберкулез является одной из ведущих проблем современной фтизиатрии, определяя трудности профилактики, диагностики и лечения данного заболевания. Особое значение приобретает мониторинг распространения множественной лекарственной устойчивости микобактерий туберкулеза (МЛУ МБТ), пред-широкой и широкой лекарственной устойчивости микобактерий туберкулеза (пред-ШЛУ и ШЛУ МБТ) [1]. Под МЛУ МБТ понимают устойчивость возбудителя к сочетанию изониазида и рифампицина независимо от наличия устойчивости к другим противотуберкулезным препаратам. Пред-ШЛУ МБТ – устойчивость микобактерий туберкулеза к изониазиду и рифампицину в сочетании с устойчивостью к фторхинолону или аминогликозиду/полипептиду (канамицину и/или амикацину и/или капреомицину) независимо от наличия устойчивости к другим противотуберкулезным препаратам. ШЛУ МБТ – это вид устойчивости, при которой одновременно определяется устойчивость микобактерий туберкулеза к изониазиду, рифампицину, фторхинолону и аминогликозиду/полипептиду (канамицину и/или амикацину и/или капреомицину) независимо от наличия устойчивости к другим противотуберкулезным препаратам [2]. Большой интерес представляют методы прогнозирования эпидемической ситуации лекарственно-устойчивого туберкулеза [3]. Глобальные отчеты ВОЗ по туберкулезу с данными о распространении МЛУ-ТБ в странах мира публикуются с 2012 г. [4], а начиная с 2016 г. проводится оценка бремени туберкулеза с МЛУ МБТ и устойчивостью к рифампицину (РУ МБТ). В Российской Федерации показатель заболеваемости МЛУ/РУ-ТБ в 2017 г. составил 39 (25–57) на 100 000 населения в год. Обеспечение стандартизации лабораторных подходов к определению лекарственной устойчивости микобактерий туберкулеза (ЛУ МБТ) также играет большую роль в корректной оценке территориальных особенностей ЛУ МБТ [5]. В современных эпидемиологических условиях выбор назначаемой схемы химиотерапии туберкулеза должен основываться на сведениях о распространенности ЛУ МБТ к противотуберкулезным препаратам в конкретном регионе, в том числе на уровне районов и микрорайонов. Непрерывное наблюдение за резистентностью МБТ на территории с помощью IT-технологий позволяет быстро получить информацию о распространении ЛУ МБТ у больных, оценить спектр ЛУ МБТ, изучить территориальные особенности его распространения в динамике пространства и времени, что обеспечивает инновационный подход в реализации противотуберкулезных мероприятий.
Цель исследования. Изучить распространение лекарственно-устойчивого туберкулеза на территории Ярославской области в период 2011–2017 гг. с использованием авторской компьютерной программы.
Материалы и методы исследования. Разработана компьютерная «Программа учета и мониторинга очагов туберкулеза на территории» [6]. Она представляет собой электронную базу данных, в которой актуальная для фтизиатров информация систематизирована в виде четырех главных и ряда вспомогательных, связанных между собой таблиц. Таблицы содержат полные сведения о больных туберкулезом взрослых и детях, контактных детях и взрослых, детях с положительными иммунологическими тестами на туберкулез. Работа осуществляется в онлайн-режиме, что позволяет отслеживать любые динамические изменения сведений о больных (например, о появлении или прекращении бактериовыделения, спектре ЛУ микобактерий, реальном месте пребывания пациента). Проекция данных на электронную карту территории обеспечивает визуализацию эпидемической ситуации по туберкулезу, в том числе локально по отдельным районам и микрорайонам в динамике пространства и времени. В базу данных внесены сведения о 2270 взрослых, больных туберкулезом, зарегистрированных на территории Ярославской области в период 2011–2017 гг. В данное исследование включены 1713 больных туберкулезом с установленным бактериовыделением методами люминесцентной микроскопии, посева на жидкие (BACTEC MGIT 960/320), плотные питательные среды и молекулярно-генетическими (GeneXpert MTB/RIF, ПЦР в режиме реального времени) методами. Сведения о массивности бактериовыделения, материале, методах исследования, спектре первичной и вторичной ЛУ МБТ получены из карт больных об обследовании на МБТ в бактериологической лаборатории. Проведены оценка и мониторинг лекарственной устойчивости микобактерий туберкулеза на территории Ярославской области. Статистическую обработку данных проводили с помощью прикладного пакета программ Microsoft Excel и NanoStat 1.10.
Результаты исследования и их обсуждение
Массивное выделение микобактерий обнаружено у 399 (23,3%) больных, умеренное бактериовыделение – у 330 (19,3%) больных и скудное бактериовыделение – у 842 (49,1%) больных. С помощью молекулярно-генетических методов микобактерии туберкулеза были обнаружены еще у 8,3% больных без выявления бактериовыделения другими методами. Первичная ЛУ МБТ наблюдалась у 904 (52,8%) больных, в том числе у 279 (16,3%) больных выявлена МЛУ МБТ, у 175 (10,2%) больных – пред-ШЛУ МБТ, у 96 (5,6%) – ШЛУ МБТ, у 354 (20,7%) больных – устойчивость к другим комбинациям препаратов (рис. 1).
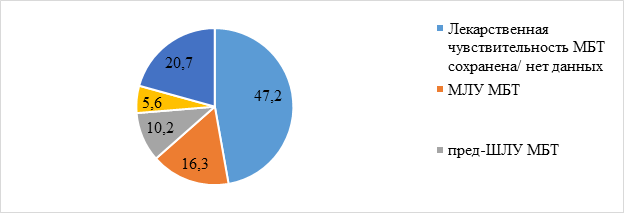
Рис. 1. Структура первичной ЛУ МБТ (%) среди бактериовыделителей 2011–2017 гг. (n=1713)
Среди впервые выявленных больных ЛУ МБТ к одному препарату определена у 180 (10,5%), двум препаратам – у 147 (8,6%), трем препаратам – у 133 (7,8%), к четырем и более препаратам – у 444 (26%) больных. Таким образом, выявляя ЛУ МБТ к изониазиду и рифампицину, мы в 26% случаев имеем устойчивость к 4 и более препаратам, что является фактором высокого риска нарастания устойчивости на фоне эмпирических режимов лечения. При такой ситуации на территории необходимо внедрять ускоренные методы определения ЛУ МБТ к противотуберкулезным препаратам второго ряда (молекулярно-генетические, посевы на жидкую питательную среду). Данный подход позволит проводить индивидуальную коррекцию схемы терапии в максимально короткие сроки и повысить эффективность лечения.
Получена ежегодная динамика структуры первичной ЛУ МБТ в 2011–2017 гг. к отдельным препаратам (таблица).
Динамика структуры первичной ЛУ МБТ к отдельным препаратам среди бактериовыделителей с ЛУ МБТ в 2011–2017 гг.
|
Очаги БК (+) с наличием ЛУ МБТ, абс. |
Первичная ЛУ МБТ, абс. (%) |
|||||||
|
2011 г. (n=107) |
2012 г. (n=107) |
2013 г. (n=103) |
2014 г. (n=117) |
2015 г. (n=192) |
2016 г. (n=173) |
2017 г. (n=105) |
2011-2017 гг. (n=904) |
|
|
S |
96 (89,7%) |
99 (92,5%) |
91 (88,3%) |
97 (83%) |
143* (74,5%) |
109* (63%) |
87* (82,8%) |
722 (80%) |
|
H |
89 (83,2%) |
86 (80,4%) |
83 (80,6%) |
91 (77,8%) |
143 (74,5%) |
141 (81,5%) |
86 (82,8%) |
719 (79,5%) |
|
R |
69 (64,5%) |
71 (66,3%) |
72 (70%) |
74 (63,2%) |
146* (76%) |
129 (74,6%) |
66* (62,8%) |
627 (69,3%) |
|
E |
52 (48,6%) |
65 (60,7%) |
21* (20,4%) |
21 (18%) |
30 (15,6%) |
35 (20,2%) |
35* (33,3%) |
259 (28,7%) |
|
Km |
37 (34,6%) |
41 (38,3%) |
31 (30%) |
34 (29%) |
34* (17,7%) |
29 (22,5%) |
20 (19%) |
226 (25%) |
|
Eto |
17 (16%) |
35* (32,7%) |
33 (32%) |
21* (18%) |
41 (21,3%) |
28 (16,2%) |
11 (10,5%) |
169 (18,7%) |
|
Fq |
28 (26,2%) |
23 (21,5%) |
9* (8,7%) |
23* (19,6%) |
28 (14,6%) |
38* (22%) |
18 (17,1%) |
167 (18,5%) |
|
PAS |
15 (14%) |
16 (15%) |
14 (13,6%) |
15 (12,8%) |
23 (12%) |
19 (11%) |
8 (7,6%) |
110 (12,2%) |
|
Cm |
19 (17,7%) |
17 (16%) |
17 (16,5%) |
16 (13,7%) |
21 (11%) |
19 (11%) |
10 (9,5%) |
119 (13,2%) |
|
Cs |
7 (6,5%) |
4 (3,7%) |
5 (4,8%) |
2 (1,7%) |
5 (2,6%) |
4 (2,3%) |
1 (1%) |
28 (3%) |
Примечание: * – значение р<0,05 в обозначенном году по отношению к предшествующему году.
Сокращения: S – стрептомицин, H – изониазид, R – рифампицин, E – этамбутол, Km – канамицин,
Eto – этионамид, Fq – фторхинолон, PAS – аминосалициловая кислота, Cm – капреомицин, Cs – циклосерин
Наиболее часто встречалась лекарственная устойчивость к стрептомицину (80% случаев), изониазиду (79,5% случаев) и рифампицину (69,3% случаев). Отмечен высокий удельный вес лекарственной устойчивости к этамбутолу – 28,7% и канамицину – 25%. Неблагоприятным является факт первичной устойчивости к фторхинолонам у 18,5% и этионамиду у 18,7%, капреомицину у 13,2%, к парааминосалициловой кислоте у 12,2% больных. Для обеспечения корректной оценки динамики ЛУ МБТ особенно следует отметить необходимость стандартизации и регулярного контроля качества лабораторных методов диагностики.
Среди 809 больных с изначально сохраненной лекарственной чувствительностью микобактерий туберкулеза (ЛЧ МБТ) произошло формирование лекарственной устойчивости у 64 (7,9%) больных. Из 904 больных с первичной ЛУ МБТ нарастание устойчивости произошло у 237 (26,2%) больных. Суммарно в 2011–2017 гг. на территории Ярославской области установлен факт появления и нарастания лекарственной устойчивости у 34,1% больных, что требует дополнительных усилий фтизиатров по оптимизации режимов химиотерапии. Особую роль в данных условиях имеют меры социальной и психологической поддержки для повышения приверженности больных к лечению и предотвращения перерывов в лечении.
Метод картографии в онлайн-режиме помогает в ряде случаев установить причины развития первичной ЛУ МБТ у конкретного больного. При этом при проекции распространения лекарственной устойчивости по территории в сравнении по районам и микрорайонам не было выявлено закономерности преобладания лекарственной чувствительности или устойчивости МБТ к определенным комбинациям препаратов. Совпадение лекарственной устойчивости в 72% случаев выявлялось только при семейном, родственном контакте или контакте по территории в пределах 1–2 домов. В качестве примера рассмотрим следующую территориальную ситуацию (рис. 2).
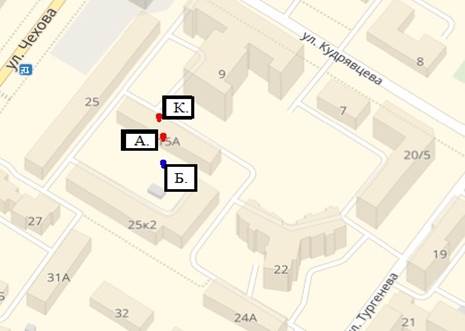
Рис. 2. Фрагмент карты микрорайона г. Ярославля
Условные обозначения:  - больной бактериовыделитель;
- больной бактериовыделитель;  - больной без бактериовыделения (пояснения в тексте)
- больной без бактериовыделения (пояснения в тексте)
У больного А., 39 л., туберкулез впервые выявлен при обращении к терапевту в феврале 2013 г., флюорографическое обследование не проходил более двух лет, в качестве факторов риска отмечены алкоголизм и низкий социальный статус, при посеве мокроты на плотные питательные среды установлено скудное бактериовыделение с сохраненной ЛЧ МБТ, при этом отмечены неоднократные перерывы в лечении по вине больного. У больного Б., 35 л., туберкулез выявлен в июне 2013 г. при плановом профилактическом осмотре на работе, бактериовыделение не установлено. Больной К., 41 г., в течение 14 лет находился в местах лишения свободы, на учете у фтизиатра не состоял, был освобожден в январе 2014 г., от профилактического флюорографического обследования уклонялся, лишь в 2015 г. при устройстве на работу на флюорограмме были выявлены изменения, подозрительные на туберкулез. При исследовании мокроты методом посева на жидкие и плотные питательные среды установлено массивное бактериовыделение с наличием пред-ШЛУ МБТ. Одномоментная визуализация очагов туберкулеза на территории по годам с учетом полученных данных обеспечивает возможность своевременного прогнозирования эпидситуации на территории и выбора конкретных решений по тактике ведения больных и контактирующих с ними лиц. В данном случае больной Б. имел территориальный контакт в пределах одного дома с больным А., выделяющим МБТ с сохраненной лекарственной чувствительностью, но не был своевременно обследован у фтизиатра. При этом у больного А. имеется низкая приверженность к лечению как фактор риска формирования вторичной ЛУ МБТ. Вернувшийся из мест лишения свободы больной К. с установленной пред-ШЛУ МБТ формирует в свою очередь территориальную группу контактных лиц с риском ЛУ МБТ, что необходимо учитывать фтизиатру при их обследовании. В представленной территориальной ситуации также следует отметить, что на протяжении указанного временного промежутка не было выявлено ни одного ребенка с положительными иммунологическими тестами на туберкулез или заболевших туберкулезом детей, что требует более тщательного совместного контроля со стороны фтизиопедиатра и участкового педиатра.
Заключение. Применение компьютерного мониторинга позволило выявить распространение первичной ЛУ МБТ у 52,8% бактериовыделителей на территории Ярославской области в 2011–2017 гг., в том числе МЛУ МБТ в 16,3%, пред-ШЛУ в 10,2% и ШЛУ МБТ в 5,6% случаев. При этом не выявлено территориальных закономерностей появления первичной ЛУ МБТ. Важным фактором риска первичной ЛУ МБТ является тесный бытовой контакт с больными лекарственно-устойчивым туберкулезом. Использование разработанной компьютерной программы позволяет осуществлять выявление контактов и оперативно получать данные по спектру устойчивости МБТ у источника инфекции, а значит, назначать адекватное лечение даже при отсутствии бактериовыделения. Для предотвращения вторичной ЛУ МБТ в настоящее время применяется раннее выявление ЛУ МБТ с использованием молекулярно-генетических методов и современных режимов химиотерапии. С учетом спектра ЛУ МБТ на территории можно рекомендовать выявление ЛУ ускоренными методами к конкретным препаратам. Применение IT-технологий позволяет на новом уровне проводить исследование ЛУ МБТ на территории и обоснованно принимать решения для улучшения ситуации в конкретных эпидемиологических условиях.
Библиографическая ссылка
Голованова М.Н., Челнокова О.Г., Беликова Е.В., Ефремов И.А. РЕЗУЛЬТАТЫ МОНИТОРИНГА ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА НА ТЕРРИТОРИИ ЯРОСЛАВСКОЙ ОБЛАСТИ В 2011–2017 ГГ. С ИСПОЛЬЗОВАНИЕМ IT-ТЕХНОЛОГИЙ // Современные проблемы науки и образования. 2018. № 6. ;URL: https://science-education.ru/ru/article/view?id=28233 (дата обращения: 23.01.2026).
DOI: https://doi.org/10.17513/spno.28233



