Изучение механизмов и закономерностей метастазирования злокачественных опухолей, несмотря на достаточно длительную историю, представляет собой важную задачу современной медицинской науки, поскольку даже при своевременном и эффективном излечении первичного очага большинство больных погибает от развивающихся впоследствии метастазов, клетки которых приобретают повышенную агрессивность и резистентность к лекарственным препаратам [1; 2]. При исследовании этих вопросов в последнее время придается большое значение раковым стволовым клеткам (РСК, cancer stem cells - CSC), обладающим некоторыми общими свойствами со стволовыми клетками, по некоторым данным, именно они считаются источником развития и генерализации злокачественного процесса [3]. В норме во многих тканях присутствуют стволовые клетки, обеспечивающие их регенерацию, особенно интенсивную в клетках кишечного эпителия.
В настоящее время вероятностная модель развития опухоли, согласно которой каждая раковая клетка может давать начало новой опухоли как в первичном очаге, так и в метастазах, вытесняется иерархической моделью, допускающей наличие указанной способности только у части клеток со свойствами РСК. Данная популяция клеток отличается от остальных малигнизированных клеток способностью к неограниченному самообновлению, к воссозданию всего разнообразия трансформированных клеток «материнской» опухоли, результатом чего является иерархично организованная клеточная популяции [4]. РСК характеризуются также целым рядом особенностей фенотипической организации.
Исследование этой особой популяции РСК предполагает решение ряда сложных проблем, связанных с небольшим числом данных клеток, отсутствием однозначных идентификационных характеристик, на фоне повышенной генетической и фенотипической нестабильности, являющихся основой обратимых переходов в другие популяции клеток. Следует отметить, что именно РСК сейчас рассматриваются как причина устойчивости опухолей к радио- и химиотерапии, возникновения рецидивов и метастазов. Поэтому изучение РСК может принципиально изменить подходы к лечению онкологических пациентов, в частности КРР.
В литературе приводится ряд иммунофенотипических характеристик РСК различных опухолей, однако принадлежность маркеров к рассматриваемому типу клеток нередко является спорной в силу неоднозначности их функции. Кроме того, более полную картину может дать не один маркер, а их совокупность; не исключена также гетерогенность РСК, даже внутри одной ткани.
Одним из маркеров РСК ряда солидных опухолей считается CD44 (рака молочной железы, поджелудочной железы, опухолей головы и шеи и др.) [5]. Данная молекула, являясь адгезивным белком, определяет межклеточные взаимодействия, контакты клетки с элементами экстрацеллюлярного матрикса. CD44 участвует в процессах рециркуляции и активации лимфоцитов, играет определенную роль в таких процессах, как миелопоэз, лимфопоэз, ангиогенез. В клетке могут существовать множественные изоформы CD44: стандартная изоформа CD44s, а также несколько вариантов CD44v, из которых лучше изучена CD44v6. Тканевая организация, особенности микроокружения клетки, активность онкогенных сигнальных путей (например, Ras-MAPK) влияют на образование соответствующего типа CD44, хотя механизмы воздействия указанных факторов на выбор образуемой изоформы данной молекулы до конца не выяснены [6].
Во внеклеточном пространстве лигандами CD44, помимо гиалуроновой кислоты, являются: коллаген, ламинин, фибронектин, остеопонтин и некоторые гликозаминогликаны. Показаны антиапоптотические и прометастатические эффекты активации СD44. Влияя на интенсивность деградации гиалуроновой кислоты и определяя расположение на мембране матрикс-модифицирующих ферментов, СD44 может участвовать в моделировании опухолевого микроокружения, а расщепление самого CD44, которое отмечалось в ткани опухоли, способствовало увеличению миграционной активности клеток.
Показано, что комплекс лиганд-СD44 вовлечен в регуляцию эпителиально-мезенхимального перехода и стволовости в клетках РМЖ, рака головы и шеи, яичников; взаимодействуя с рецепторами факторов роста (EGFR- и HER2), изменяет активность ряда транскрипционных факторов и их комплексов с дальнейшей экспрессией генов, определяющих стволовость, торможение апоптоза и лекарственную устойчивость [6].
Следствием указанных особенностей РСК, у CD44+ опухолевых клеток описана более высокая способность к образованию опухолей, устойчивость к лекарственному воздействию, меньшая склонность к апоптозу по сравнению с CD44- клетками [7]. Однако роль CD44 в прогрессии опухоли и образовании метастазов при КРР неоднозначна [8].
Еще одним поверхностным маркером, используемым для идентификации РСК, является CD133 (АС133, проминин-1), особенностями структурной организации которого является наличие пяти трансмембранных доменов, обуславливающих взаимодействие с холестеролом плазматических мембран. Эта структура ассоциирована с мембранными выпячиваниями, но функция её точно не известна [6]. Определяются три изоформы данного гликопротеина.
Экспрессия CD133 снижается при увеличении степени дифференцировки клеток, что позволяет идентифицировать РСК. CD133 определяется на ряде клеток, не связанных с опухолевым ростом: в гемопоэтических и нейрональных стволовых клетках, клетках-предшественницах, в эмбриональных эпителиях [6].
В эксперименте L. Ricci-Vitiani et al. (2007) продемонстрировали, что CD133+ раковые клетки, введенные иммунодефицитным мышам, формировали опухоли, а CD133- нет [9]. Низкая пролиферативная активность CD133+ клеток КРР способствует их высокой химио- и радиорезистентности [10], вследствие чего его экспрессия CD133 обратно коррелирует с выживаемостью пациентов, получавших 5-фторпиримидины [11].
К настоящему времени, таким образом, накоплен определенный опыт изучения особенностей фенотипической характеристики РСК, но уровень экспрессии этих молекул при различной распространенности процесса не изучен в полной мере.
Целью данной работы явилась оценка частоты и уровня экспрессии маркеров стволовых клеток колоректального рака CD44 и CD133 при различной распространенности процесса на материале больных ФГБУ «РНИОИ» Минздрава России.
Материалы и методы исследования
При проведении работы были исследованы образцы опухолевой ткани КРР 60 больных: 31 женщины и 29 мужчин в возрасте от 37 до 78 лет. Первая группа обследованных включала 30 больных без отдаленного метастазирования: T2-4N0M0 (n=21), T3-4N1M0 (n=9). Вторая группа – 30 пациентов с метастазами в печень: T3-4aN0M1 (n=8) и T3-4аN1-2M1 (n=22). По гистологическому строению все опухоли были аденокарциномами.
В работе использован иммуногистохимический метод определение экспрессии CD44 и CD133 на опухолевых клетках, с использованием мышиных моноклональных антител к CD44 клона 156-3С11 (ThermoScientific) в разведении 1:100 и поликлональных кроличьих антител к CD133 (MyBioSource) в разведении 1:200 с использованием автостейнера Thermo Scientific 480S. Экспрессия белка CD44 имеет мембранную локализацию и определялась как положительная, когда окрашивание было выявлено в 10% (cut-off) и более всех опухолевых клеток. Белок CD133 также имеет мембранную локализацию; его экспрессию считали положительной, когда окрашивание было выявлено в более 5% всей опухоли. Кроме того, характеризовали интенсивность окрашивания клеточной мембраны: 0, 1+ слабое, 2+ умеренное, 3+ сильное окрашивание. При наличии интенсивности окрашивания 2+ и 3+ случай рассматривался как позитивный.
Оценку достоверности отличий результатов исследования осуществляли с помощью программы STATISTICA 7.0 (StatSoftInc., США) с применением t-критерия Стьюдента.
Результаты исследования и их обсуждение
Результаты исследования представлены на рисунках 1-3. Позитивная экспрессия CD44 на опухолевых клетках при отсутствии метастазов в печень и при их наличии выявлена в 40% (12 из 30) и 30% (9 из 30) опухолей, в то время как для CD133 эти показатели составили 60% (18 из 30) и 83,3% (25 из 30) соответственно (рис. 1).
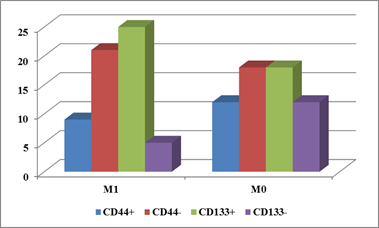
Рис. 1. Доля опухолей с позитивной и негативной экспрессией маркеров РСК при наличии и отсутствии отдаленных метастазов
Как видно из рисунка 1, при метастазирующем и при неметастазирующем КРР среди первичных опухолей превалируют экспрессирующие CD133, но не CD44; различие особенно наглядно проявляется в опухолях с метастазами в печень.
В опухолях больных 1-й группы разброс количества CD44+ клеток составлял от единичных до 25% всей площади опухоли (в среднем 9,8±3,1%), во 2-й группе – от единичных до 15% (в среднем 6,6±2,9%); различия статистически недостоверны (p≥0,05). Для CD133+ клеток соответствующие показатели составили: в группе больных без отдаленного метастазирования от единичных до 15% всей площади опухоли (в среднем 8,6±3,1%), в группе с отдаленными метастазами – от единичных до 25% (в среднем 13,8±2,4%); различия также статистически недостоверны (p≥0,05).
Хотя статистически значимых различий количества клеток, позитивных по экспрессии маркеров РСК, в зависимости от распространенности процесса и не установлено, следует отметить, что при наличии метастазирования в печень в первичной опухоли нарастает количество CD133+ и снижается количество CD44+ (рис. 2).
Более детальный анализ данных внутри каждой группы подтверждает разнонаправленный характер экспрессии CD44 и CD133: отмечено нарастание как доли CD133+ опухолей, так и экспрессии этого маркера их клетками по мере увеличения распространенности КРР (рис. 3), в частности, регистрируется статистически достоверное повышение количества CD133+ клеток в опухолях T3-4aN1-2M1 по сравнению с T2-4N0M0 (16,7±3,4 против 6,3±3,6%, p<0,05).
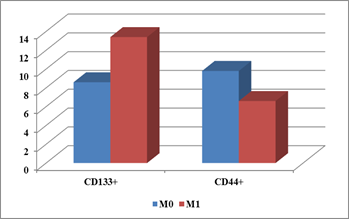
Рис. 2. Экспрессия CD133 и CD44 в опухолях с метастазами и без метастазов.
Ось Y - % позитивно окрашенных клеток
В опухолях, дающих отдаленные метастазы (T3-4aN0M1), CD44 лучше экспрессирован в клетках первичной опухоли, чем метастазов: среди 8 образцов последних наличие экспрессии выше точки cut-off не выявлено. Аналогичная картина наблюдается и в опухолях T3-4aN1-2M1, среди которых экспрессия CD44 найдена в 27,3% образцов опухолей, и только в 9,1% образцов метастатической ткани. Несмотря на немногочисленность образцов исследованных метастатических лимфатических узлов, следует отметить, что в них данный маркер также экспрессируется реже, чем в первичной опухоли. Напротив, для маркера CD133 отмечено возрастание процента позитивно окрашенных опухолевых клеток в метастазах по сравнению с тканью первичной опухоли. Например, среди исследованных образцов T3-4aN1-2M1 опухолей и их метастазов все 22 образца последних (100%) оказались CD133+ и только 9,1% из них были CD44+.
Таким образом, нами выявлен оппозитный характер экспрессии двух исследованных маркеров, которые, согласно данным литературы, присущи раковым стволовым клеткам КРР. Полученные нами результаты по экспрессии CD44 согласуются с данными некоторых авторов. В частности, в работе Alaa Afify et al. (2016) отмечается снижение экспрессии CD44 маркера в большинстве метастатических опухолей. Показано, что в 65% случаев метастазов аденокарцином в лимфатические узлы отсутствует экспрессия CD44, в то время как в 92% случаев первичной опухоли она выявляется [12].
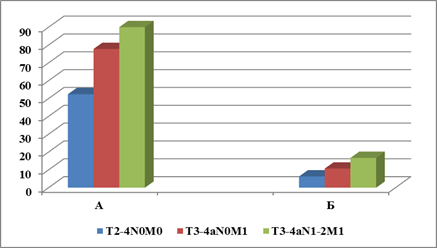
Рис. 3. Экспрессия CD133 в опухолях при наличии и отсутствии отдаленных метастазов. Ось Y - % А – % опухолей с позитивной экспрессией CD133; Б – % CD133+ опухолевых клеток в опухоли
Снижение экспрессии СD44 на клетках метастатического очага, вероятнее всего, обуславливается протеолизом проксимальной области молекулы металлопротеиназой I типа, и, как следствие, приводит к потере адгезивных свойств опухолевых клеток с усилением их миграции, повышением их метастатического потенциала. Picco N. et al. (2016) предполагают, что экспрессия CD44 может меняться при метастазировании в зависимости от микроокружения [13], хотя при изучении экспрессии этого маркера в первичных опухолях и метастазах рака молочной железы не нашли различий [14].
В целом же данные литературы о роли исследованных маркеров в инициации и метастазировании КРР разноречивы, что может обуславливаться различными методическими подходами авторов. Как и при изучении других процессов, результаты, полученные в культурах, в эксперименте и на клиническом материале могут не совпадать, однако они оказались неоднозначными и при использовании сходных моделей.
Так, одними авторами при проведении культуральных исследований показано, что опухоль-инициирующими клетками КРР являются CD133+CD44+. Другими авторами в опытах на культурах клеток и на иммунодефицитных мышах установлено, что как CD133+, так и CD133- клетки могут быть опухоль-инициирующими, при этом они указывают на то, что более агрессивными являются метастатические CD133-, экспрессирующие CD44 [15].
Напротив, Ricci-Vitiani L. et al. (2007) показали, что недифференцированные CD133+, в отличие от CD133- клеток КРР могут образовывать долгоживущие сфероиды, что является признаком CSC, сохраняя при этом свою антигенную структуру [15].
По данным ряда исследователей, в опухолях больных была выявлена более высокая экспрессия CD44s и CD44v6 в первичных опухолях по сравнению с их метастазами, причем она возрастала с увеличением G и инвазивности первичной опухоли, а продолжительность жизни больных с CD44s+ метастазами была ниже, чем при CD44s- [16].
Несмотря на многочисленные сообщения о том, что СD133 присутствует на многих РСК солидных опухолей, включая КРР [16; 17], нам удалось обнаружить экспрессию CD133 лишь в 15,3% проб КРР, причем всего в 11,1% случаев была найдена его гиперэкспрессия, встречавшаяся только в умеренно- и высокодифференцированных опухолях. Многие авторы считают гиперэкспрессию CD133 маркером неблагоприятного прогноза [17].
Заключение
Колоректальный рак различной распространенности характеризуется более выраженной положительной экспрессией CD44 маркера в неметастазирующих опухолях, чем в опухолях, дающих метастазы в печень. При этом в метастазах прослеживается тенденция к снижению данного показателя по сравнению с его уровнем в первичной опухоли.
Увеличение агрессивности опухоли сопровождается нарастанием как частоты выявления, так и экспрессии CD133 - в метастатической ткани ее уровень соответствует первичной опухоли, из которой происходит метастазирование.
Мы полагаем, что определение экспрессии CD44 и CD133 иммуногистохимическим методом можно использовать в качестве одного из факторов прогнозирования течения КРР, для чего необходимо установить более четкие количественные критерии, а также провести сравнительный анализ с чувствительностью больных к адъювантной химиотерапии и показателями их общей и бессобытийной выживаемости.
Библиографическая ссылка
Златник Е.Ю., Кит О.И., Новикова И.А., Ульянова Е.П., Сагакянц А.Б., Теплякова М.А., Егоров Г.Ю., Чупанов Г.М., Черникова Е.Н. ВОЗМОЖНАЯ РОЛЬ СТВОЛОВЫХ ОПУХОЛЕВЫХ КЛЕТОК В ПРОЦЕССАХ МЕТАСТАЗИРОВАНИЯ КОЛОРЕКТАЛЬНОГО РАКА // Современные проблемы науки и образования. 2018. № 6. ;URL: https://science-education.ru/ru/article/view?id=28217 (дата обращения: 16.02.2026).



