До настоящего времени одним из наиболее часто применяемых методов хирургической реваскуляризации миокарда при ишемической болезни сердца (ИБС) у пациентов с многососудистым поражением коронарных артерий является коронарное шунтирование (КШ), с использованием искусственного кровообращения (ИК) и без него [1-3].
Несмотря на то что необходимость в использовании этого метода коррекции в последние десятилетия «молодеет», часто в проведении КШ нуждаются больные пожилого возраста (ПВ) [4-6]. Но, по мнению многих исследователей, это хирургическое вмешательство у данной категории пациентов сопряжено со значительными периоперационными рисками развития потенциально фатальных осложнений (острого инфаркта миокарда (ОИМ), острого нарушения мозгового кровообращения (ОНМК), синдрома полиорганной недостаточности (СПОН), острой почечной недостаточности (ОПН)) [7-9].
Во многих клиниках, занимающихся проблемой хирургического лечения ИБС, проводят исследования, направленные на снижение риска развития периоперационных осложнений. И в настоящее время удалось расширить показания к операциям КШ на работающем сердце и чрескожным коронарным вмешательствам, что исключало бы риски, связанные с ИК [10-12]. Но данная тактика часто неприменима к пациентам ПВ, у которых часто диагностируется низкая сократительная функция левого желудочка и многососудистое поражение коронарных артерий [13; 14]. Поэтому поиск способов снижения частоты развития осложнений КШ с ИК или без него у пациентов данной категории не потерял своей актуальности [11; 14].
В решении вопросов профилактики существенная роль отводится врачам анестезиологам-реаниматологам, которые определяют объем и качество анестезиологического пособия, медикаментозной поддержки, инфузионно-трансфузионной терапии. Им приходится корригировать значительные эндокринно-метаболические, системные воспалительные, гемодинамические, гемостатические и другие нарушения, которые сопровождают КШ в той или иной степени [1; 2; 14].
Цель исследования. Проведение сравнительного анализа послеоперационных осложнений КШ у пациентов разных возрастных групп при применении традиционной и сочетанной анестезии (с использованием грудной эпидуральной анальгезии (ГЭА)).
Материал и методы исследования. С января 2016 по сентябрь 2018 г. кафедрой анестезиологии и реаниматологии ВолгГМУ, на базе Клиники № 1 ВолгГМУ, проведено проспективное контролируемое исследование результатов хирургической реваскуляризации миокарда у 277 пациентов с ИБС, которым было выполнено КШ двух и более ветвей коронарных артерий с использованием ИК или без него.
Все исследуемые разделены на две группы. В основную группу (ОГ, n = 102) были включены пациенты пожилого возраста (от 65 лет и старше). Больные контрольной группы (КГ, n = 175) были моложе 65 лет.
Каждая из исследованных групп была разделена, в зависимости от вида анестезиологического пособия, на подгруппы. В первых подгруппах (ОГ-ГЭА (n = 60) и КГ-ГЭА (n = 76)) в качестве анестезиологического пособия применялась сочетанная анестезия (с ГЭА на уровне Th IV-V (с постоянной инфузией перфузором (B.Braun, Германия) растворов наропина (ропивакаина) 0,3-0,5% - 6-7 мл/час с фентанилом 0,004-0,006 мг/мл)). У больных вторых подгрупп (ОГ-ТА (n = 42) и КГ-ТА (n = 99)) использовалась традиционная анестезия (ТА): внутривенная инфузия раствора пропофола 3-4 мг/кг х час в сочетании с постоянной инфузией раствора фентанила 0,004-0,005 мг/кг х час.
У больных обеих групп индукция в наркоз выполнялась болюсным внутривенным введением раствора пропофола 2 мг/кг, релаксация обеспечивалась деполяризующим (раствора листенона 1-1,5 мг/кг) и недеполяризующим (раствора ардуана 0,04-0,06 мг/кг) миорелаксантами. В наиболее травматичные этапы операции (стернотомия, торакотомия, энуклеация сердца) дополнительно болюсно вводился раствор фентанила 0,004-0,006 мг/кг. ИВЛ в режиме нормовентиляции обеспечивалась наркозным аппаратом WATO EX-65/55 (Mindray, Китай). ИК в режиме нормотермии выполнялось с применением аппарата Maquet HL 20 (Германия), для кардиоплегии (КП) использовали охлажденный раствор кустодиола 1500-2000 мл.
В базу данных вносили более 50 переменных:
1) демографические данные (пол, возраст, индекс массы тела (ИМТ));
2) характер операционного и анестезиологического пособий;
3) заключения инструментальной диагностики (УЗИ, КТ и др.);
4) результаты лабораторной диагностики;
5) показатели газотранспортной функции крови, кислотно-основного
состояния и лактата артериальной крови определяли с помощью анализатора
ABL-625 (Radiometer, Дания), общий анализ крови выполняли на автоматическом гематологическом анализаторе Mindray BC-5800 (Китай), биохимические показатели крови определяли на автоанализаторе Olimpus AU 400 (Германия), уровень кортизола на автоматическом иммунохимическом анализаторе Cobas-e 411 (Roche, Германия) и др.;
6) выводы консилиума врачей о наличии либо об отсутствии того или иного осложнения.
Достоверность полученных результатов и обоснованность выводов обеспечивались исключением систематических ошибок. Для сравнения независимых групп по качественному признаку выбирали критерий χ2 Пирсона. Частоту бинарного признака двух несвязанных групп вычисляли с применением критерия «относительный риск» (ОР) с расчетом 95% доверительного интервала (95% ДИ). Полученные результаты обрабатывались с помощью специализированного пакета статистических программ Statistica 10 (StatSoft Inc., USA). При статистически достоверном различии сравниваемых групп коэффициент статистической значимости (p) был менее или равен 0,05 и/или 95% ДИ не включал числовой показатель 1,0.
Результаты исследования и их обсуждение. На начальном этапе обработки полученных результатов исследования было необходимо убедиться в сопоставимости групп сравнения. Для этой цели мы провели сравнительный анализ данных пациентов основной и контрольной групп, которые могли бы исказить полученные результаты и привести к ошибочным выводам. Больных исследованных групп и подгрупп сравнили по возрасту и полу, травматизму оперативного вмешательства (КШ с применением ИК или без него, длительность операции и ИК), по степени операционно-анестезиологического риска и структуре коморбидного фона. Полученные результаты обработки базы данных представлены в таблицах 1, 2.
Как показано в таблице 1, по большинству изученных переменных группы сравнения были сопоставимы (по полу и возрасту, характеру оперативного вмешательства (с ИК или без него), длительности оперативного вмешательства и ИК (χ2 Пирсона, p>0,05)). Только при сравнении подгрупп ОГ-ГЭА и КГ-ГЭА обнаружено, что в подгруппе ОГ-ГЭА было достоверно больше пациентов с IV степенью операционно-анестезиологического риска (χ2 Пирсона, p=0,0079). Но при сравнении групп исследования по этому показателю выяснилось, что группы сопоставимы (χ2 Пирсона, p=0,1054).
В основной группе, по сравнению с контрольной группой, было относительно меньше женщин (13,7% (14/102) против 15,4% (27/175)) и больше пациентов, у которых КШ выполнялось с использованием ИК (32,4% (33/102) против 30,9% (54/175)), больных с высокой степенью (IV) операционно-анестезиологического риска (39,2% (40/102) против 29,7% (52/175)). Но данные различия групп сравнения были статистически недостоверны (χ2 Пирсона, p>0,05) и не могли повлиять на полученные результаты.
Таблица 1
Основные переменные пациентов подгрупп исследования
|
Переменная |
Число пациентов (подгруппы), n(%) |
p, χ2 Пирсона |
|
|
Основная группа (n = 102) |
Контрольная группа (n = 175) |
||
|
Подгруппа ГЭА |
ОГ-ГЭА |
КГ-ГЭА |
|
|
Пол |
|||
|
Женщины |
5(8,3%) |
10(13,2%) |
0,3725 |
|
Мужчины |
55(91,7%) |
66(86,8%) |
|
|
Коронарное шунтирование |
|||
|
С ИК |
21(35,0%) |
32(42,1%) |
0,4855 |
|
Без ИК |
28(65,0%) |
55(57,9%) |
|
|
Длительность операции, мин |
261,7±71,4 |
258,1±67,8 |
0,3891 |
|
Длительность ИК, мин |
87,9±28,7 |
92,6±32,1 |
0,4186 |
|
О-А риск по МНОАР |
|||
|
III |
31(51,7%) |
56(73,7%) |
0,0079* |
|
IV |
29(48,3%) |
20(26,3%) |
|
|
Всего |
60 |
76 |
|
|
Подгруппа ТА |
ОГ-ТА |
КГ-ТА |
|
|
Пол |
|||
|
Женщины |
9(21,4%) |
17(17,2%) |
0,5511 |
|
Мужчины |
33(78,6%) |
82(82,8%) |
|
|
Коронарное шунтирование |
|||
|
С ИК |
11(26,2%) |
22(22,2%) |
0,6108 |
|
Без ИК |
31(73,8%) |
77(77,8%) |
|
|
Длительность операции, мин |
275,5±74,1 |
272,8±72,4 |
0,6819 |
|
Длительность ИК, мин |
97,5±33,2 |
95,7±31,5 |
0,7187 |
|
О-А риск по МНОАР |
|||
|
III |
31(73,8%) |
67(67,7%) |
0,4695 |
|
IV |
11(26,2%) |
32(32,3%) |
|
|
Всего |
42 |
99 |
|
|
Итого |
102(100%) |
175(100%) |
|
ОР – относительный риск; ДИ – доверительный интервал; О-А риск – операционно-анестезиологический риск; МНОАР – московское научное общество анестезиологов-реаниматологов.
При сравнении групп исследования по структуре коморбидного фона (табл. 2) определено, что группы были сопоставимы и по этому показателю. В основной группе было больше пациентов с постинфарктным кардиосклерозом (ПИКС, 71,6% против 65,1%), сахарным диабетом (СД, 18,6% против 17,1%), хронической ишемией головного мозга (ХИГМ, 77,5% против 54,9%) и хронической болезнью почек (ХБП, 4,9% против 4,6%), но относительно меньше больных с последствиями острого нарушения мозгового кровообращения (ОНМК, 4,9% против 5,1%) и с ожирением I-II степени (15,7% против 21,1%). Но, данные различия групп сравнения были статистически недостоверны (χ2 Пирсона, p>0,05).
Таблица 2
Структура коморбидного фона
|
Сопутствующая патология |
Число пациентов, n(%) |
p, χ2 Пирсона |
|
|
Основная группа (n = 102) |
Контрольная группа (n = 175) |
||
|
ПИКС |
73(71,6%) |
114(65,1%) |
0,2707 |
|
СД |
19(18,6%) |
30(17,1%) |
0,7548 |
|
ХОБЛ |
4(3,9%) |
7(4,0%) |
0,9743 |
|
Последствия ОНМК |
5(4,9%) |
9(5,1%) |
0,9297 |
|
ХБП |
5(4,9%) |
8(4,6%) |
0,9002 |
|
ХИГМ |
79(77,5%) |
96(54,9%) |
0,0002* |
|
Ожирение, степень |
|||
|
I (ИМТ 30-34,9 кг/м2) |
11(10,8%) |
25(14,3%) |
0,4032 |
|
II (ИМТ 35-40 кг/м2) |
5(4,9%) |
12(6,9%) |
0,5132 |
ПИКС – постинфарктный кардиосклероз; СД – сахарный диабет; ХОБЛ – хроническая обструктивная болезнь легких; ОНМК – острое нарушение мозгового кровообращения; ХБП – хроническая болезнь почек; ХИГМ – хроническая ишемия головного мозга.
Структура и частота развития ранних послеоперационных осложнений у пациентов групп исследования показана в таблице 3.
Таблица 3
Осложнения раннего послеоперационного периода
|
Осложнение |
Число пациентов, n(%) |
ОР (95% ДИ) |
|
|
Основная группа (n = 102) |
Контрольная группа (n = 175) |
||
|
ОПН |
4(3,9%) |
6(3,4%) |
1,15(0,31-4,23) |
|
ОИМ |
2(2,0%) |
2(1,1%) |
1,72(0,23-12,75) |
|
Пневмония |
15(14,7%) |
12(6,9%) |
2,14(1,04-5,27)* |
|
ФП |
12(11,8%) |
16(9,1%) |
1,29(0,60-2,95) |
|
ПЖТ |
5(4,9%) |
5(2,9%) |
1,72(0,49-6,29) |
|
СПОН |
8(7,8%) |
7(4,0%) |
1,96(0,71-5,88) |
|
ОПП |
3(2,9%) |
7(4,0%) |
0,74(0,18-2,92) |
|
Гидроторакс |
20(19,6%) |
19(10,9%) |
1,81(1,01-4,00)* |
|
Нет осложнений |
50(49,0%) |
120(68,6%) |
0,71(0,27-0,73)* |
*- статистически достоверное различие (р<0,05); ОПН – острая почечная недостаточность; ОИМ - острый инфаркт миокарда; ФП – фибрилляция предсердий; ПЖТ – пароксизмальная желудочковая тахикардия; СПОН – синдром полиорганной недостаточности; ОПП – острый послеоперационный панкреатит.
У пациентов пожилого возраста определено значительное повышение относительного риска развития ОИМ (ОР=1,72), острой почечной недостаточности (ОР=1,15), пароксизмов фибрилляции предсердий и желудочковой тахикардии (ОР=1,29 и ОР=1,72 соответственно), синдрома полиорганной недостаточности (ОР=1,96). Но из-за небольших объема выборки и частоты развития этих осложнений различия групп исследования по этому показателю статистически недостоверны (p>0,05). У больных основной группы определено достоверное увеличение частоты развития пневмонии (ОР=2,14; 95% ДИ (1,04-5,27), p<0,05) и клинически значимого гидроторакса (ОР=1,81; 95% ДИ (1,01-4,00), p<0,05), потребовавшее либо продления активной аспирации более 24 часов, либо проведения плевральной пункции. И как итог, ранний послеоперационный период у больных контрольной группы (моложе 65 лет) протекал без клинически значимых осложнений достоверно чаще, чем у пациентов основной группы (в 68,6% против 49,0% случаев: ОР=1,40; 95% ДИ (1,37-3,77), p<0,05).
При сравнении подгрупп исследования (табл. 4) основной группы (ОГ-ГЭА и ОГ-ТА) доказано, что у пациентов пожилого возраста применение сочетанной анестезии (с продленной ГЭА) значительно снижает относительный риск развития ОПН (ОР=0,70), пневмонии (ОР=0,53), ПЖТ (ОР=0,47), СПОН (ОР = 0,23) и клинически значимого гидроторакса (ОР=0,12). У больных ОГ-ГЭА подгруппы не было ни одного случая развития ОИМ, а у пациентов ОГ-ТА подгруппы это осложнение зафиксировано в 4,8% наблюдений. Неосложненный ранний послеоперационный период наблюдался у 60,0% больных ОГ-ГЭА подгруппы и только у 33,3% пациентов ОГ-ТА подгруппы (ОР = 1,80; 95% ДИ (1,31-6,90), p<0,05).
Таблица 4
Основные осложнения у пациентов подгрупп исследования
|
Группа |
Осложнение |
Число пациентов, n(%) |
ОР (95 % ДИ) p, χ2 Пирсона |
|
|
ГЭА-подгруппа |
ТА-подгруппа |
|||
|
Основная группа (n = 102) |
ОПН |
2(3,3%) |
2(4,8%) |
0,70(0,09-5,21) |
|
ОИМ |
0(0,0%) |
2(4,8%) |
p=0,0878 |
|
|
Пневмония |
6(10,0%) |
8(19,0%) |
0,53(0,15-1,50) |
|
|
ФП |
7(11,7%) |
5(11,9%) |
0,98(0,28-3,36) |
|
|
ПЖТ |
2(3,3%) |
3(7,1%) |
0,47(0,07-2,86) |
|
|
СПОН |
2(3,3%) |
6(14,3%) |
0,23(0,04-1,10) |
|
|
ОПП |
2(3,3%) |
1(2,4%) |
1,4(0,12-16,55) |
|
|
Гидроторакс |
3(5,0%) |
17(40,5%) |
0,12(0,02-0,29)* |
|
|
Нет осложнений |
36(60,0%) |
14(33,3%) |
1,80(1,31-6,90)* |
|
|
Всего |
60 |
42 |
||
|
ОПН |
1(1,3%) |
5(5,1%) |
0,26(0,03-2,24) |
|
|
Контрольная группа (n = 175) |
ОИМ |
0(0,0%) |
2(2,0%) |
p=0,2127 |
|
Пневмония |
3(3,9%) |
9(9,1%) |
0,43(0,11-1,60) |
|
|
ФП |
3(3,9%) |
13(13,1%) |
0,30(0,07-0,99)* |
|
|
ПЖТ |
1(1,3%) |
4(4,0%) |
0,33(0,03-2,96) |
|
|
СПОН |
1(1,3%) |
6(6,1%) |
0,22(0,02-1,79) |
|
|
ОПП |
1(1,3%) |
6(6,1%) |
0,22(0,02-1,79) |
|
|
Гидроторакс |
3(3,9%) |
16(16,2%) |
0,24(0,06-0,77)* |
|
|
Нет осложнений |
63(82,9%) |
57(57,6%) |
1,44(1,73-7,38)* |
|
|
Всего |
76 |
99 |
||
*- статистически достоверное различие (p<0,05).
При сравнении подгрупп контрольной группы (у пациентов моложе 65 лет) были получены аналогичные результаты. При использовании сочетанной анестезии значительно снижался относительный риск развития осложнений раннего послеоперационного периода (ОР=0,22-0,43). У больных КГ-ГЭА подгруппы достоверно чаще, чем у пациентов КГ-ТА подгруппы, ранний послеоперационный период протекал без осложнений (в 82,9% против 57,6%) (ОР = 1,44; 95% ДИ (1,73-7,38), p<0,05).
На рисунке представлена структура и частота осложнений раннего послеоперационного периода у пациентов общей выборки.
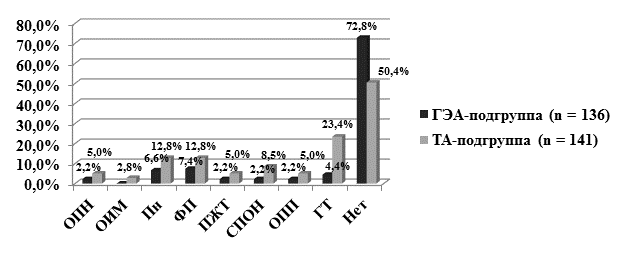
Осложнения у пациентов с сочетанной и традиционной анестезией (ОПН – острая почечная недостаточность; ОИМ – острый инфаркт миокарда; Пн – пневмония;
ФП – фибрилляция предсердий; ПЖТ – пароксизмальная желудочковая тахикардия;
СПОН – синдром полиорганной недостаточности; ОПП – острый послеоперационный панкреатит; ГТ – гидроторакс; Нет - нет осложнений)
При статистической обработке полученных данных доказано, что у больных с традиционной анестезией достоверно чаще были диагностированы клинически значимый гидроторакс, ОИМ и СПОН, чем у больных с сочетанной анестезией (χ2 Пирсона, p=0,0000, p=0,0479 и p=0,0205 соответственно). Определено, что использование ГЭА в ранний послеоперационный период снижает, но статистически незначимо (χ2 Пирсона, p > 0,05), риск развития ОПН (2,2% против 5,0%) и вентилятор-ассоциированной пневмонии (6,6% против 12,8%), нарушений ритма сердца (9,6% против 17,8%) и ОПП (2,2% против 5,0%).
Более частое осложненное течение раннего послеоперационного периода у пожилых пациентов, по сравнению с пациентами моложе 65 лет, потребовало достоверного увеличения длительности госпитализации (до 25,8±5,3 суток против 16,7±4,5 суток соответственно; χ2 Пирсона, p=0,0316). В то же время применение сочетанной анестезии (с продленной ГЭА) позволило снизить как время нахождения больных в палатах интенсивной терапии, так и длительность госпитализации больных ГЭА-подгрупп (с 50,7±5,2 часа до 44,3±4,8 часа и с 19,8±6,3 суток до 17,6±5,8 суток соответственно).
Летальность в ОГ и КГ составила 2,0% (2/102) и 1,1% (2/175), в ГЭА- и ТА-подгруппах – 1,5% (2/136) и 1,4% (2/141) соответственно. Причинами летального исхода были ОИМ в 50,0% (2/4) и СПОН в 50,0% (2/4) наблюдений.
Клинически значимых осложнений, которые потребовали бы специализированного лечения (эпидуральная гематома или абсцесс, эпидурит, менингит и др.), связанных с применением ГЭА, не зафиксировано.
Как показано в данном исследовании, пожилой возраст существенно осложняет течение раннего послеоперационного периода после КШ, что подтверждается и результатами других исследователей [4; 6; 9]. Возрастное снижение адаптационных возможностей к операционному стрессу, часто системное поражение сосудов и эндотелиальная дисфункция, нарушение перфузии периоперационной зоны на фоне возрастных изменений гормонального статуса приводят к повышению риска развития послеоперационных осложнений у пациентов данной категории. Больные старшей возрастной группы, при исходно сопоставимом характере течения ИБС с пациентами моложе 65 лет, как правило, находятся в худшем функциональном состоянии.
Полученные результаты доказывают, что применение сочетанной анестезии (с продленной ГЭА) эффективно снижает риск развития осложнений после КШ у пациентов общей выборки, как у больных моложе 65 лет, так и у пациентов более старшего возраста. Достоверное снижение риска развития ОИМ и СПОН при использовании ГЭА можно объяснить более эффективным снижением степени выраженности операционного стресс-ответа (модуляция гормонально-метаболического и системного воспалительного компонентов) и эндотелиальной дисфункции, улучшением перфузии зоны операции и прокинетическим эффектами ГЭА, повышением качества послеоперационного обезболивания.
Выводы
- выполнение коронарного шунтирования у пациентов пожилого возраста сопряжено со значительным увеличением риска развития послеоперационных осложнений;
- применение сочетанной анестезии (с продленной ГЭА) во время КШ снижает риск развития осложнений как у пожилых пациентов, так и у больных моложе 65 лет;
- применение ГЭА при выполнении КШ является безопасным методом анальгезии.
Библиографическая ссылка
Экстрем А.В., Туровец М.И., Мозговой П.В., Попов А.С., Лопушков А.В. ПРОФИЛАКТИКА ОСЛОЖНЕНИЙ КОРОНАРНОГО ШУНТИРОВАНИЯ У ПОЖИЛЫХ ПАЦИЕНТОВ // Современные проблемы науки и образования. 2018. № 5. ;URL: https://science-education.ru/ru/article/view?id=28174 (дата обращения: 20.02.2026).
DOI: https://doi.org/10.17513/spno.28174



