Вне зависимости от того, что заболеваемость раком желудка в России не находится на высоком уровне, в структуре смертности от злокачественных новообразований он занимает 2 место. Это свидетельствует о поздней диагностике рака желудка и агрессивном течении заболевания [1]. Процессы прогрессирования заболевания, вероятность метастазирования и развитие устойчивости к применяемой терапии определяются особенностями экспрессии определенных генов, изменением фенотипа опухолевых клеток, что сопровождается закономерными метаболическими, морфологическими и иммунологическими их изменениями [2; 3]. Кроме того, указанные свойства опухолей определяются наличием особой субпопуляции клеток – опухолевыми, раковыми стволовыми клетками (ОСК, РСК). Показано, что маркеры, выявленные на раковых стволовых клетках, представлены и на определенных типах соматических клеток организма человека, на эмбриональных и мезенхимальных стволовых клетках [4]. Несмотря на то что данные клетки достаточно трудно идентифицировать, число работ, посвященных изучению биологических и клинических особенностей ОСК при различных формах онкологических заболеваний, неуклонно растет [5].
В разных опухолях ОСК экспрессируют различные маркеры и их комбинации, которые выявляются также на нормальных стволовых клетках или клетках-предшественницах, элементах стромы опухоли или опухолевых клетках, не имеющих свойств стволовых, поэтому, возможно, только часть клеток, выбранных по их экспрессии, является ОСК. К настоящему моменту окончательно не решен вопрос о стабильности фенотипа ОСК в процессе прогрессии опухоли или при переходе из систем in vivo к in vitro. Кроме того, разные подтипы опухолей одного органа могут иметь ОСК, экспрессирующие разные маркеры [6].
Одним из маркеров раковых стволовых клеток является CD44 - это адгезивный белок, который участвует во взаимодействиях клетка–клетка и клетка–межклеточный матрикс посредством своего лиганда – гиалуроновой кислоты, а также коллагена, ламинина, фибронектина, остеопонтина и некоторых гликозаминогликанов. У CD44+ опухолевых клеток описана более высокая туморогенность (пролиферативный потенциал, способность к формированию колоний), резистентность к лекарственному воздействию, меньшая склонность к апоптозу по сравнению с CD44- клетками [7].
CD44 изолированно или в комбинации с другими маркерами выявляется на ОСК в раке молочной, предстательной и поджелудочной желез, печени, колоректальном раке, опухолях головы и шеи, желудка [8].
CD133 (АС133, проминин-1) впервые был обнаружен Х. Yin и соавт. в 1997 г. на гемопоэтических стволовых клетках [9]. Это гликопротеин с пятью трансмембранными доменами молекулярной массой 120 кД, взаимодействующий с холестеролом [10], принадлежит к семейству промининов, имеет 3 изоформы: CD133-1, CD133-2, CD133-3. Ген (PROM1) картирован на 4р15.32. Ассоциирован с мембранными выпячиваниями, но функция его точно не известна. Было также показано, что экспрессия антигена CD133 коррелирует с выживаемостью пациентов с аденокарциномой желудка [11]. Кроме того, у пациентов с колоректальной карциномой комбинация CD133, CD44 и CD166 может успешно идентифицировать пациентов при рецидиве и метастазировании с низким, средним и высоким риском [12].
Для идентификации ОСК при раке желудка чаще всего используют фенотипический маркёр CD44+, наличие которого с высокой вероятностью может указывать на данный тип клеток. Использование же CD133 при обнаружении РСК при раке желудка отмечается не так часто, и его информативность при данной форме опухолей обсуждается.
Таким образом, к настоящему времени накоплен определенный опыт исследования ОСК при различных солидных опухолях, однако вопросы, связанные с особенностями фенотипической организации и «поведении» данной популяции клеток при ряде заболеваний, в частности при различных формах рака желудка, остаются изучены не полностью.
Цель работы: исследование CD44+, CD133+ - ОСК в различных тканях при не метастатической и метастатической форме рака желудка с использованием метода проточной цитофлюориметрии.
Материалы и методы
В исследование включено 18 больных раком желудка в возрасте от 30 до 80 лет. Больные давали письменное информированное согласие на проведение исследований, подвергались стандартному в данном случае объему обследований. Пациенты были разделены на две группы:
1 группа – М0, рак желудка без метастазов, 11 человек, степень дифференцировки опухоли – G2, средний возраст 58,9±9,7.
2 группа – М1, рак желудка с выявленными метастазами в брюшину и большой сальник, 7 человек, степень дифференцировки опухоли– G2, средний возраст 53,4±11,9.
Непосредственно после оперативного вмешательства осуществляли забор следующих образцов: опухоль (ОП), перифокальная зона (ПЗ), сальник (СА), брюшина (БР), которые ex temporae помещались в раствор CellWash и подвергались дезинтеграции с использованием BD Medimachine в течение 30–60 сек. Полученную клеточную взвесь после фильтрования центрифугировали в течение 4 мин. при 1500 об/мин. в центрифуге Еppendorf 5702 R. Осажденные клетки ресуспендировали раствором CellWash.
Фенотипирование клеток осуществляли на проточном цитометре FACSCantoII (BD, USA) после их обработки панелью антител (CD45, CD44, CD133). Аналитические процедуры осуществляли в соответствии с указаниями фирмы - производителя наборов. Результаты определения клеток, имеющих маркеры ОСК (CD44+, CD133+), выражали в процентах от общего количества лимфоцитов CD45+-клеток либо от общего числа CD45--клеток.
Статистическая обработка полученных результатов предполагала расчет средних значений и стандартных отклонений. После проверки характера распределения проводили оценку статистической значимости различий между группами. В случае нормального распределения использовали параметрический критерий Стьюдента, в противном случае – непараметрический критерий Манна-Уитни. Различия считали статистически значимыми при р≤0,05.
Результаты исследования
Выявлены следующие особенности процентного содержания клеток с маркёрами опухолевых стволовых клеток в группе пациентов с раком желудка без метастатических поражений (М0), представленные на рисунке 1.
В группе М0 при степени дифференцировки опухоли G2 процентное содержание клеток с фенотипом CD45+CD44+ в ткани опухоли и брюшины статистически не отличалось и составило 3,4±1,4 и 3,8±1,6 соответственно. При этом отмечено увеличение клеток с данным фенотипом в сальнике - 8,4±4,5, что больше количества этих клеток в ткани опухоли на 147% (в 2,4 раза), р=0,002. В случае ПЗ не удалось определить клетки с данным фенотипом.
Определение клеток с фенотипом CD45-CD44+ позволило выявить следующие закономерности. Наибольшее количество клеток данного фенотипа выявлено в ткани БР – 1,1±0,5, что выше значений данного показателя в ОП (0,65±0,3) и СА (0,3±0,1) на 69% (в 1,7 раза) и 267% (3,7 раза) соответственно, р=0,001.
Другим маркёром опухолевых стволовых клеток является CD133+. Определение клеток, имеющих фенотип CD45+CD133+, выявило большее процентное число данных клеток в ткани ОП – 2,75±0,9. В БР и СА количество данных клеток было ниже значений в ОП соответственно на 60% (2,5 раза) – 1,1±0,4, и 93% (13,8 раз) – 0,2±0,05, р=0,02. В ПЗ клетки с данным фенотипом не определялись (рис. 1).
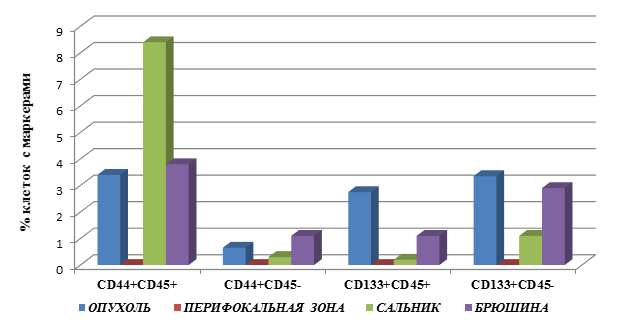
Рис. 1. Процентное содержание клеток с маркерами ОСК в тканях больных раком желудка, группа 1 (М0) – без метастатических поражений
Следует отметить, что определение процентного содержания клеток с фенотипом CD45-CD133+ имело аналогичные закономерности распределения, однако число данных клеток во всех тканях было выше, чем клеток с фенотипом CD45+CD133+. Максимальное число данных клеток выявлено в ОП – 3,35±2,7, затем в БР – 2,9±1,1 и в СА – 1,1±0,4. Полученные результаты меньше значений в ОП соответственно на 13% (в 1,2 раза) для БР и на 67% (в 3 раза) для СА, р=0,02. В ПЗ клеток с данным фенотипом не выявлено.
Таким образом, при раке желудка у пациентов без выявленных метастатических поражений в опухоли наблюдается накопление клеток с фенотипом CD45+CD133+ и CD45-CD133+, превышающее таковое в брюшине и сальнике. Кроме того, процентное содержание клеток с фенотипом CD45+CD44+ было выше в сальнике, а с фенотипом - CD45-CD44+ - в опухоли (рис. 1).
Выявлены следующие особенности процентного содержания клеток с маркёрами опухолевых стволовых клеток в группе пациентов с раком желудка, стадия дифференцировки опухоли G2 с метастатическими поражениями (М1), которые представлены на рисунке 2.
Наибольшее процентное содержание клеток с фенотипом CD45+CD44+ у больных раком желудка с метастатическими поражениями выявлено в ткани ОП – 19,8±4,5, в то время как в БР – 9,7±1,5, с практически одинаковым количеством данных клеток в ПЗ, СА – соответственно 4,4±1,5 и 4,2±1,2. Полученные значения ниже данного показателя в ОП на 79% (в 4,7 раза), 78% (4,5 раза) и 51% (в 2 раза) для СА, ПЗ и БР соответственно (для всех результатов р=0,03).
Обращает внимание тот факт, что у больных с метастатическими поражениями при РЖ по сравнению с данным показателем у пациентов без метастазов количество клеток с фенотипом CD45+CD44+ в ОП было выше на 482% (в 5,8 раза), в БР – на 155% (в 2,6 раза), а в СА – ниже на 50% (в 2 раза), р=0,03. Кроме того, данный тип клеток появляется в ПЗ пациентов группы М1, в то время как у больных М0 они не определялись (рис. 2).
Наибольшее количество клеток с фенотипом CD45-CD44+ у больных с метастазами отмечается в СА и ПЗ, соответственно 3,3±1,4 и 0,9±0,05, что превышает в 11 раз показатель у пациентов без метастазов (для СА). В ОП и БР данный тип клеток не выявлен при наличии метастазов, в то время как без них они определялись.
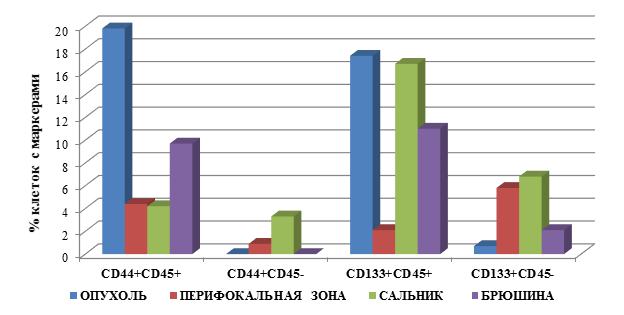
Рис. 2. Процентное содержание клеток с маркерами ОСК в тканях больных раком желудка, группа 2 (М1) – с метастатическими поражениями
При определении другого, менее часто используемого для идентификации ОСК РЖ маркера CD133, выявлены следующие особенности при наличии метастатических поражений.
Количество клеток с фенотипом CD45+CD133+ было максимальным в ОП и СА, соответственно 17,4±2,5 и 16,7±2,1, что выше значений у пациентов группы М0 в 6,3 и в 84 раза, т.е. максимальный прирост данных клеток выявлен в СА. В ПЗ у больных М1 группы количество было ниже на 37% (в 1,6 раза) по сравнению с значениями в ОП, но превышало значения данного показателя у пациентов без метастатических поражений в 10 раз. Следует отметить, что на фоне метастатических поражений данные клетки обнаруживаются и в ПЗ, чего не наблюдалось у больных РЖ без метастазов. Однако значение данного показателя было ниже на 88% (в 8,3 раза) количества данных клеток в ОП.
У больных группы М1 клетки фенотипом CD45-CD133+ в максимальном количестве определялись в СА, ПЗ и БР, соответственно 6,8±1,5, 5,8±1,8 и 2,1±0,3, в то время как в ОП их число было относительно невелико – 0,7±0,05. При этом, как правило, количество данных клеток существенно превышало данный показатель у больных без метастатических поражений в случае СА – в 6 раз (выше на 518%), в ПЗ эти клетки обнаруживались у пациентов с поражениями, в то время как без метастазов они не выявлялись. Однако количество клеток с фенотипом CD45-CD133+ снижалось у пациентов с метастазами в ОП и БР – отмечено снижение данного показателя на 79% (4,8 раза) и 28% (1,4 раза) соответственно, р=0,02.
Таким образом, у больных РЖ с метастатическими поражениями по сравнению с пациентами без метастазов (рис. 2):
- в ОП – увеличивается количество клеток фенотипа CD45+CD44+ и CD45+CD133+ и уменьшается число клеток CD45-CD44+ и CD45-CD133+;
- в ПЗ – отмечается рост числа клеток всех определяемых фенотипов CD45+CD44+ и CD45+CD133+, CD45-CD44+ и CD45-CD133+;
- в СА – снижается число клеток с фенотипом CD45+CD44+ и увеличивается число клеток остальных типов: CD45+CD133+, CD45-CD44+ и CD45-CD133+;
- в БР – увеличивается число клеток с фенотипом CD45+CD44+ и CD45+CD133+, а количество клеток CD45-CD44+ и CD45-CD133+, напротив, снижается.
Заключение
Проведенное исследование позволило выявить некоторые особенности распределения клеток, имеющих маркёры ОСК в различных тканях у больных раком желудка, что может в дальнейшем быть использовано при оценке особенностей развития и прогрессирования заболевания, эффективности проводимой терапии. Полученные результаты являются основой для дальнейшего научного поиска в отношении наиболее полной характеристики гетерогенной опухолевой популяции при раке желудка, роли отдельных клеток в росте, прогрессии и метастазировании опухоли.
Библиографическая ссылка
Сагакянц А.Б., Франциянц Е.М., Златник Е.Ю., Геворкян Ю.А., Солдаткина Н.В., Бондаренко Е.С., Самойленко Н.С., Ульянова Е.П., Шульгина О.Г., Дашков А.В., Каймакчи Д.О., Егоров Г.Ю., Гречкин Ф.Н. ЭКСПРЕССИЯ МАРКЕРОВ ОПУХОЛЕВЫХ СТВОЛОВЫХ КЛЕТОК ПРИ РАЗЛИЧНЫХ ФОРМАХ РАКА ЖЕЛУДКА // Современные проблемы науки и образования. 2018. № 5. ;URL: https://science-education.ru/ru/article/view?id=28129 (дата обращения: 15.02.2026).



